Введение
На сегодняшний день достаточно актуальной проблемой в мире является высокая распространенность хронической болезни почек (ХБП) среди населения. По данным на 2017 г., один из десяти человек в мире страдает ХБП [1]. Самая частая причина, приводящая к терминальной стадии ХПН, которая уступает только сахарному диабету и артериальной гипертензии, – гломерулопатии [2–4]. В большинстве случаев ХГН характеризуется необратимым прогрессированием патологического процесса, который приводит к формированию почечной недостаточности, значительно ухудшающей качество жизни пациента, приводящей к дисфункции внутренних органов и повышающей риск общей и сердечно-сосудистой смертности [5–7]. Одной из главных задач современной нефрологии является понимание механизмов утраты способности почечной ткани выполнять свою функцию и замещения ее соединительной тканью. На данный момент в развитии тубулоинтерстициального повреждения определена роль сложных процессов межклеточных взаимодействий, которые активизируются под влиянием иммунных и неиммунных факторов [8]. При ХБП нарушение функции эндотелия возникает задолго до развития структурных изменений в почках, играя значимую роль в формировании расстройств почечной микроциркуляции [9, 10].
Еще в начале ХХ в. стало известно, что ICAM-1 принадлежит к суперсемейству иммуноглобулинов, является одним из факторов эндотелиальной дисфункции. Основной функцией ICAM-1 является обеспечение адгезии нейтрофилов, моноцитов и лимфоцитов к активированному сосудистому эндотелию с последующей их экстравазацией и миграцией в очаг воспаления. ICAM-1 участвует также в контактных взаимодействиях клеток в иммунных реакциях: Т-лимфоцита с моноцитом, цитотоксического Т-лимфоцита с клеткой-мишенью [11].
Все это делает актуальным поиск маркеров ранней диагностики тубулоинтерстициального фиброза (ТИФ) и методов активного воздействия на них, что позволило бы предотвратить или отсрочить прогрессирование снижения почечной функции и выработать нефропротективную стратегию, основу которой составит воздействие на медиаторы воспаления и фиброза [12].
Цель. Определить влияние уровня ICAM-1 и других клинико-морфологических признаков при ХГН на развитие ТИФ при ХГН.
Материал и методы
В исследование были включены 80 больных ХГН в стадии обострения (из них 48 мужчин и 32 женщины, средний возраст обследованных составил 35,6±10,8 года). Медиана продолжительности ХГН составила 3 года [1; 7]. В группы были включены пациенты со следующими морфологическими формами ХГН: IgA-нефропатия – 44 человека, IgM-нефропатия – 2, фокально-сегментарный гломерулосклероз – 16, мембранозная нефропатия – 10, мембрано-пролиферативный гломерулонефрит – 2, болезнь минимальных изменений – 10 человек.
Пациенты с нефротическим вариантом течения заболевания составили 67,5%, нефритическими – 37,5%. ХБП распределялась по стадиям следующим образом: ХБП 1-й стадии – 1; 2-й – 25 человек, 3А-стадии – 11 человек, 3Б-стадии – 4 человека, ХБП 4-й стадии – 39 человек.
Всем больным проведено физическое обследование: собрали анамнез заболевания, оценили длительность течения и клинические проявления гломерулонефрита, наличие сопутствующих заболеваний, а также учитывались особенности лечения. Из лабораторных методов обследования при подготовке данного исследования учтены следующие показатели: сывороточный уровень ICAM-1 методом количественного иммуноферментного анализа (ИФА) (Luminex MAGPIX, США). Всем пациентам выполнена пункционная нефробиопсия с целью дальнейшего гистологического исследования методом световой микроскопии, иммуногистохимического метода и электронной микроскопии.
Статистический анализ полученных результатов проведен с помощью программ Microsoft Office Excel 2010 (Microsoft Corp., США) и «Statistica 10.0» (StatSoft Inc., США). С целью оценки типа распределения показателей в группе применены критерии Шапиро–Уилка. При значениях p>0,05 распределение считали не отличающимся от нормального. Описательная статистика включила следующие статистические показатели: Me [Q1;Q3] (Me – медиана, Q1 и Q3 – первый и третий квартили). При нормальном распределении выборки при сравнении двух независимых выборок использовали критерий Стьюдента, а при отличии от нормального – критерий Пирсона. Также применяли метод логистического регрессионного анализа и ROC-анализ информативности методов оценки вероятности наличия ТИФ при ХГН.
Результаты
В исследуемой группе медиана ICAM-1 составила 254,7 [217–274] нг/мл (рис. 1). Был проведен логистический регрессионный анализ, в ходе которого оценивалось влияние ICAM-1 в совокупности с клинико-морфологическими проявлениями на вероятность обнаружения в биоптате ТИФ. В итоге были получены уравнения регресса и оценки вероятности обнаружения в биоптате ТИФ при известных значениях ICAM-1 и ряда клинико-морфологических факторов риска (табл. 1).
Из приведенной выше табл. 1 становится понятным, что такие клинические и морфологические признаки, как уровень альбумина крови, сужение просвета артериол, склероз клубочков, совместно с повышенным уровнем ICAM-1 служат факторами развития ТИФ.
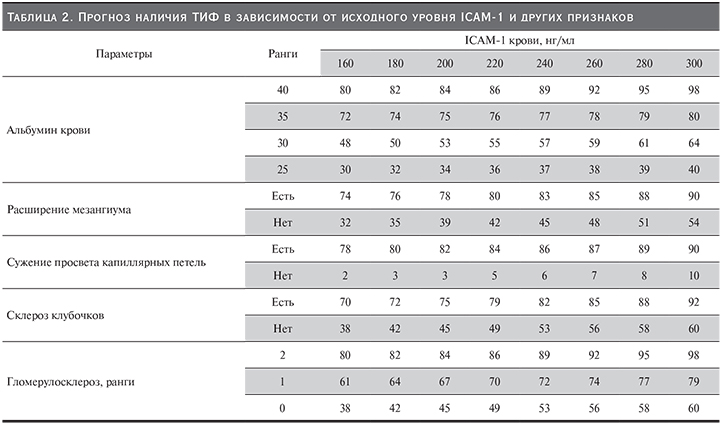
В качестве примера на рис. 2 приведены графики логистической зависимости вероятности обнаружения ТИФ от уровня ICAM-1 и такого признака, как выраженность гломерулосклероза.
На основании полученных уравнений логистического регресса нами были рассчитаны номограммы для прогнозирования вероятности обнаружения ТИФ в нефробиоптате (табл. 2).
Обсуждение
Факторы эндотелиальной дисфункции играют важную роль в развитии склероза почечной паренхимы и снижения клубочковой фильтрации. Так, в исследовании F. Mihout et al. выявлены корреляции между биомаркерами эндотелиальной дисфункции и разными уровнями скорости клубочковой фильтрации у больных ХБП, артериальной гипертензией, сахарным диабетом, что указывает на участие эндотелия в процессах склерозирования почечной ткани [13].
В исследовании J.T. Norman et al. говорится о том, что хроническая гипоксия, индуцированная прогрессированием эндотелиальной дисфункции, опосредует прогрессирование почечного фиброза даже на ранних стадиях ХБП [14]. Сывороточные уровни растворимых молекул адгезии VCAM-1, ICAM-1 коррелируют положительно со стадией заболевания почек по данным M.F. Attalah и L.A. Adel, D.E. Fahmy [15]. Данные, полученные в одном из японских исследований, свидетельствуют о том, что гломерулярная гиперфильтрация служит основной причиной гломерулосклероза, частично опосредуется экспрессией ICAM-1 и инфильтрацией макрофагов [16].
Вышеизложенные результаты исследований совпадают с полученными нами результатами и подтверждают участие ICAM-1 в развитии патологических профиброгенных процессов, происходящих при повышении ее концентрации при проведении нашего исследования.
Приведенные данные говорят о важности исследования факторов эндотелиальной дисфункции и уточнения их роли в развитии профиброгенных процессов в почечной ткани.
Заключение
Результаты исследования демонстрируют важную роль ICAM-1 в процессе развития иммунокомплексного воспаления при ХГН, которое приводит к прогрессированию фиброгенеза в почечной ткани и, следовательно, к снижению функции почек. Установлено, что повышение уровня ICAM-1 крови в совокупности с различными клиническими и морфологическими критериями может играть важную роль в развитии ТИФ и как следствие – в развитии ХПН.



