Под ампулярной карциномой (АК) подразумевают опухоли, анатомически связанные со следующими структурами [1]:
- дистальный (интерстициальный) отдел общего желчного протока и/или ампулярная часть главного панкреатического протока – интраампулярный компонент;
- большой дуоденальный сосочек (БДС).
На долю АК приходится 0,5% от всех злокачественных опухолей желудочно-кишечного тракта. Возраст больных варьируется в пределах 30–85 лет (медиана – 60 лет) с преобладанием мужчин в 1,5 раза [2]. АК характеризуется наиболее высокими показателями 5-летней выживаемости (до 70%) и низкой частотой рецидивов [3]. Несмотря на прогресс, достигнутый в изучении молекулярной онкологии, спектр выявленных молекулярных нарушений в АК на сегодняшний день ограничен [4–7].
В зависимости от различий в экспрессии муцинов 1-го, 2-го и 5АС-типов, среди АК гистологически различают кишечный и панкреато-билиарный типы [4].
По данным литературы, многие авторы включают АК в группу опухолей с синдромом наследственного неполипозного колоректального рака (ННКРР-HNPCC), для которых характерны высокая частота микросателлитной нестабильности (МСН) из-за наличия герминальных мутаций в генах MSH2, MLH1, PMS2,MSH3, MSH6 и MLH3 [8].
МСН (MSI), или феномен RER+-фенотипа (replication error), впервые описан в 1993 г. при изучении карцином толстой кишки [9]. МСН возникает вследствие нарушения системы репарации неспаренных оснований (mismatchrepair, MMR) и проявляется как накопление аллелей с измененной длиной коротких повторов ДНК в злокачественной опухоли.
В настоящее время общепринятым способом анализа RER+-фенотипа в опухолях является тестирование при помощи стандартного набора микросателлитных маркеров, одобренного экспертами Национального института рака США (NationalCancerInstitute, NCI). Рекомендуемая панель включает два квазимономорфных мононуклеотидных микросателлита (BAT25 и BAT26) и 3 динуклеотидных маркера (D5S346, D2S123,и D17S250). Принято выделять микросателлитные стабильные и нестабильные опухоли. Карциномы, демонстрирующие укорочение длины повторов по двум и более маркерам основной панели или имеющие более 30% нестабильных локусов при использовании большего числа маркеров, принято относить к случаям МСН высокого уровня (MSI-H), эквивалентной RER+-фенотипу.
В случае изменения длины только одного локуса из пяти в основной панели или менее 10–20% других маркеров было предложено использовать термин «низкий уровень МСН» (MSI-L) [10].
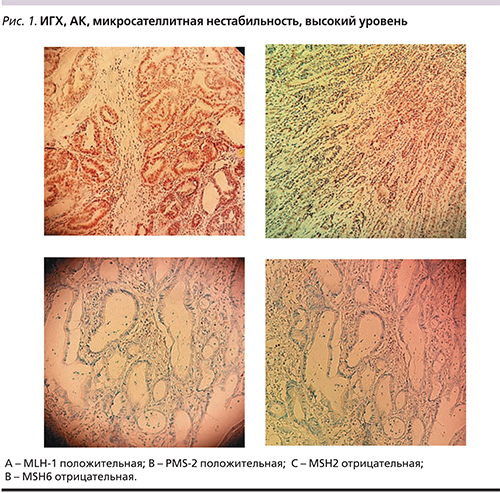
Частота МСН в АК варьируется от 12,5 до 22% (табл. 1). Тем не менее прогностическая значимость МСН в АК до конца не понятна.
С учетом этих данных целью настоящей работы стала оценка частоты и клинико-биологического значения МСН в АК.
Материал и методы
Работа основана на операционном материале, полученном от 31 больного АК, находившегося на лечении в учреждениях Москвы в 2003–2015 гг. Отмечено незначительное преобладание лиц мужского пола (1,3:1). Возраст больных колебался от 34 до 78 лет. Средний возраст мужчин составил 62, средний возраст женщин – 54 года.
Макроскопическое исследование резецированного органокомплекса проводили с использованием унифицированного алгоритма для АК [18]. Для дальнейшего микроскопического исследования материал фиксировали в 10%-ном забуференном растворе формалина, затем заливали в парафин по обычной методике. Серийные парафиновые срезы толщиной 3 мкм депарафинировали по стандартной схеме, окрашивали гематоксилином и эозином.
Выявление МСН в АК осуществлено в два этапа. На первом этапе применен иммуногистохимический метод – определен уровень белков системы репарации неспаренных оснований ДНК – MLH1, PMS2, MSH2, MSH6. В случае дефицита белков данной репаративной системы диагностировали МСН.
Дальнейшее подтверждение МСН проведено на образцах с наличием дефицита белков репаративной системы. Для молекулярного анализа в качестве источника ДНК использованы парафиновые блоки с помощью набора TIANampFFPEDNAKit (TIANGEN BIOTECH (BEIJING) CO, LTD, Китай). Образцы для молекулярного анализа содержали не менее 80% опухолевой ткани. В качестве контроля ДНК использовали неизмененную слизистую оболочку двенадцатиперстной кишки и лимфоциты в опухолевой ткани. Определение МСН проведено с помощью фрагментного анализа на приборе ABIPRISM 3500 (Life Technology, США). Использовали панель из 5 парных микросателлитных праймеров (NR21, NR24,BAT25, BAT26, BAT27).
Для определения микросателлитного статуса использовали те же критерии, что и для колоректального рака [19]:
- МСТ высокого уровня (MSI-H) – не менее 30% используемых маркеров нестабильны;
- МСТ низкого уровня (MSI-L) – нестабильны 10–30% маркеров;
- микросателлитная стабильность (MSS).
Силу и значимость связи между анализируемыми признаками оценивали с помощью корреляционного-регрессионного анализа. Для количественных признаков вычисляли корреляционный коэффициент Пирсона. За уровень статистической значимости принимали р<0,05 с использованием пакета программ Statistica для MicrosoftWindows, версия 6.0.
Результаты
В результате проведенного исследования, согласно классификации Adsay V, установлено, что по локализации преобладали ампулярно-двенадцатиперстные АК – 67,7% случаев (21/31), реже встречались ампулярно-протоковые – 19,3% (6/31) и интраампулярные – 12,9% (4/31). По гистологическому типу в зависимости от экспрессии муцинов 1-го, 2-го и 5АС-типов преобладала группа с кишечным фенотипом – 67,7% (21/31), группа с панкреато-билиарным типом выявлена в 29% (9/31) случаев.
В одном случае обнаружена коэкспрессия маркеров как кишечной, так протоковой дифференцировки и опухоль расценивалась как смешанный тип АК. Следует отметить, что во всех случаях АК панкреато-билиарного типа экспрессия муцина 1 сочеталась с экспрессией муцина 5АС, т.е. «истинного» панкреато-билиарного типа с изолированной экспрессией муцина 1-го типа, более характерного при протоковом раке поджелудочной железы, не обнаружено.
При анализе морфологических данных была выявлена прямая корреляционная зависимость между макроскопическим и гистологическим типами АК (r=0,67; р=0,001). Так, для ампулярно-двенадцатиперстного макроскопического типа характерен был кишечный гистологический тип, а для ампулярно-протокового – панкреато-билиарный.
В 90,3% (28/31) случаев АК была представлена местно-распространенными формами: рТ2-инвазия в стенку двенадцатиперстной кишки обнаружена в 35,5% (11/31) случаев; рТ3-инвазия в поджелудочную железу – в 41,9% (13/31); рТ4 – в 12,9% (4/31).
И лишь в 9,7% (3/31) случаев опухоль не выходила за пределы ампулы БДС.
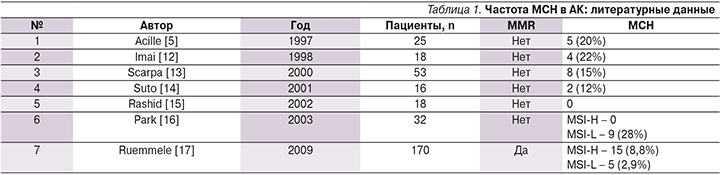
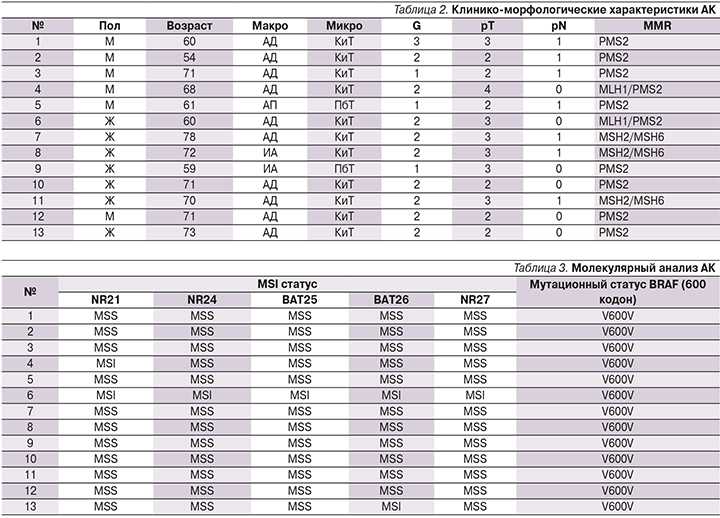
При определении уровня белков системы репарации неспаренных оснований ДНК дефицит белков диагностирован в 41,9% (13/30) случаев. При этом в большинстве (8/13) случаев обнаружен дефицит основания в гене PMS2. Сочетания MLH1/PMS2 (2/13) и MSH2/MSH6 (3/13) встречались реже (рис. 1). Основные морфологические характеристики приведены в табл. 2.
Мы не выявили статистически значимой связи между морфологическими характеристиками опухоли и наличием дефицита гена ДНК.
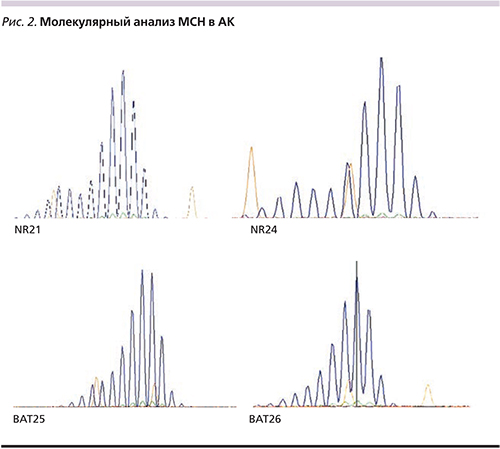
Далее в этих 13 образцах провели молекулярный анализ (табл. 3). В двух случаях выявили статус MSI-L и только в одном – статус MSI-H (рис. 2). Опухоли со статусом MSI-L и микросателлитные стабильные опухоли были объединены в одну группу для удобства статистической обработки. Во всех случаях отсутствовали как семейный анамнез заболевания, так и синхронные/метахронные опухоли других локализаций.
Мутаций гена BRAF не было обнаружено ни в одном случае.
Заключение
Проведенное исследование показало, что в АК МСН присутствует в 16,7% спорадических карцином и характерна для опухолей с кишечным иммунофенотипом, встречаясь примерно с такой же частотой, что и при колоректальной карциноме [20]. Мутации гена BRAF в нашей серии не обнаружены.
В единственном обнаруженном случае МСН высокого уровня с потерей белков репарации ДНК можно расценить как предиктивный фактор наследственного рака.



