Мультидисциплинарный подход к лечению нейроэндокринных опухолей
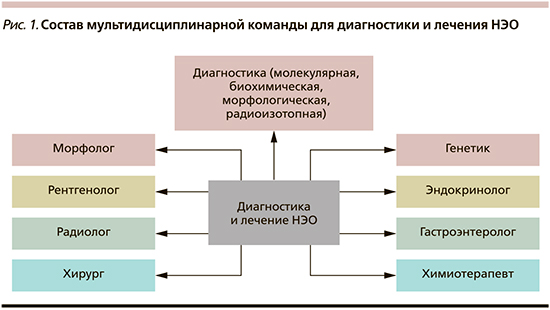
Мультидисциплинарный подход в настоящее время считается оптимальным методом диагностики и ведения пациентов с редкими (орфанными) заболеваниями, такими как нейроэндокринные опухоли (НЭО). Такой подход связан с улучшением качества и сроков диагностики, выстраиванием наиболее рационального индивидуального алгоритма лечения пациентов, повышением их выживаемости, снижением затрат на лечение за счет исключения использования неэффективных препаратов. В состав мультидисциплинарной команды входят специалисты многих смежных медицинских дисциплин: терапевты, эндокринологи, гастроэнтерологи, специалисты всех онкологических специальностей – хирурги-онкологи, химиотерапевты, специалисты диагностической и интервенционной радиологии, онкопатологи, генетики, а также медицинские сестры, имеющие опыт работы с НЭО (рис. 1). Сложные случаи НЭО рассматриваются на мультидисциплинарном консилиуме, на который при необходимости приглашаются более узкие специалисты – гинекологи, отоларингологи, невропатологи, нейрохирурги и др.
НЭО долгое время встречались редко, но с 1973 г. во всем мире наблюдается 5-кратный рост заболеваемости этими опухолями и пациентов с ними становятся все больше во всех онкологических клиниках мира [1, 2] В настоящее время НЭО представляют собой серьезную клиническую проблему, поскольку являются гетерогенной группой злокачественных новообразований, которые могут возникать в любых органах человека, характеризуются очень широким спектром морфологических и функциональных особенностей и различным биологическим потенциалом [3]. Спектр НЭО включает опухоли с низким потенциалом злокачественности и очень медленным ростом (Grade-1 и часть Grade-2), опухоли с умеренным злокачественным потенциалом (Grade-2 и Grade-3) и чрезвычайно агрессивные опухоли с очень быстрым ростом и высоким потенциалом метастазирования (мелкоклеточные [МК НЭК] и крупноклеточные нейроэндокринные карциномы [КК НЭК]). Кроме того, НЭО возникают из клеток эндокринных желез или диффузных эндокринных клеток и обладают способностью продуцировать неконтролируемые количества различных гормонов с широким спектром клинических проявлений и гиперфункциональных синдромов. Основные причины поздней или ошибочной диагностики НЭО: отсутствие доступа пациентов к чувствительным и специфическим методам диагностики, возможностей и достаточного опыта лечения этих опухолей в региональных медицинских учреждениях, недостаток высококачественных клинических испытаний новых лекарственных средств. Чтобы стимулировать развитие региональных междисциплинарных экспертных центров (МДЭЦ) и проведение многоцентровых клинических испытаний, Европейское общество нейроэндокринных опухолей (ENETS) выступило с инициативой по установлению критериев для сертификации и создания центров НЭО (Centre of Excellence [CoE]) по всей Европе [4, 5]). Позже дочерняя организация ENETS, Североамериканское общество нейроэндокринных опухолей (NANETS), постулировала несколько иной подход к стандартизации медицинской помощи в Северной Америке, выпустив свои первые оригинальные руководства по лечению НЭО, в которых междисциплинарная помощь рассматривается как наиболее эффективная стратегия лечения [6]. С этого момента мировым трендом и «золотым» стандартом оказания медицинской помощи при НЭО мировое медицинское сообщество считает создание МДЭЦ. В настоящее время во многих развитых странах сеть таких центров постоянно разрастается. Так, в Европе к 2008 г. были созданы и аккредитованы ENETS 35 МДЭЦ, в Америке – 1, в Австралии – 1 [1, 5, 7].
Преимущества лечения НЭО в МДЭЦ можно оценить по результатам, опубликованным S. Singh и C. Law [7], на примере Центра рака Одетты Саннибрук в Торонто (Канада), созданного в 2009 г. Самыми важными принципами работы центра авторы считают следующие: проведение за одно посещение пациента с НЭО всех необходимых ему консультаций, постоянное общение между медицинскими специалистами, а также проведение тематических конференций и консилиумов с обсуждением всех этапов лечения каждого конкретного пациента. Такой подход значительно сокращает время, которое проходит между постановкой диагноза и началом лечения, поскольку большинство врачей общей практики редко встречают подобных пациентов, недостаточно информированы о клинических проявлениях НЭО и методах их лечения. Клиника также активно работает в направлении информирования и обучения врачей с целью оказания ими ранней и многопрофильной помощи пациентам с НЭО, как новым, так и находящимся под длительным наблюдением. Медицинская информация о пациентах проверяется всеми специалистами, и это позволяет вырабатывать согласованный алгоритм; каждый пациент обсуждается на междисциплинарном консилиуме, включающем специалистов разных специальностей, принятые решения затем обсуждаются с пациентом и с лечащим врачом. Для больных, которые не живут в регионе, где находится МДЭЦ по лечению НЭО, разработанный в нем алгоритм лечения адаптируется к условиям ближайшего к месту проживания пациента медицинского учреждения. Очень важным звеном разработки всего алгоритма лечения пациентов с НЭО являются сотрудники отделения патологии, без участия которых невозможно правильно оценить тип и степень злокачественности новообразования, они также активно участвуют во всех консилиумах и исследовательских работах центра. Важным результатом создания МДЭЦ является возможность работающих в них специалистов стать экспертами в области лечения и диагностики НЭО, в которой остро не хватает специалистов, необходимых навыков ведения и лечения пациентов с этими новообразованиями. Такие центры имеют возможность на своей базе проводить устные или видеоконференции для облегчения сотрудничества с врачами в любом лечебном учреждении, что позволяет получать, передавать и обсуждать в реальном времени любые диагностические изображения, в т.ч. морфологические. Одна из главных целей центра, по мнению авторов, состоит в том, чтобы пациенты покидали его с корректно поставленным диагнозом, четко сформулированным и продуманным индивидуальным планом лечения, пониманием ими особенностей своего заболевания. Важной задачей работы МДЭЦ должно быть улучшение дизайна его работы и ухода за пациентами, чему должен способствовать анализ отзывов больных о своем лечении. В частности, в качестве примера авторы приводят историю одного пациента [7], у которого после нескольких ошибочных диагнозов и многих месяцев беспокойного ожидания был диагностирован НЭО с карциноидным синдромом. Его направили в онкологический центр, где начали курс химиотерапии. Однако после трех сеансов лечения компьютерная томография (КТ) показала, что злокачественные новообразования не уменьшились, а, напротив, увеличились в размерах. После этого пациенту предложили вернуться домой и продолжать динамическое наблюдение. Позже он обратился в другой онкологический центр, где ему предложили устаревшую схему лечения (пациент был очень информированным и читал специальную литературу о своем заболевании). Наконец он смог попасть в МДЭЦ, где при каждом визите его осматривали специалисты мультдисциплинарной команды: онколог, хирург, специально обученные медсестры. Они принимали решение о лечении коллегиально с патоморфологами и предлагали инновационные методы терапии. Пациент отмечает, что его слушают, ценят и уважают.
Создание МДЭЦ потребовало от энтузиастов преодоления ряда проблем и предубеждений, к основным из которых относятся плохая осведомленность специалистов всех уровней о биологической природе и злокачественном потенциале различных типов НЭО; сомнения многих коллег в целесообразности создания подобного отдельного центра в составе крупного онкологического медицинского учреждения; необходимость убедить тех, кто принимает решения, что большинство пациентов смогут лечиться по месту жительства и там получать системную терапию.
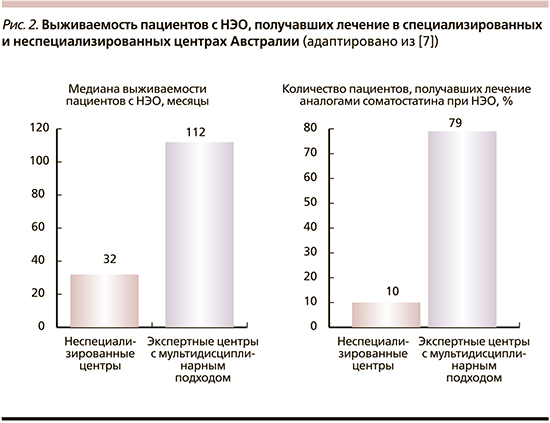
Еще один обзор, опубликованный А. Townsend et al. [8], в котором проведен ретроспективный анализ тенденций лечения пациентов с метастатическими НЭО в Службе здравоохранения Северо-Запада Аделаиды (Австралия), убедительно свидетельствует в пользу создания МДЭЦ. Авторы обнаружили значительные различия между выживаемостью пациентов с НЭО (112 месяцев) в специализированном отделении онкологии в МДЭЦ и в отделениях, где они получали стандартную медицинскую помощь с медианой выживаемости 32 месяца. При этом 79% пациентов, лечившихся в специализированном центре, получали аналоги соматостатина (АСС) по сравнению лишь с 10% пациентов, лечившихся у других специалистов (рис. 2). Сравнение медианы общей и 10-летней выживаемости у пациентов, получавших и не получавших АСС, не утешительно в отношении последних: 112 и 53 месяца, 40 и 22% соответственно.
По данным, опубликованным J. Strosberg et al. [9], средняя выживаемость 146 пациентов с метастатическими НЭО средней кишки, которые с 1999 по 2003 г. лечились в МДЭЦ Онкологического центра им. Х. Ли Мофитта, Тампа (Флорида, США), составила 103 месяца, 5-летняя выживаемость – 75%. Это очень хорошие результаты, и такая длительная выживаемость пациентов, по мнению авторов, связана с эффективным использованием в специализированных центрах всего спектра самых современных инновационных достижений в области лечения НЭО, включая своевременное назначение аналогов АСС.
Очевидно, что необходимы дальнейшие клинические исследования разработки новых вариантов лечения, но относительная редкость НЭО часто служит препятствием к широкому обсуждению этой проблемы. Анализ накопленного опыта по лечению пациентов с НЭО в разных центрах будет способствовать дальнейшим исследованиям в этой области, созданию международных баз данных пациентов с такой патологией, регистрации исследований в крупных центрах, испытанию и внедрению новых лекарственных средств и технологий. Все это приведет к дальнейшим успехам в лечении пациентов с НЭО, которые могут быть доступными только в крупных МДЭЦ.
Создание МДЭЦ по лечению НЭО в Российской Федерации
С учетом мирового тренда и тенденций в лечении НЭО в Российской Федерации (РФ) в апреле 2019 г. также был запущен проект по созданию МДЭЦ лечения НЭО и на данный момент уже было создано 6 таких центров.
Цели создания экспертных центров по диагностике и лечению НЭО:
- Увеличение выявляемости пациентов с НЭО (в т.ч. на ранних стадиях заболевания).
- Повышение выживаемости пациентов с НЭО.
- Организация маршрутизации пациентов с НЭО.
- Ведение регистра пациентов.
- Расчет потребности в лекарственном обеспечении.
- Контроль и повышение качества оказания медицинской помощи, наблюдение за пациентами.
- Увеличение количества и улучшение качества клинических исследований.
- Повышение узнаваемости центра.
Проект экспертных центров по НЭО в России включает следующие этапы:
- Иммуногистохимическая (ИГХ) диагностика – направление из региональных центров в экспертные лаборатории биопсийного материала пациентов для диагностики НЭО (минимальный набор маркеров – хромогранин А, синаптофизин, Ki-67).
- Биохимическая диагностика – скрининг на содержание хромогранина А в крови пациентов в сети лабораторий.
- В проекте участвуют следующие лаборатории: 6 патоморфологических лабораторий ведущих центров РФ, сеть лабораторий ИНВИТРО – филиалы в регионах России.
- География проекта: 32 субъекта РФ.
- Период реализации проекта: июнь 2019–декабрь 2020 г. (горячая линия проекта: 8-800-100-28-62 с 9–00 до 18–00 МСК).
В проекте участвуют следующие патоморфологические отделения по диагностике НЭО (участники проекта):
- ГБУЗ МО «МОНИКИ им. М.Ф. Владимирского», Москва (отв. – Л.Е. Гуревич, д.б.н., профессор, ведущий научный сотрудник морфологического отделения отдела онкологии).
- ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» МЗ РФ, Москва (отв. – В.В. Делекторская, д.м.н., руководитель патологоанатомического отделения).
- Санкт-Петербургское ГУЗ «Городской клинический онкологический диспансер» (отв. – Г.А. Раскин, д.м.н., руководитель патоморфологической службы).
- ГБУЗ «Клинический онкологический диспансер № 1», Краснодар (отв. – О.Ю. Чухрай, зав. патологоанатомическим отделением).
- ГБУЗ «Челябинский областной клинический центр онкологии и ядерной медицины», Челябинск (отв. – А.Б. Семенова, д.м.н., зав. лабораторно-диагностической службой).
- ГБУЗ «Областной онкологический диспансер», Иркутск (отв. – А.В. Тараненко, зав. патологоанатомическим отделением).
Предварительные итоги работы Экспертного центра по морфологической диагностике НЭО на базе ГБУЗ «МО МОНИКИ им. М.Ф. Владимирского» (сентябрь 2019–апрель 2020 г.)
В рамках проекта в 2019 г. на базе МОНИКИ был создан МДЭЦ по диагностике НЭО. МОНИКИ представляет собой современный региональный многофункциональный центр, в котором ведется лечебная и научно-исследовательская работа по различным направлениям (кроме акушерства и гинекологии, которое выделено в отдельный региональный институт – МОНИАГ), а также есть Факультет усовершенствования врачей всех специальностей. Наличие в институте всего спектра терапевтических и хирургических подразделений, а также отделений онкологии, радиологии, химиотерапии, патоморфологии, современных методов визуализации и лабораторных служб позволяет проводить на месте консультации и консилиумы по любым вопросам. Исторически так сложилось, что с 1980-х гг. в МОНИКИ активно занимаются проблемами диагностики и лечения опухолей эндокринных органов и НЭО. Эту работу долгие годы возглавлял руководитель отдела хирургической эндокринологии, член-корреспондент РАМН, профессор Ариан Павлович Калинин (1927–2016). В настоящее время заложенные им традиции не забыты и исследования в этом направлении продолжаются уже на современном этапе. В институте существует отделение не только хирургической (руководитель – проф. Т.А. Бритвин), но и терапевтической эндокринологии (руководитель – проф. А.В. Древаль), где работает высококвалифицированный коллектив сотрудников, хорошо знакомых с проблемами НЭО, в тесном сотрудничестве со специалистами отдела онкологии, патоморфологии и других отделений. Это позволяет проводить межотделенческие консультации, консилиумы, разрабатывать алгоритмы лечения пациентов и оперативно принимать решения.
Диагностику НЭО в рамках МДЭЦ в патологоанатомическом отделении МОНИКИ мы стали проводить с сентября 2019 г. с использованием ИГХ-маркеров – хромогранина А, синаптофизина, Ki-67 – и набора реактивов для Автостейнера Ventana Bench Mack Ultra. Наша группа по диагностике НЭО состоит из ведущего научного сотрудника, проф. Л.Е. Гуревич, научных сотрудников Е.В. Бондаренко и В.Е. Ашевской, руководителя отделения к.м.н. Д.Н. Федорова, лаборанта-гистолога Е.С. Зуевой и медрегистратора И.И. Лялинской. Данные о пациентах с подозрением на НЭО поступали через горячую линию в общую базу проекта, куда их ввел лечащий врач, затем материал доставляли в МОНИКИ сами пациенты, их родственники или знакомые, или он поступал с помощью курьерской службы. Поступающий материал обязательно должен был состоять из подробной клинической выписки и отобранных морфологом (по месту приготовления материала) информативных препаратов и парафиновых блоков.
ИГХ-исследование мы проводили в автоматическом режиме в соответствии с международными требованиями, с использованием стандартных контролей. В рамках работы Экспертного центра по морфологической диагностике НЭО пищеварительного тракта с использованием перечисленных выше маркеров исследование пациентов проводилось бесплатно. Больные подписывали информированное согласие на обработку личных данных и ИГХ-исследование в рамках этой программы. Также пациенты могли подписать на добровольной основе согласие на оплату на коммерческой основе дополнительных ИГХ- маркеров, если это будет необходимо для постановки окончательного диагноза. Дополнительную панель маркеров мы использовали в тех случаях, когда материал был представлен в виде диагностических биопсий метастазов из неизвестного первичного очага или если первичный диагноз НЭО не подтверждался и было необходимо поставить правильный диагноз.

С сентября 2019 по май 2020 г. мы провели тестирование 56 опухолей различной локализации (табл. 1). В 42 (75%) случаях поставленные диагнозы НЭО совпали, но в некоторых случаях уточнялась степень злокачественности (Grade). Во всех случаях, когда диагноз НЭО подтверждался, проводилось обязательное тестирование опухолей с целью определения экспрессии в них рецепторов к соматостатину 2-го и 5-го типов. В остальных 14 (25%) случаях диагноз НЭО не подтвердился или был существенно изменен. Самой большой была группа опухолей поджелудочной железы (ПЖ) – 16 случаев, из которых в 14 (87,5%) был поставлен диагноз НЭО, в 2 (12,5%) диагноз был изменен (КК НЭК вместо НЭО, солидно-псевдопапиллярная опухоль вместо НЭО ПЖ). Второй по величине была группа опухолей желудка – 15 случаев, из них в 11 (73,3%) диагноз НЭО подтвердился, в 4 (26,7%) он был изменен (2 случая рака желудка вместо НЭО и НЭК, GIST желудка вместо МК НЭК, эндокринноклеточная гиперплазия слизистой оболочки желудка вместо НЭО). При этом в трех случаях были выявлены множественные НЭО желудка (от двух до пяти опухолей у одного пациента), из которых в двух случаях все опухоли были Grade-1, в одном случае две опухоли были Grade-1 и Grade-2. Опухолей кишечника (тонкой, толстой и прямой кишки) было 13 случаев, из которых диагноз НЭО подтвердился в 9 (69,2%) случаях, в 4 (30,8%) был изменен (умеренно дифференцированная аденокарцинома толстой кишки вместо КК НЭК, КК НЭК вместо аденокарцинома и соматостатинома 12-перстной кишки вместо НЭО ПЖ, НЭО вместо болезни Крона). При определении локализации НЭО по метастазам опухолей неизвестной первичной локализации диагноз подтвердился в 7 из 12 (58,3%) случаев, в остальных 5 (41,7%) диагнозы были изменены (первичная НЭО аппендикса вместо первичной НЭО яичников, холагиокарцинома вместо НЭО печени, метастаз в ребро атипичного карциноида средостения вместо метастаза НЭО ПЖ в ребро, первичная НЭО печени вместо гемангиома печени, НЭО печени первичная вместо метастаза инсулиномы ПЖ в печень). Таким образом, хотя в большинстве (75%) случаев первичный диагноз НЭО подтверждался, у 25% пациентов он был неверным: чаще всего не совпадали диагнозы при опухолях желудка. Важно отметить, что в 19 из 42 (45,2%) случаев НЭО у пациентов уже имелись метастазы: в печень – 13, в лимфатические узлы – 3, в ребро – 1, в селезенку и надпочечники – 1, в яичники – 1 случай). Причин этого может быть несколько: а) опухоли были обнаружены на поздних стадиях; б) пациенты вообще не получали лечения; в) пациенты лечились, но не по эффективным для НЭО алгоритмам; г) был поставлен неверный диагноз.
Наличие метастазов у большинства пациентов с НЭО на этапе постановки диагноза полностью согласуется с опытом, нами накопленным за многие годы диагностики этих новообразований. При этом известно, что подавляющее большинство НЭО – это медленнорастущие опухоли Grade-1 и -2, которые часто прогрессируют и дают метастазы только после ≥5–10 лет роста. К основным проблемам и наиболее частым ошибкам при диагностике можно отнести следующие: поздняя и неверная диагностика этих опухолей; лечение пациентов у непрофильных специалистов; неправильная оценка Grade, существенно влияющая на выбор схемы лечения.
Хотелось бы привести примеры самых частых ошибок даже в случаях, когда ставится правильный диагноз НЭО. Так, ставится правильный диагноз «НЭО Grade-1» (или Grade-2), а заключительный диагноз в выписке лечебного учреждения звучит как «нейроэндокринный рак». Но это абсолютно разные опухоли и по своему биологическому потенциалу, и по выживаемости пациентов, и по подходам к их лечению. Лечащий врач по месту жительства читает эту выписку и начинает лечить пациента от «рака» со всеми сопутствующими результатами, т.е. в лучшем случае без особого эффекта, в худшем – происходит прогрессирование заболевания. Еще одной ошибкой является то, что большинству пациентов вовремя не назначают терапию АСС, которые существенно влияют на их выживаемость. Ну и конечно, неверно поставленный диагноз: чаще всего рак вместо НЭО или НЭК, или наоборот. Такие ошибки чаще всего встречаются в диагнозах опухолей желудка, толстой кишки и легких.
В многофункциональных центрах с мультидисциплинарным подходом все эксперты, участвующие в диагностике НЭО, постоянно контактируют друг с другом и пациенты своевременно и без промедления получают необходимые консультации и лечение.
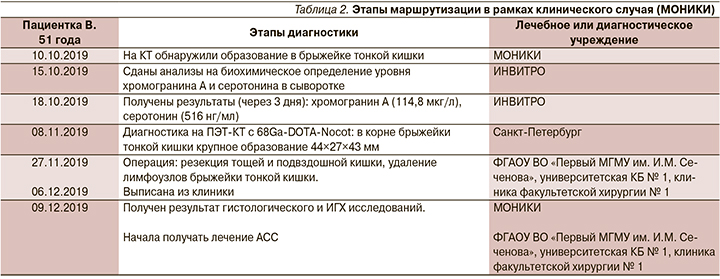
Проиллюстрировать преимущества Экспертного центра по диагностике НЭО мы бы хотели на одном клиническом примере. Пациентка В. 51 года в октябре 2019 г. обратилась в наш центр с жалобами на боли в брюшной полости, которые беспокоили ее в течение последних нескольких лет, а за последний год усилились. На КТ у нее обнаружили образование в брыжейке тонкой кишки, которое тесно прилежало (или прорастало?) к крупным сосудам, в результате чего первоначально больную признали неоперабельной. После консультации с морфологом было высказано предположение, будто это, возможно, НЭО (карциноид) тонкой кишки, поскольку у пациентки были эпизоды (не резко выраженные) приливов и диареи. Все этапы диагностики и лечения больной представлены в табл. 2. Пациентке было рекомендовано сдать кровь для определения уровней хромогранина А и серотонина, а также провести позитронно-эмиссионную КТ (ПЭТ-КТ) для уточнения локализации первичной опухоли, возможности ее хирургического удаления и выявления возможных метастазов. Данные лабораторных исследований были получены в течение 3 дней и подтвердили предполагаемый диагноз НЭО тонкой кишки с карциноидным синдромом (табл. 2). Анализ результатов ПЭТ-КТ с 68Ga-DOTA-Nocot позволил хирургам-онкологам сделать заключение о возможности удаления опухоли. Пациентка была прооперирована, метастазы в печени выявлены не были, но имелись метастазы в двух лимфатических узлах брыжейки. Удаленная опухоль (рис. 3) состояла из нескольких узлов, тесно прилежащих друг к другу и почти полностью перекрывающих просвет тонкой кишки, что в самое ближайшее время могло привести к кишечной непроходимости.

Макро-, микроскопические и ИГХ-особенности опухоли представлены на рис. 3, 4. Патоморфологичесий диагноз звучал так: «...высокодифференцированная нейроэндокринная опухоль подвздошной кишки, серотонин-продуцирующая (“типичный карциноид”) Grade-2. T4N1M0».

Поскольку у пациентки существует риск прогрессирования и наличие невыявленных метастазов и то обстоятельство, что в опухоли был выявлен высокий уровень экспрессии рецепторов по соматостатину 2-го и 5-го типов, ей было назначено лечение АСС.
В настоящее время пациентка находится под наблюдением, через определенные промежутки времени сдает анализы на определение уровня хромогранина А в сыворотке (это позволяет контролировать эффективность лечения, не пропускать возможный рецидив заболевания и вовремя корректировать схему лечения – дозу АСС, интервал приема, переход на другой АСС и т.д.).
В приведенном наблюдении все этапы – от постановки первичного диагноза до удаления опухоли и назначения эффективного лечения – заняли чуть больше 2 месяцев. Этот пример еще раз убедительно демонстрирует все преимущества получения пациентами с НЭО своевременной и эффективной помощи в экспертных центрах, специализирующихся на диагностике и лечении этих опухолей.
Определение экспрессии рецепторов к соматостатину в НЭО различной локализации ИГХ-методом
В связи со всем изложенным хотелось бы отдельно акцентировать внимание на роли определения экспрессии рецепторов к соматостатину в НЭО при терапии АСС. Функция гормона соматостатина как ингибитора гормона роста была описана в 1973 г. Соматостатин – мультифункциональный гормон, который секретируют клетки эндокринной, иммунной, центральной и периферической нервной систем, желудочно-кишечного тракта, ПЖ и многих других органов – плаценты, почек, сетчатки и др. Это универсальный эндокринный «коммуникатор» и «переключатель», обладающий эндокринным, паракринным и аутокринным действиями на соответствующие мишени на клеточной мембране, к числу которых относятся рецепторы к соматостатину (ССР) 5 типов – 1, 2, 3, 4 и 5. ССР экспрессируются клетками многих опухолей – большинства аденом гипофиза, НЭО желудочно-кишечного тракта, ПЖ, легких и других локализаций, а также менингиом, нейробластом и рядом других. Клиническое применение нативного соматостатина для лечения НЭО ограничено его коротким сроком жизни (примерно 2 минуты), поэтому были разработаны синтетические АСС с укороченными полипептидными цепями, образующие прочные связи с ССР. Клетки большинства НЭО экспрессируют одновременно несколько типов ССР, но чаще всего рецепторы 2-го и 5-го типов, с которыми преимущественно и связываются АСС, активно применяющиеся в настоящее время в клинической практике: октреотид и ланреотид. Выявление плотности ССР 2-го и 5-го типов на клетках НЭО позволяет в большинстве случаев существенно снижать, а в ряде случаев полностью ингибировать симптомы гиперфункциональных синдромов. Разные типы ССР имеют различную биологическую и функциональную активность: рецепторы 1-го, 2-го и 5-го типов регулируют пролиферативную активность клеток, секрецию гормонов, в частности, они осуществляют контроль секреции и выброса инсулина, а рецепторы 2-го и 3-го типов индуцируют апоптоз и обладают антионкогенными свойствами.
Поскольку НЭО до сих пор часто выявляют на поздней стадии, когда у пациентов уже имеются регионарные или отдаленные метастазы и радикально удалить опухоль не представляется возможным, в настоящее время в первой линии терапии распространенных или неоперабельных НЭО широко применяют АСС [10]. Это позволяет существенно снижать уровень гормонов, секретируемых опухолевыми клетками, а следовательно, ослабить угрожающие жизни симптомы эндокринных гиперфункциональных синдромов. Однако не все НЭО экспрессируют ССР и поэтому не отвечают на терапию АСС, поэтому очень важно еще до начала лечения пациентов этими препаратами определять наличие или отсутствие на опухолевых клетках ССР.
В 2016 г. мы опубликовали результаты анализа особенностей экспрессии ССР в 155 НЭО разных типов [11]. Полученные данные свидетельствовали о том, что большинство НЭО пищеварительного тракта независимо от их локализации (желудок, ПЖ, тонкий и толстый кишечник) интенсивно экспрессировали ССР-2, максимальный уровень которых был выявлен в опухолях тонкой кишки (84,6%), минимальный – в опухолях ПЖ (50%). Рецепторы ССР-5 чаще всего встречались в НЭО 12-престной кишки и других отделов тонкой кишки (в 85,4 и 58,3% случаев), реже в НЭО ПЖ – 17,8%. С 2016 г. наша база данных пациентов с НЭО, опухоли которых тестировали на наличие экспрессии ССР-2 и ССР-5, пополнилась, новые данные на представлены на рис. 5. ИГХ-исследование экспрессии ССР-2 и ССР-5 проводили в соответствии с методикой, разработанной М. Volante et al. [12], когда положительной считается выраженная мембранная экспрессия ССР-2 (2–3+), а для ССР-5 – мембранная или мембранно-цитоплазматическая экспрессия (2 и 3+). Клинически значимой считали соответствующую реакцию, выявляемую в большой популяции (более 40%) опухолевых клеток. Для ИГХ-исследования использовали кроличьи моноклональные антитела (клоны UMB-1, Epitomics Inc., ID-UMB4, Эпитомикс, США). Экспрессию Ki-67 (для определения Grade) оценивали по стандартной методике.
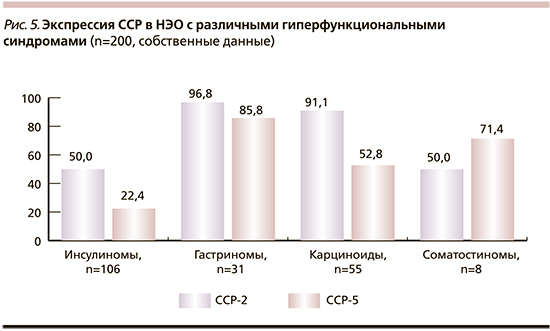
На рис. 5 представлена экспрессия ССР в 200 функционирующих НЭО с гиперфункциональными синдромами гипогликемии (инсулиномы ПЖ), Золлингера–Эллисона (гастриномы ПЖ и 12-перстной кишки), карциноидным синдромом (опухоли тонкой кишки – подвздошной и тощей) и синдромом соматостатиномы (опухоли ПЖ и 12-перстной кишки). Показано, что для гастрином и карциноидов характерен очень высокий уровень экспрессии ССР-2, которые определяются в 96,8 и 91,1% опухолей соответственно, несколько реже в них экспрессируются ССР-5 – в 85,8 и 52,8% опухолей соответственно.
Эти результаты позволяют сделать очень важный вывод: даже если нет возможности ИГХ-методом определить экспрессию ССР-2 и ССР-5 в функционирующих гастриномах и карциноидах, применение АСС для лечения этих пациентов и ослабления их клинически выраженных гиперфункциональных симптомов оправданно и эффективно. Другое дело инсулиномы и соматостатиномы – только 50% из них экспрессируют ССР-2 и 22,4 и 71,4% – ССР-5 соответственно. Для этих типов функционирующих опухолей очень желательно, скорее даже обязательно, проводить ИГХ-тестирование на наличие ССР-2 и ССР-5, в противном случае лечение АСС может быть неэффективным, будет потеряно время и зря потрачены средства. В таких случаях необходимо, минуя применение АСС, сразу переходить на другие схемы терапии.
Мы также поставили цель исследовать особенности экспрессии ССР-2 и ССР-5 в нефункционирующих НЭО ПЖ (НФ НЭО ПЖ) различной степени злокачественности – высокодифференцированных НЭО Grade-1, -2 и -3 и низкодифференцированных НЭК. Выбор этой группы опухолей был связан с тем, что они наиболее многочисленны (108 НЭО ПЖ) и это позволило получить более объективные данные (рис. 6). Группа НЭО Grade-2 – самая обширная, поскольку включает опухоли с очень широким спектром значений индекса пролиферации Ki-67 – от 3 до 20%. Поэтому мы разделили эту группу на 2 подгруппы в зависимости от степени злокачественности: НЭО Grade-2А с индексом пролиферации 3–10% и НЭО Grade-2Б с индексом пролиферации 10–20%. Левые столбики на диаграмме показывают суммарную экспрессию ССР во всей группе НФ НЭО ПЖ.
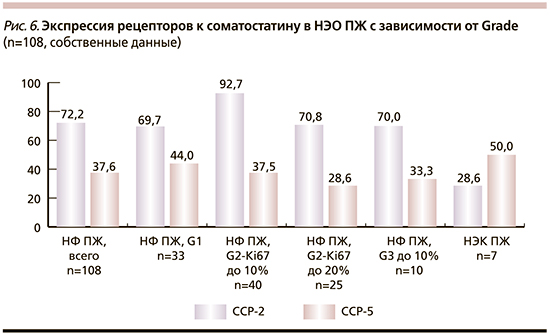
Как следует из рис. 6, во всех высокодифференцированных НФ НЭО ПЖ (и в их исследованных метастазах) уровень экспрессии ССР-2 был высоким – ≥70%, особенно высоким уровень этих рецепторов был в группе Grade-2А – 92,7%. Реже всего экспрессия ССР-2 выявлялась в НЭК – только в 28,6% опухолей. Уровень экспрессии ССР-5 во всех группах высокодифференцированных НЭО был значительно ниже, чем ССР-2: он варьировался от 28,6% в НЭО Grade-2Б до 44% в НЭО Grade-1.
Неожиданным оказался факт обнаружения экспрессии ССР-5 в 50% низкодифференцированных НЭК ПЖ, что было выше, чем во всех высокодифференцированных НЭО ПЖ. Таким образом, в большинстве высокодифференцированных НФ НЭО ПЖ уровень экспрессии ССР-2 был высоким, ССР-5 – низким. При этом только 28,5% низкодиффернцированных НЭК ПЖ экспрессируют ССР-2, 50% – экспрессируют ССР-5. Ранее сходные данные были получены H.A. Schmida et al. [13], которые показали, что при увеличении злокачественного потенциала НЭО-экспрессия ССР-5 увеличивалась.
Важный вывод этого исследования: большинство высокодифференцированных НФ НЭО ПЖ Grade-1, -2 и -3 экспрессируют ССР-2, реже – ССР-5. Показано, что использование АСС в лечении пациентов с НЭО ПЖ увеличивает сроки их безрецидивного выживания, стабилизация роста НЭО ЖКТ наблюдалась у 10–45% пациентов, а также наблюдалось уменьшение размеров опухолей [14]. При этом следует помнить, что в половине НЭК может выявляться экспрессия ССР-5, в трети – ССР-2, и это следует учитывать при выборе схем лечения этих агрессивных опухолей. Рекомендуется тестирование таких опухолей на наличие ССР. Хотелось бы также акцентировать внимание на том, что обязательное ИГХ-тестирование НЭО на наличие экспрессии ССР позволит до начала лечения исключить группу рецептор-негативных опухолей. Важно отметить, что не во всех случаях НЭО выявляется одновременная экспрессия ССР-2 и ССР-5, иногда в них присутствует только один из этих рецепторов, и необходимо исследовать оба. Высокодифференцированные НФ НЭО, такие как карциноиды тонкой кишки, обычно очень хорошо отвечают на лечение АСС со стабилизацией роста опухоли в течение многих лет.
Выводы
Анализ приведенных в работе данных убедительно свидетельствует о том, что Экспертные центры играют важную роль в диагностике и лечении нейроэндокринных опухолей. Это подтверждается и международной практикой, и опытом работы Российского экспертного центра по морфологической диагностике нейроэндокринных опухолей пищеварительного тракта на базе Московского областного научно-исследовательского клинического института им. М.Ф. Владимирского (МОНИКИ).
Мультидисциплинарный подход в настоящее время является оптимальным при диагностике и лечении нейроэндокринных опухолей, а дальнейшее расширение сети Экспертных центров позволит все большему числу пациентов получить доступ к самым современным методам лечения.



