Введение
В клинической практике каждого онколога есть пациенты с генерализованными процессами, которым мы вынуждены отказать в дальнейшем противоопухолевом лечении из-за его неэффективности. Однако многие больные настаивают на продолжении терапии и хотят продолжать борьбу с болезнью, несмотря на распространенность опухоли и ее резистентность к лечению. Эти люди предпочитают продолжать противоопухолевое лечение как можно дольше, в этом они видят принцип «жить до конца жизни».
В нашем арсенале немного препаратов, которые можно использовать для улучшения качества жизни паллиативных пациентов с неоперабельными прогрессирующими формами местных и диссеминированных форм злокачественных новообразований (ЗНО). Одним из них является гидразина сульфат (ГС), или Сегидрин, который применяется в клинической практике с 1994 г., зарегистрирован для лечения пациентов с распространенными формами ЗНО легких, первичных опухолей головного мозга (глиобластомы, астроцитомы и др.), нейробластомы, лимфогранулемы, лимфосаркомы, рака желудка и других органов желудочно-кишечного тракта, а также при десмоидах мягких тканей с инфильтративным ростом и опухолях других локализаций, при химиоиндуцированной и постлучевой цитопении.
По данным предшествовавших исследований доказано, что ГС (торговое наименование Сегидрин) способен подавлять рост опухолей и ингибировать моноаминооксидазную активность [1–3]. Он снижает проницаемость мембран клеток и биомембран субклеточных структур, является ингибитором метаболизма ксенобиотиков и применяется в виде пероральных таблеток для симптоматического лечения при распространенных опухолевых процессах [4–6]. Препарат не обладает миелодепрессивным и другими побочными эффектами, характерными для многих других противоопухолевых препаратов.
Эти и некоторые другие свойства ГС приводят к тому, что он повышает качество жизни, дневную активность онкологических больных, уменьшает выраженность болевого синдрома [4, 6, 7–8].
Поскольку в настоящее время имеются лишь разрозненные сведения о влиянии ГС на интенсивность боли у пациентов, получавших опиоидные анальгетики, целью нашего исследования было выяснить, насколько отечественный противоопухолевый препарат ГС (Сегидрин) способен влиять на обезболивание у паллиативных онкологических пациентов. Для этого было выполнено открытое многоцентровое рандомизированное исследование в виде научно-исследовательской работы «Опыт применения лекарственного средства Сегидрин у онкологических пациентов, получающих опиоидные анальгетики». В рамках указанной работы изучалось влияние длительного применения лекарственного препарата Сегидрин в дозе 120–180 мг в день в течение двух циклов (по 28 дней каждый) на качество жизни, выраженность болевого синдрома и потребность в опиоидных анальгетиках онкологических пациентов, получающих паллиативную помощь.
Для реализации цели исследования мы поставили следующие основные задачи:
- оценить влияние курсового применения препарата Сегидрин на интенсивность болевого синдрома у онкологических пациентов посредством оценки динамики интенсивности боли (ИБ) по нумерологической оценочной шкале (НОШ), оценить клинический (анальгетический) ответ на курсовое лечение препаратом и ежедневную потребность пациента в анальгетиках;
- оценить влияние препарата Сегидрин на качество жизни пациентов, оцениваемое посредством модифицированного опросника SF-36, Лидского опросника для оценки сна и шкалы депрессии Бека;
- оценить удовлетворенность пациентов от терапии Сегидрином на этапах исследования.
Методы
ГС назначался в дозе 120 мг/сут (1 таблетка дважды в день) пациентам с дефицитом веса, больные с нормальной массой тела принимали ГС в дозе 180 мг/сут (1 таблетка трижды в день). Первый курс длился 28 дней, затем следовал перерыв в 14 дней и в течение 28 дней проводился второй курс терапии.
Согласно протоколу, расписание визитов было следующим:
- визит 0 – скрининг;
- визит 1 – рандомизация, начало терапии;
- визит 2 через 14 дней (3-я неделя) от начала терапии;
- визит 3 через 28 дней (5-я неделя) от начала терапии.
Перерыв – 14 дней (2 недели).
- визит 4 через 42 дня (7 недель) от начала терапии;
- визит 5 через 56 дней (9 недель) от начала терапии;
- визит 6 через 70 дней (11 недель) от начала терапии.
Исследование проводилось в двух исследовательских центрах, в нем приняли участие 60 пациентов, полностью закончили исследование 57 больных, 3 пациента выбыли из исследования по собственному желанию из-за прогрессирования опухолевого процесса и/или невозможности перорального приема препарата (переход на парентеральные формы обезболивающих средств).
Исследуемая популяция состояла из онкологических пациентов с ЗНО различных локализаций, которые были включены согласно протоколу в одну исследуемую группу. Все пациенты имели ЗНО 3-й или 4-й стадии, их физическая активность составляла 2–3 балла по ECOG, болевой синдром находился на уровне «умеренная боль» и «сильная боль». Для терапии боли пациенты получали опиоидные анальгетики (трамадол, морфина сульфат, ТТС фентанила, пропионилфенилэтоксиэтилпиперидин – Просидол), а также терапию сопровождения: нестероидные противовоспалительные средства, адьювантные препараты (прегабалин, толперизон). Около 40% пациентов имели ЗНО органов пищеварения, 9% – женских половых органов, 6% – мочевыводящих путей, остальные локализации составили от 1 до 4%.
Результаты
1. Оценка влияния курсового применения ГС на интенсивность болевого синдрома.
При оценке изменения ИБ по НОШ (от 0 до 100%) выявлено, что на исходном этапе исследования (визит 1) в среднем по группе она составила 58,08±10,82%, на визите 3 снизилась до 48,25±12,24% (р<0,05). Полученный результат с учетом особенностей исследуемого контингента пациентов с ЗНО можно расценивать как хороший. Визит 4 (после 14-дневного перерыва в приеме ГС) характеризовался ИБ на уровне 52,08±10,10%, которая практически не изменилась спустя 4 недели на визите 6 (52,88±11,54%). Приведенные данные позволяют сделать вывод о снижении ИБ на этапах исследования, однако для полноценной оценки динамики ИБ по отдельным этапам был проведен анализ попарного сравнения усредненных показателей НОШ на визитах 3, 4 и 6 относительно исходного значения на визите 1 и между отдельными визитами (табл. 1).
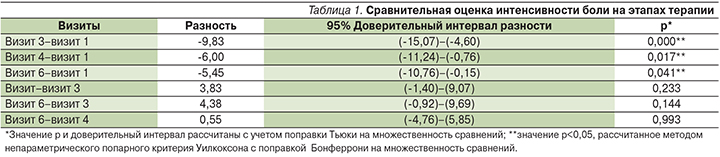
Анализ показал, что в целом имело место достоверное снижение ИБ на этапах исследования (визиты 3, 4, 6) относительно исходного визита 1. Наилучший результат отмечен через 28 дней терапии на визите 3.
В соответствии с общепринятой методикой нами была проведена оценка клинического ответа на курсовое применение ГС на основе изменений показателей ИБ по НОШ (усиление, стабильный уровень, ослабление; табл. 2).

Проведенный одновыборочный тест показал, что доля (16%) пациентов, у которых боль усилилась, достоверно ниже таковой пациентов, у которых боль ослабла или не изменилась (84%; p<0,01).
Через 28 дней приема препарата на визите 3 было выявлено ослабление ИБ у 42 (70%) пациентов (в интервале от 5 до 35% по НОШ), боль усилилась у 6 (10%) больных (на 10–15%) и осталась без изменений у 12 (20%) пациентов.
Среди пациентов, отметивших то или иное снижение ИБ, было выявлено 15 (25%) больных, ответивших на лечение (снижение ИБ по НОШ на 20% и более) и 8 (13%) пациентов с клинически значимым ответом на лечение (снижение ИБ на 30% и более). Пациентов, отметивших снижение боли на 50% и более на визите 3, не было.
2. Оценка динамики потребности пациентов в опиоидных анальгетиках.
Для оценки динамики ежедневной потребности пациентов в опиоидных анальгетиках все эти препараты были приведены к единому трамадоловому эквиваленту. Это позволило проследить динамику использования пациентами опиоидов на всех этапах исследования.
К завершению исследования (визит 6) были выявлены следующие показатели:
- 16 (26,7%) пациентов получали стабильную дозу опиоидных анальгетиков (200–300 мг трамадола);
- у 10 (16,7%) пациентов доза опиоидов была увеличена, из них 5 больных переведены на более сильные препараты (морфин пероральный –2 пациента, ТТС фентанила – 2 пациента, морфин пероральный и Просидол – 1 пациент);
- 3 (5%) пациента вышли из исследования по причине активного прогрессирования опухолевого процесса, появления резкой слабости, усиления ИБ (двое переведены на ТТС фентанила, одна пациентка продолжала принимать трамадол в дозе 50 мг/сут);
- у 31 (51,7%) пациента к концу исследования доза трамадола была снижена, в т.ч:
- у 5 пациентов трамадол был отменен (с визита 4–5);
- у 2 пациентов доза была снижена со 100–200 до 50 мг/сут;
- у 15 пациентов доза снижена с 200 до 100 мг/сут;
- у 3 пациентов доза снижена с 200 до 150 мг/сут;
- у 5 пациентов доза снижена с 300 до 200 мг/сут;
- у 1 пациента, получавшего морфина сульфат 40 мг/сут (перорально) на визите 1, боль значительно уменьшилась, морфин был отменен, пациент принимал трамадол начиная с визита 3 по 200 мг/сут.
Таким образом, можно заключить, что около половины больных, принимавших препарат Сегидрин, к концу исследования снизили дозу трамадола, при этом 25% уменьшили его прием в 2 раза, 12% полностью прекратили применение.
3. Оценка влияния ГС на качество жизни пациентов (по данным опросников SF-36, Лидского опросника оценки сна и шкалы депрессии Бека).
Были оценены 8 шкал опросника SF-36, а также результирующие показатели «физический компонент здоровья» и «психологический компонент здоровья» (табл. 3).
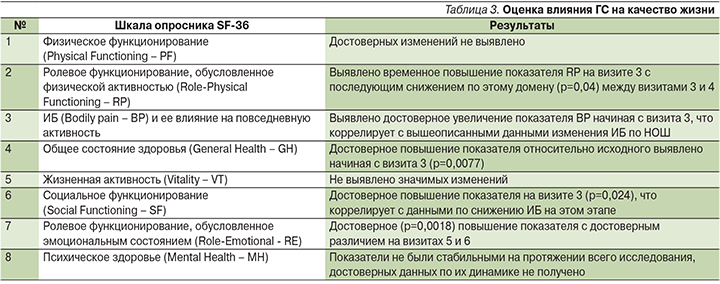
Анализ интегративного показателя «Физический компонент здоровья» (Physical health – PH) показал, что, несмотря на имевшие место положительные изменения по отдельным ппунктам опросника, в целом он имел отрицательную динамику (табл. 4). Это говорит о повышении эффективности обезболивающей терапии, но только в состоянии покоя, без активной физической нагрузки, когда пациенты могут выполнять уход за собой, но не способны полноценно осуществлять профессиональную деятельность.
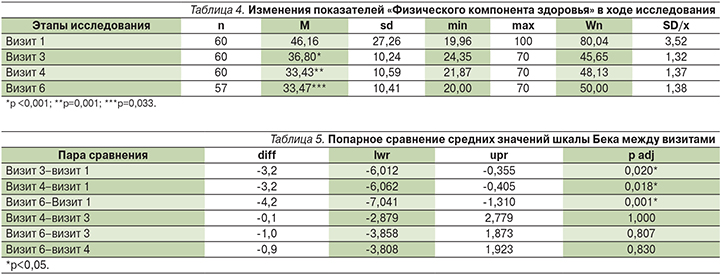
Интегративный показатель «психологический компонент здоровья» (Mental Health – MH) на протяжении исследования был стабилен относительно исходного состояния, без достоверных изменений по отношению к началу исследования.
Анализ средних величин уровня депрессии по Шкале Бека не обнаружил значимых изменений, однако попарное сравнение средних значений между визитами показало достоверное разлиие между визитами 3, 4 и 6 относительно исходного визита 1 и недостоверные различия в остальных вариантах (табл. 5).
В целом более половины (54%) пациентов отметили ослабление общего депрессивного состояния, 23% не обнаружили изменений и 13% пациентов показали увеличение уровня депрессии. Эти показатели коррелируют с изменениями ИБ по НОШ.
Изменение показателей Лидского опросника для оценки сна показало, что к визиту 4 отмечается достоверное увеличение числа положительных субъективных оценок качества сна, относительно других визитов эти изменения не были продолжительными и к 6-му визиту число положительных оценок снизилось до исходного уровня. Таким образом, можно сделать вывод о временном улучшении качества сна у пациентов, получавших ГС, через 3–5 недель от начала приема.
4. Изменение показателей удовлетворенности лечением на этапах исследования.
Удовлетворенность терапией на этапах исследования оценивалась по 4-балльной шкале от 1 до 4: плохо – 1 балл, удовлетворительно – 2 балла, хорошо – 3 балла, отлично – 4 балла.
На этапах исследования эти показатели претерпевали значительные изменения как по средним величинам, так и по процентному распределению оценок пациентов. Начиная с визита 5 средний балл по шкале удовлетворенности лечением достоверно отличался от исходного уровня. К визиту 5 он увеличился на 0,40 до 2,67 балла (p<0,05), к визиту 6 – на 0,56 и составил 2,82 балла (p<0,01), что представлено в табл. 6.
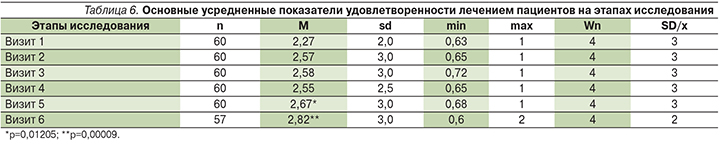
Доля пациентов, оценивших лечение на «хорошо», достоверно возросла как за первый (до 46,7%), так и за второй курсы лечения Сегидрином (61,4%). Однако при включении в статистический анализ поправки Холма на множественность сравнений статистическая достоверность сохраняется только при парном анализе показателей «визит 1–визит 6» (p=0,00098), а остальные пары визитов достоверности различий не демонстрируют.
Интегративный показатель положительных оценок («хорошо» и «отлично») по удовлетворенности лечением в конце исследования составил 71,9%.
Заключение
В ходе исследования отмечено достоверное снижение ИБ у онкологических больных через 28 дней от начала приема Сегидрина, что коррелировало с улучшением показателей отдельных доменов опросника SF36: «ролевое функционирование», «социальное функционирование», «общее состояние здоровья» и «интенсивность боли». Около половины пациентов, принимавших ГС (Сегидрин), к концу исследования снизили дозу основного опиоидного анальгетика трамадола (25% уменьшили в 2 раза, 12% полностью прекратили прием). Адекватный контроль боли на фоне снижения дозы опиоидных анальгетиков не оказал ожидаемого положительного влияния на итоговые интегративные показатели «физический компонент здоровья» и «психологический компонент здоровья» по опроснику SF 36, но нашел отражение в положительных изменениях показателей уровня депрессии по Шкале Бека, а также показателей «субъективное качества сна» по Лидскому опроснику сна. Динамика положительных оценок удовлетворенности пациентов лечением («хорошо» и «отлично») продемонстрировала достоверное повышение их числа только к концу исследования (между визитами 1 и 6).
Следует отметить, что в задачи исследования не входила оценка неблагоприятных эффектов ГС и его лекарственных взаимодействий. О них мы можем лишь косвенно судить по динамике показателей качества жизни. В целом препарат хорошо переносился пациентами, и тот факт, что более половины больных оценивают его влияние положительно, говорит о целесообразности применения Сегидрина у онкологических пациентов, которым по различным причинам отказано в противоопухолевой терапии. Препарат не заменит применения опиоидных анальгетиков, если они показаны, но может отсрочить их назначение, продлить период между прогрессированием опухоли и терминальной стадией процесса. Наш опыт применения Сегидрина говорит о том, что его не следует назначать пациентам в терминальной стадии, в случаях когда физическая активность минимальна. Наилучшие результаты при использовании Сегидрина мы отметили у пациентов, получавших небольшие дозы опиоидов, ведущих относительно активный образ жизни, проводящих 50% дневного времени в постели, хотя отдельные успешные клинические случаи наблюдались у пациентов с физической активностью 3–4 балла по ECOG. В последующих публикациях целесообразно систематизировать и описать этот клинический опыт.



