Введение
За последнее время опубликованы сведения, подтверждающие участие свободных радикалов в развитии различных заболеваний. В клинических исследованиях показано, что при заболеваниях разной этиологии наблюдается изменение однонаправленной реакции – снижение концентрации HS-групп в сыворотке крови больных. Белковые и низкомолекулярные компоненты тиолдисульфидной системы реагируют на любое воздействие изменением своего окислительно-восстановительного состояния, которое определяется соотношением концентрации (-HS) и (-SS) групп (HS/SS) или т.н. тиолдисульфидным соотношением (ТДС). Согласно этому, можно рассматривать ТДС как интегральный показатель адаптивных возможностей организма или показатель неспецифической резистентности к различным воздействием. Окислительный метаболизм в организме протекает при участии процессов свободно-радикального окисления антиоксидантных систем, обеспечивающих нормальную жизнедеятельность организма, являясь одним из базовых компонентов обмена и поддержания гомеостаза. Процессы свободно-радикального окисления контролируются антиоксидантной системой (АОС) организма, действие которой реализуется путем предотвращения образования потенциально опасных активных форм кислорода (АФК) с участием ферментов. Несостоятельность защитных механизмов способствует развитию окислительного стресса, что является ведущим фактором в патогенезе свободнорадикальной патологии [2]. Снижение функции АОС приводит к окислению липидных молекул под воздействием АФК и повреждению мембранных структур с нарушением их проницаемости для различных ионов [6]. В качестве инициирующих факторов окислительного метаболизма выступают АФК, относящиеся к свободным радикалам и обладающие регуляторным и токсическим действием в клетках организма, что определяет их важную роль в нормальной жизнедеятельности и при патологических процессах. Активность ферментов зависит от состояния свободно-радикального окисления, изменение которого отражается на состоянии мембранных протеинов и гомеостазе клеточных ионов [17]. Свободные радикалы представляют собой высокоактивные молекулы, которые, внедряясь в липопротеиновый слой клеточных мембран, инициируют цепную реакцию пероксидации липидов. В условиях избыточной генерации АФК вследствие влияния ионизирующей активности, инфекционного и токсического агентов, ишемии и других патологических факторов функциональная активность не способна обеспечить защитное действие, что приводит к тяжелому дисбалансу клеточного метаболизма и нарушению тканевого дыхания. Наиболее чувствительными к свободнорадикальному окислению являются сульфгидрильные группы мембранных белков, которые, связываясь с кислородом в реакциях взаимодействия, играют важную роль в развитии клеточной патологии [3, 4]. При нарушении окислительно-восстановительного гомеостаза избыточное количество АФК, превышающее защитные возможности клетки, вызывает клеточный стресс, окисление и разрушение многих клеточных компонентов – белков и липидов мембран – с высвобождением содержимого клетки в межклеточное пространство и повреждением ткани. Одним из ведущих звеньев АОС является система глутатиона, имеющая физиологическое значение в регуляции метаболических процессов организма [2, 3]. Антиоксидантными свойствами обладают сульфгидрильные группы, такие как серосодержащие (SH) группировки аминокислот. Эти группировки взаимодействуют с пероксидными радикалами и активными формами кислорода, восстанавливая их до нетоксичного состояния. Тиолдисульфидная система характеризуется обратимостью редокс-взаимопревращений тиолов и дисульфидов (2–HS↔SS–+2Н) и рассматривается как феномен образования дисульфидной связи, что лежит в основе биологической регуляции неспецифической адаптивной реакции организма. Тиолсодержащие соединения имеют в своем составе HS-группы и представлены в клетке в виде трипептида глутатиона, функционируя в клетке одновременно в восстановленном (-HS) и окисленном (-SS) состояниях. Восстановленная HS-группа обладает физиологической активностью, и концентрация (-HS) групп в несколько раз выше концентрации (-SS) групп. В восстановленном состоянии тиоловые белки обладают физиологической активностью, а глутатион поддерживает в клетке восстановительную среду, являясь основным компонентом редокс-буферной системы [3, 7].
Благодаря обратимости редокс-взаимопревращений тиолов и дисульфидов, тиолдисульфидная система и ее компоненты на любое воздействие реагируют изменением окислительно-восстановительного баланса, который определяется отношением концентрации (-HS) и (-SS) групп (HS/SS) или ТДС. Многочисленные исследования подтверждают роль глутатиона в экспрессии генов как уникального пептида, участвующего в защите клетки от свободных радикалов и реактивных разновидностей кислорода, а также в поддержании внутриклеточного редокс-гомеостаза [7, 11].
В настоящее время отмечается прогресс в изучении молекулярных механизмов, участвующих в регуляции редокс-гомеостаза клеток и тканей, активности ферментов клеточных мембран. По мнению авторов, функционирование клеток зависит от редокс-состояния и редокс-свойств внутриклеточной среды, причем изменение параметров редукс-состояния приводит к таковому метаболизма клеток [6, 7, 9]. Таким образом, окислительная модификация белка и изменение его структуры и функций служат результатом общего молекулярного механизма повреждения клетки и могут быть использованы в качестве критерия раннего патологического процесса.
Имеются данные об участии тиолдисульфидной системы и дисбаланса ее в сторону дисульфидов у больных целиакией. Приведенные сведения указывают на важную роль тиолсодержащих редокс-белков – тиоредоксина, пероксиредоксина и глутаредоксина – в поддержании клеточного редокс-гомеостаза и редокс-зависимой регуляции пролиферативных процессов и процессов дифференцировки и апоптоза клетки, что свидетельствует о важном участии этих ферментов в АОС [7, 14].
Высокое содержание пролина в глиадине и схожих белках пшеницы и других злаковых культур способствует их неполному перевариванию в кишечной стенке, токсичные олигопептиды с высоким содержанием пролина и глутамина накапливаются в тонкой кишке и оказывают токсические эффекты на ее слизистую оболочку (СОТК) у генетически предрасположенных лиц [13, 15, 17]. Эти процессы приводят к повреждению эпителиального барьера и повышению его проницаемости, активации иммунного ответа (врожденного и приобретенного) с последующей атрофией СОТК. Взаимоотношения оксидативного стресса и целиакии изучены в ряде исследований на клетках СОТК и клетках крови [10, 14, 16]. В образцах биоптатов СОТК больных активной формой целиакии выявлены высокие уровни простагландина Е2, в то время как активность антиоксидантных ферментов глутатионпероксидазы и глутатионредуктазы была низкой и сопровождалась снижением количества глутатиона. В некоторых исcледованиях также показана важная роль при целиакии реактивных форм азота, например повышение количества монооксида азота (NO). Увеличение активности фермента нитрооксидсинтазы (iNOS) выявлено в энтероцитах пациентов, не получавших аглютеновую диету (АГД), с частичной ее коррекцией на фоне соблюдения АГД.
С помощью достижений протеомики внесен важный вклад в понимание патогенеза целиакии, где цитотоксический и иммуномодулирующий эффекты зависят от аминокислотной последовательности регионов глютена. Некоторые регионы запускают оксидативный стресс и способствуют высвобождению провоспалительных цитокинов в СОТК. Элиминация глютена из рациона питания приводит к улучшению клинического состояния больных целиакией [8, 12, 14, 18].
Поскольку патологический процесс сопровождается усилением свободнорадикального окисления и ослаблением активности АОС, весьма актуальной представляется оценка состояния этих систем с целью ранней диагностики и патогенетически обоснованного лечения заболеваний. В связи с этим функциональное состояние тиолсульфидной системы и ТДС имеет важное значение при оценке эффективности патогенетической терапии целиакии [1, 2, 4, 6].
Цель данного исследования состояла в оценке состояния тиолдисульфидной системы у больных целиакией и возможности ее использования в качестве критерия эффективности АГД.
Методы
В исследование был включен 81 пациент с диагнозом целиакии, верифицированным на основании клинических, гистоморфологических данных и генетического анализа крови. Перед началом исследования все пациенты подписали информированное согласие в соответствии с этическими нормами, представленными в Хельсинской декларации Всемирной медицинской ассоциации от 2000 г., и требованиями, изложенными в основных нормативных документах РФ по клиническим исследованиям.
Критерии включения в исследование:
- возраст старше 18 лет;
- верифицированный диагноз «целиакия» по совокупности данных;
- наличие подписанного информированного согласия.
Критерии исключения из исследования:
- пациенты с воспалительными заболеваниями кишечника, синдромом раздраженного кишечника;
- пациенты с другими генетическими заболеваниями желудочно-кишечного тракта;
- наличие тяжелых сопутствующих заболеваний, включая сердечно-сосудистую, дыхательную, печеночную и почечную недостаточность;
- женщины в период беременности и лактации;
- отсутствие подписанного информированного согласия.
Обследованным проведены клинико-анамнестическое исследование и лабораторные исследования согласно стандартизированным методикам, включившим клинический анализ крови, исследование крови на генетический профиль – HLA-типирование, определение тиолсульфидных групп в крови с подсчетом ТДС.
HLA-типирование крови выполнялось для уточнения генетической предрасположенности к целиакии в независимой лаборатории «МедЛаб». При проведении данного анализа использовалась венозная кровь для выявления DQ2 и DQ8 гаплотипов методом ПЦР.
Антиоксидантная защита организма оценивалась по состоянию неферментативного звена АОС – содержанию восстановленных (-SH) и окисленных (-SS) групп и их соотношению (SH/SS), отразившему буферную емкость АОС, а также по уровню общей антиокислительной активности плазмы крови.
Исследование тиолдисульфидной системы крови проведено с использованием метода амперометрического титрования. Количество (-SH) групп осуществлено титрованием раствора азотнокислого серебра. Количество (-SS) групп соответствовало разности между показателями токового сигнала при известном избытке ионов серебра и после внесения раствора NaSO3. Расчет ТДС проведен по формуле «К=SH/SS» [15].
Для оценки состояния слизистой оболочки (СО) двенадцатиперстной кишки (ДПК) и эффективности применения АГД проведено гистоморфологические исследование биоптата залуковичного отдела ДПК, полученного при эндоскопическом исследовании. В полученном материале (от 5 до 15, в среднем 6–7 участков) рассчитывали линейные и количественные показатели с последующим вычислением средних величин, оценка которых проводилась путем сравнения с показателями здоровых добровольцев (табл. 1).
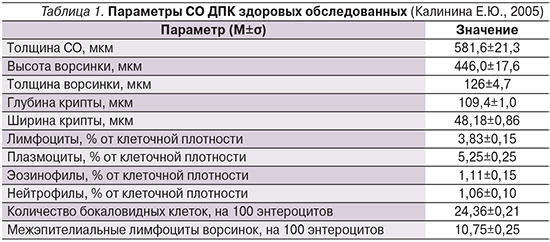
Признаки хронического дуоденита определены по классификациям R. Whitehead (1990) и M.N. Marsh (1992). Согласно первой классификации, выделяли I степень (слабую), II степень (умеренную) и III степень (тяжелую) выраженности хронического дуоденита, степень активности которого (слабая, умеренная, выраженная) определялась в зависимости от уровня нейтрофильной инфильтрации слизистой оболочки. По классификации M.N. Marsh морфологические изменения СО ДПК разделяли на четыре стадии: 1-я стадия – инфильтративная, 2-я – гиперпластическая, 3-я – деструктивная (3А – порциальная, 3В – субтотальная, 3С – тотальная атрофия ворсинок), 4-я стадия – гипопластическая.
Статистический анализ полученных данных проведен на ПК с использованием стандартного пакета пpогpамм «STATISTICA» v. 10 (StatSoft) с расчетом средних значений и критерия Стьюдента.
Результаты
В исследование участвовали пациенты в возрасте от 18–65 лет с верифицированным диагнозом «целиакия»; их средний возраст составил 31,4±11 года. Все пациенты были распределены на три группы. В первую группу вошли 24 человека, 14 из которых (58,3%) не соблюдали АГД, у 10 (41,7%) сроки соблюдения АГД были менее 6 месяцев. Во вторую группу были включены 25 больных, соблюдавших АГД от 6 месяцев до 1 года. Третью группу составили 32 пациента, соблюдавших АГД более 1 года. Контрольная группа имела схожие демографические характеристики с группой больных целиакией, включала 15 здоровых добровольцев без хронических заболеваний и лекарственного анамнеза.
Объективная оценка эффективности соблюдения АГД проведена с учетом показателей гистоморфологического исследования биоптата СО ДПК. По мере увеличения срока АГД у обследованных наблюдались закономерные признаки лечебного патоморфоза, заключавшегося в достоверном увеличении линейных и количественных показателей СО ДПК (табл. 2).
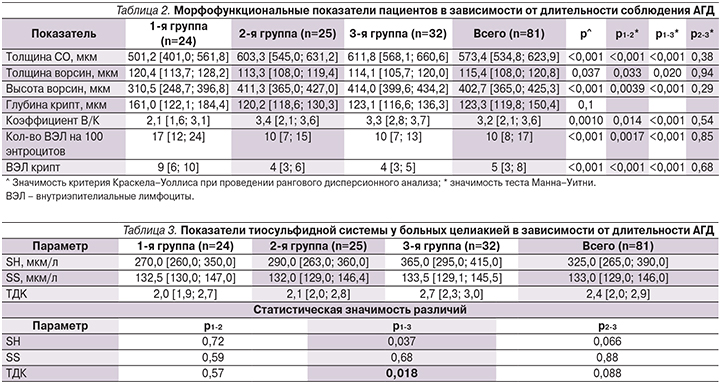
По результатам оценки неспецифической резистентности организма оказалось, что у обследованных больных целиакией уровень (-SH) групп был достоверно ниже такового по сравнению с группой здоровых добровольцев (480±25 мкмоль/л; p<0,001). Вывлено нарастание концентрации восстановленного тиола (-SH) у больных целиакией по мере увеличение сроков соблюдения АГД (табл. 3). Так, у пациентов 1-й группы концентрация (-SH) групп составила 270,0 [260,0; 350,0] мкмоль/л, 2-й группы – 290,0 [263,0; 360,0] мкмоль/л, 3-й группы –325,0 [265,0; 390,0] мкмоль/л. Статистически занчимыми были различия значений восстановленной фракции тиола у больных 1-й и 3-й групп (р=0,037). Значения показателя (-SS) групп не имели значимых различий у обследованных, однако у пациентов, длительно находившихся на АГД, наблюдалось незначительное повышение данного показателя.
С целью определения буферной емкости АОС определяли ТДК. В группе здоровых отмечено преобладание восстановленных форм над окисленными формами небелковых тиолов и ТДК составил 3,8±0,3, что указывает на функциональный баланс свободно-радикального окисления с преобладанием восстановительных процессов. При статистическом анализе результатов проведенного обследования выявлено достоверное (р<0,001) снижение ТДК во всех группах по сравнению с группой здоровых. Значения ТДК у больных целиакией в зависимости от сроков соблюдения АГД представлены в табл. 3. Следует отметить, что достоверно более высокий ТДК в группах больных целиакией отмечен у пациентов, соблюдавших АГД более года, что подтверждает восстановление оптимального баланса тиолдисульфидной редокс-системы на фоне патогенетичской терапии.
Таким образом, показатели внутриклеточного метаболизма у больных целиакией характеризуются сдвигом редокс-гомеостаза в сторону окислительных процессов за счет уменьшения концентрации (-SH) групп и снижения буферной способности АОС. Увеличение значения коэффициента ТДК по мере увеличения сроков АГД свидетельствует о снижении антиоксидантной активности у больных целиакией на фоне патогенетического лечения, направленного на элиминацию факторов, провоцирующих оксидативный стресс.
В литературе описано токсичное влияние глютена, заключающееся в активации цитокиновых реакций и процессов свободно-радикального окисления, приводящих к нарушению структуры энтероцитов и гомеостаза белквых редокс-систем [8]. Следовательно, изменения показателей тиолдисульфидной системы и структурные изменения кишечного эпителия у больных целиакией свидетельствуют о взаимосвязанных механизмах патогенеза, запускающим фактором которых можно считать глютен. Поддержание равновесия тиолдисульфидной системы следует рассматривать как молекулярный механизм биохимических процессов, участвующих в регуляции проницаемости клеточных мембран и метаболического функционирования. Элиминация глютена из рациона питания способствует уменьшению выраженности токсического повреждения кишечного эпителия и повышению защитной роли кишечного барьера у больных целиакией, что подтверждает антиоксидантное действие лечебного питания.
Из изложенного выше следует, что показатели тиосульфидной системы и линейные характеристики СО ДПК можно использовать как интегральную оценку окислительного повреждения мембранных структур и их проницаемости.
Обсуждение
Как известно, в патогенезе целиакии особую роль играют олигопептиды, которые, с одной стороны, оказывают цитотоксическое действие на энтероциты, вызывая атрофические изменения, с другой – запускают оксидативный стресс и способствуют высвобождению провоспалительных цитокинов у генетически предрасположенных лиц (DQ-2, DQ-2.5, DQ-7, DQ-8). Элиминация глютена из рациона питания приводит к ослаблению цитотоксичности и окислительного стресса, что улучшает клеточную устойчивость и устраняет клинические симптомы [3, 13]. Лечебное действие АГД при целиакии не вызывает сомнений, объективным подтверждением его эффективности является нормализация структуры СО ДПК по данным гистоморфологического исследования [5, 10, 12]. Учитывая роль глютена как стресс-фактора, запускающего системную реакцию оксидативного стресса, вызывающего окислительное повреждение молекулярных структур слизистых оболочек, целесообразно оценить состояние тиолдисульфидной системы у больных целиакией с учетом сроков соблюдения АГД. Самые низкие показатели ТДС определялись у пациентов с целиакией, не получавших патогенетическую терапию, что свидетельствовало о нарушении метаболических процессов за счет увеличения окислительного пула редокс-гомеостаза.
У пациентов с длительностью АГД до 6 месяцев показатели (-SH) и ТДК были снижены по сравнению с больными, соблюдавшими АГД от 6 месяцев и более года; установлены значимые различия этих показателей у пациентов с разным сроком длительности АГД, что свидетельствовало о повышении антиоксидантной активности организма и эффективности лечебного питания. Наблюдавшиеся изменения окислительно-восстановительного равновесия у больных целиакией, вырзившиеся указанными сдвигами в показателях ТДС, можно расценить как истощение адаптационного резерва организма у этих пациентов.
Заключение
Тиолдисульфидная система является особым объектом повреждения при целиакии и принимает непосредственное участие в молекулярных механизмах нарушений окислительно-восстановительного гомеостаза и неспецифической резистентности организма к повреждающему действию глютена.
При целиакии реализуются общие закономерности нарушения окислительно-восстановительных преобразований (-SH) и (-SS) групп белков, что позволяет отнести данное заболевание к свободнорадикальной патологии.
Закономерные изменения показателей тиолдсульфидной системы на фоне АГД, подтвержденные результатами гистоморфологического исследования, позволяют рекомендовать данную методику для оценки эффективности патогенетической терапии больных целиакией.



