Введение
Острая задержка мочи (ОЗМ) – это быстроразвивающееся патологическое состояние, при котором моча не поступает в мочеиспускательный канал и накапливается в мочевом пузыре. Внезапное возникновение данного состояния при неврологическом заболевании, как правило, сопровождается быстронарастающим неврологическим дефицитом. Так, если в случае ОЗМ, вызванной доброкачественной гиперплазией предстательной железы или другими органическими причинами, неотложные мероприятия на догоспитальном этапе направлены на купирование этого состояния, то при наличии неврологической симптоматики восстановление оттока мочи осуществляется в комплексе с другими неотложными действиями (восстановлением дыхания, глотания, дефекации и др.).
Среди наиболее вероятных причин возникновения нейрогенной ОЗМ можно считать следующие:
• ишемический инсульт;
• спинальный инсульт или преходящее нарушение кровообращение;
• миелит;
• рассеянный склероз (крайне редко);
• синдром Гийена–Барре;
• послеоперационная рефлекторная ОЗМ вследствие анестезиологического пособия (в т. ч. перидуральной анестезии);
• послеоперационная ОЗМ вследствие нейрохирургических пособий на головном или спинном мозге;
• опухоли головного и спинного мозга;
• прием противопаркинсонических средств.
До недавнего времени ОЗМ рассматривали исключительно как проблему мужского здоровья, поскольку наиболее частая ее причина в механическом препятствии по ходу мочеиспускательного канала, что в основном встречается среди мужчин преимущественно пожилого и старческого возраста. Известно, что свыше 10 % мужчин старше 60 лет имеют риск развития ОЗМ и этот показатель втрое увеличивается каждые 10 лет [S. Choong и соавт., 2000]. Вероятность развития ОЗМ у мужчин в возрасте старше 70 лет в 8 раз выше, чем в возрасте 40 лет.
Механизмы развития ОЗМ разнообразны:
• нарушение центральной и периферической регуляции мочевого пузыря, его сфинктеров и мочеиспускательного канала;
• последствия механических препятствий к мочеиспусканию, обусловленных различными заболеваниями мочевого пузыря, предстательной железы и уретры;
• травматические повреждения мочевого пузыря и мочеиспускательного канала;
• психогенно обусловленная задержка мочеиспускания;
• медикаментозная интоксикация.
Лекарственная терапия
Консервативное лечение нейрогенных нарушений мочеиспускания – это основной вид медицинских мероприятий и чаще всего включает использование медикаментов (фармакотерапии), а также другие методы неоперативного лечения.
Важную роль в функционировании нижних мочевых путей как в физиологических, так и в патологических условиях играет холинергическая иннервация. Сокращения детрузора осуществляются за счет прежде всего стимуляции мускариновых рецепторов. В настоящее время установлено наличие нескольких подтипов мускариновых (М) холинорецепторов (М1, М2, М3 и др.), различающихся как по строению, локализации и функциям, так и по отношению к агонистам и антагонистам.
Мочевой пузырь содержит М2- и М3-подтипы мускариновых холинорецепторов, его сокращения осуществляются благодаря активации относительно небольшой популяции М3-холинорецепторов.
Адренергическая (симпатическая) иннервация детрузора по сравнению с холинергической представлена в значительно меньшем объеме. В противоположность ситуации с детрузором в мышцах шейки мочевого пузыря, предстательной железе и мочеиспускательном канале (уретре), играющих важную роль в удержании мочи, широко представлены a1-адренорецепторы. Стимуляция β-адренорецепторов приводит к расслаблению детрузора и накоплению мочи. В мочевом пузыре имеется значительное количество т. н. нехолинергических неадренергических рецепторных представительств. Локализация и функция рецепторов нижних мочевых путей (НМП) представлены в табл. 1.
Как видно из табл. 1, в механизмах накопления и опорожнения мочевого пузыря участвуют различные нейромедиаторные системы. Именно указанные особенности парасимпатической и симпатической иннервации НМП являются основой выбора лекарственных препаратов различного механизма действия для лечения нейрогенных нарушений мочеиспускания. Основные мишени фармакотерапии представлены на рисунке.
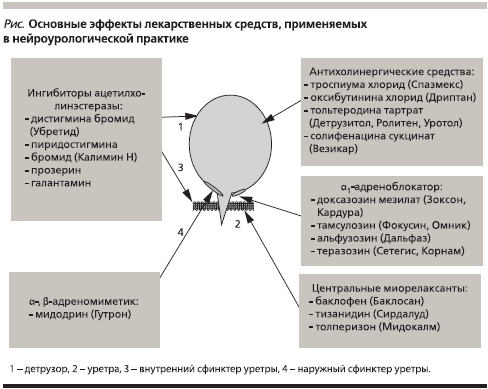
Ингибиторы ацетилхолинэстеразы
Лица с нарушением сократительной активности детрузора применяют ингибиторы ацетилхолинэстеразы – фермента, расщепляющего ацетилхолин на ацетил и холин, что приводит к накоплению нерасщепленного медиатора в синаптической щели и повышает степень взаимодействия последнего с мускариновыми постсинаптическими М2-, М3-рецепторами. К таким средствам относятся неостигмина метилсульфат, галантамин, пиридостигмина бромид, дистигмина бромид и ривастигмин (табл. 2).
Клинический эффект, который развивается в первые сутки приема, проявляется в появлении позывов на мочеиспускание, облегчении начала мочеиспускания, уменьшении объема остаточной мочи. Применение этих средств в сочетании с α1-адреноблокаторами позволяют купировать острую и хроническую нейрогенную задержку мочи в течение 1–2 недель постоянного приема. В тот же период пациентам с мочевыми дренажами целесообразно осуществлять тренировку детрузора, пережимая катетер или цистостомический дренаж по 3–4 часа в дневное время суток. Пациенты с цистостомическим дренажем могут осуществлять попытки мочеиспускания при возникающем позыве на пережатом дренаже. Больные с уретральным катетером могут производить подобные попытки после удаления дренажа.
Наряду с восстановлением мочеиспускания возможно купирование явлений атонического запора и восстановление половой чувствительности. В некоторых случаях отмечаются тошнота и учащенное мочеиспускание вплоть до императивного недержания мочи.
Альфа1-адреноблокаторы
Больным, страдающим детрузорно-сфинктерной диссинергией и псевдодиссинергией, показан прием α1-адреноблокаторов, с различной степенью избирательности блокирующих постсинаптические адренорецепторы шейки мочевого пузыря и гладкомышечного сфинктера уретры, конкурируя с норадреналином и вызывая их расслабление. К средствам с таким механизмом действия относятся празозин, альфузозин, доксазозин, теразозин и тамсулозин (табл. 3).
Эффект от начатой терапии развивается через 3–4 дня, достигая своего максимума к концу 1–2-й недели лечения и поддерживается при длительном приеме. Клинический эффект проявляется в облегчении начала мочеиспускания, уменьшении объема остаточной мочи. Побочные эффекты в основном связаны с ортостатическими реакциями (гипотензией).
Прием а1-адреноблокаторов в некоторых случаях позволяет уменьшать дозы антигипертензивных препаратов, в то же время лекарственные средства этой группы следует с осторожностью назначать пациентам, страдающим недостаточностью мозгового кровообращения. Другим побочным эффектом данных препаратов является некоторое улучшение качества эрекции. На функции прямой кишки препараты этой группы не влияют.
Центральные миорелаксанты
В комплексной терапии пациентов со спастичностью мышц тазового дна используют центральные миорелаксанты различных механизмов действия (баклофен, тизанидин, толперизон), принимаемые внутрь.
Баклофен – лекарственное средство, миорелаксант центрального действия, производное гамма-аминомасляной кислоты (ГАМКb-стимулятор). По структуре баклофен сходен с производными γ-аминомасляной кислоты (ГАМК): аминалоном и аминофенилмасляной кислотой. От последней отличается наличием атома хлора в пара-положении фенильного ядра. Фармакологические свойства баклофена иные, чем аминофенилмасляной кислоты и других ноотропных препаратов. Он является агонистом ГАМК-Б-рецепторов, а основное проявление его фармакологической активности – антиспастическое действие. Он угнетает спинальные и висцеральные рефлексы, уменьшает мышечное напряжение (снижает тонус скелетных мышц), клонус. Кроме того, оказывает анальгезирующее действие.
Предполагается, что угнетение моно- и полисинаптических рефлексов обусловлено уменьшением выделения возбуждающих аминокислот (глутамата и аспартата) из везикул, что происходит в результате стимуляции пресинаптических ГАМК-рецепторов. Следовательно, угнетающее действие препарата, наступающее спустя несколько часов после приема, может быть объяснено высвобождением аккумулированного чрезмерного потенциала ГАМКергических тормозных систем.
Тизанидин – миорелаксант центрального действия. По биохимическому действию является агонистом a2-адренорецепторов – преимущественно в спинальных восходящих нейронных сетях. Подавляет полисинаптические спинномозговые рефлексы и оказывает антиспастическое действие при повышенном мышечном тонусе, снимает спазмы и клонические судороги. По фармакологическим свойствам тизанидин сходен с толперизоном и баклофеном, но отличается от них механизмом действия. Так, баклофен повышает активность тормозной ГАМКергической медиаторной системы, а влияние тизанидина связано с уменьшением высвобождения из интернейронов возбуждающих медиаторных аминокислот.
Толперизон оказывает сложное влияние на центральную нервную систему (ЦНС): блокирует полисинаптические спинномозговые рефлексы, уменьшает токсичность стрихнина и подавляет вызываемое им повышение рефлекторной возбудимости. Эти свойства толперизона приближают его к центральным релаксантам (мепробамату и др.). Имеются данные, что толперизон оказывает избирательное угнетающее влияние на каудальную часть ретикулярной формации мозга, что сопровождается уменьшением спастичности. Обладает также центральными н-холинолитическими свойствами. На периферические отделы нервной системы выраженного влияния не оказывает, обладает слабой спазмолитической и сосудорасширяющей активностью, а также мембраностабилизирующим и местноанестезирующим действиями. Снижает болевую чувствительность периферических нервных окончаний, тормозит проводимость импульсов в первичных афферентных и двигательных волокнах, что приводит к блокированию моно- и полисинаптических спинномозговых рефлексов. Вероятно, вторично (вследствие торможения поступления Ca2+ в пресинаптические окончания) тормозит выделение медиаторов в синапсах. Способствует торможению проведения возбуждения по ретикулоспинальному пути. Избирательно снижает активность каудальной части ретикулярной формации головного мозга, уменьшая спастичность. Снижает патологически повышенный мышечный тонус и ригидность мышц, уменьшает болезненность, облегчает произвольные активные движения. Обладает слабым спазмолитическим и адреноблокирующим эффектами. Усиливает периферический кровоток независимо от влияния ЦНС.
К наиболее эффективным среди центральных миорелаксантов, применяемых в качестве расслабления мышц тазового дна, относится баклофен, но его применение может значительно снижать тонус нижних конечностей и “обездвиживать” больного (например, с рассеянным склерозом).
Заключение
Расстройства мочеиспускания – это широко распространенные осложнения неврологических заболеваний, которые существенно ухудшают качество жизни больных. Характер и формы этих нарушений отражают локализацию поражений в ЦНС и диктуют необходимость включения урологического обследования в перечень диагностических методов исследования неврологических больных. Реабилитация пациентов с урологическими расстройствами должна быть комплексной и представляет собой сложную задачу как для врача, так и для пациента.
На сегодняшний день лекарственная терапия является наиболее эффективным методом лечения острой и хронической задержки мочи нейрогенного генеза – серьезной медико-социальной проблемы, требующей междисциплинарного подхода и сотрудничества неврологов, урологов, клинических фармакологов и микробиологов. При помощи лекарственной терапии можно влиять на поврежденные или сохраненные холинергические, адренергические и другие нейромедиаторные системы, что в ряде случаев может приводить к восполнению неврологического дефицита и восстановлению утраченных на различный срок функций мочевого пузыря и уретры.



