ЭПИДЕМИОЛОГИЯ
Средняя частота САК в мире составляет, по данным регистров инсульта разных стран, 14=20 случаев на 100 тыс. населения в год со смертностью около 60% в течение первых 6 месяцев. Исследование ВОЗ показало 10-кратное различие в ежегодной заболеваемости САК в странах Европы и Азии. Наиболее часто случаи САК фиксируются в Финляндии (22,5 случаея в год на 100 тыс. населения) и в Японии (22,7 случая в год на 100 тыс. населения), реже всего – в Китае (2 случая в год на 100 тыс. населения). В Москве ежегодно регистрируется до 1400 случаев САК, что составляет 14 на 100 тыс. населения в год. Большинство исследований указывают на более высокий уровень заболеваемости среди женщин, которая в 1,24 раза выше, чем среди мужчин.
Доля субарахноидального кровоизлияния среди других видов инсульта не превышает 5%. Субарахноидальное кровоизлияние может случиться в любом возрасте, однако наиболее часто оно происходит в 40–60 лет.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Основными этиологическими факторами развития спонтанных САК являются разрывы мешотчатых аневризм на основании мозга (до 85%), которые чаще всего (90%) располагаются в переднем отделе артериального виллизиева круга и только в 9–10% случаев локализуются в вертебрально-базилярном сосудистом бассейне. Диаметр мешотчатых аневризм может колебаться от 2 мм до нескольких сантиметров (чаще – 2–10 мм). Их образование, по-видимому, обусловлено врожденным дефектом сосудистой стенки, обычно возникающим в месте бифуркации или ветвления артерии, со временем отмечается постепенное увеличение размеров аневризмы. Основным фактором риска разрыва мешотчатой аневризмы является АГ, дополнительными – курение и злоупотребление алкоголем.
Значительно реже причинами субарахноидального кровоизлияния могут быть разрывы артерио-венозной мальформации, микотичес-кой аневризмы, кавернозной мальформации (кавернозной гемангиомы), венозной мальформации (венозной гемангиомы), артериовенозного свища в твердой мозговой оболочке.
У больных АГ и церебральным атеросклерозом иногда образуются веретенообразные аневризмы, преимущественно в базилярной, внут-ренней сонной, средней и передней мозговой артериях, однако они сравнительно редко осложняются разрывом и субарахноидальным кровоизлиянием. Иногда к субарахноидальному кровоизлиянию приводит расслоение позвоночной, реже – сонной артерии, которое может быть следствием травмы шеи, мануальной терапии на шейном отделе позвоночника.
К редким причинам субарахноидального кровоизлияния относятся гематологические заболевания (серповидно-клеточная анемия, лейкоз, тромбоцитопения, синдром диссеминированного внутрисосудистого свертывания – ДВС-синдром), антикоагулянтная терапия, кровотечение из опухоли оболочек мозга, амилоидная ангиопатия (в пожилом возрасте), церебральный васкулит, тромбозы корковых или менингеальных ветвей, употребление кокаина, использование симпатомиметиков, сопровождающиеся повышением системного АД.
Излившаяся в субарахноидальное пространство кровь вызывает асептическую воспалительную реакцию сосудистой мозговой оболочки, отек, сосудистый спазм и ишемию головного мозга.
Факторы риска САК. К независимым факторам риска развития САК относят артериальную гипертензию, очень низкий индекс массы тела, курение и злоупотребление алкоголем. Кроме того, риск повышают симпатомиметики, такие как кокаин и фенилпропаноламин, особенно у лиц молодого возраста. Сахарный диабет не является фактором риска развития САК. Вышеназванные факторы также повышают риск развития множественных внутричерепных аневризм (АГ, курение, цереброваскулярные болезни в анамнезе, постменопаузальное состояние).
Есть данные о корреляции атмосферного давления с частотой развития САК.
Ряд генетических синдромов связывают с развитием САК. К ним относят аутосомный доминантный поликистоз почек, синдром Элерса-Данлоса и др.
Установлена наследственная предрасположенность к развитию аневризм. При наличии двух и более родственников первой степени с субарахноидальным кровоизлиянием рекомендуется проведение скрининга всем остальным родственникам. В других случаях скрининговые исследования асимптомных пациентов нецелесообразны.
Провоцирующие факторы. К непосредственным провоцирующим факторам САК относятся: резкое повышение АД и внутричерепного давления при резком физическом напряжении (во время подъема тяжести, дефекации, кашля, полового акта), сильных отрицательных эмоциях, а также ухудшение венозного оттока во время ночного сна у больных с резко выраженным атеросклеротическим поражением сосудов головного мозга.
КЛАССИФИКАЦИЯ
Этиологическая классификация САК выделяет среди причин первичные сосудистые заболевания ЦНС и вторичную сосудистую патологию ЦНС.
Первичные сосудистые заболевания ЦНС:
- артериальные аневризмы церебральных сосудов;
- сосудистые мальформации ЦНС (артериовенозные мальформации, каверномы, артериовенозные фистулы);
- аномалии сосудистой системы мозга (болезнь Нисимото, расслаивающие аневризмы церебральных сосудов).
Вторичная сосудистая патология ЦНС:
- артериальная гипертензия;
- васкулиты;
- болезни крови;
- нарушение свертывающей системы крови при приеме антикоагулянтов, антиагрегантов и других лекарственных препаратов.
В случаях, когда не удается установить этиологию кровоизлияния, используют понятие «субарахноидальное кровоизлияние неясного генеза». На долю таких кровоизлияний приходится около 15%.
Субарахноидальные кровоизлияния классифицируют также по распространенности, определяемой на основании данных КТ или МРТ. При этом учитывают как массивность кровоизлияния, так и его сочетание с другими компонентами внутричерепного кровоизлияния – паренхиматозным и вентрикулярным.
В зависимости от этого фактора выделяют следующие типы САК:
- изолированное субарахноидальное;
- субарахноидально-паренхиматозное;
- субарахноидально-вентрикулярное;
- субарахноидально-паренхиматозно-вентрикулярное.
 В мировой практике широкое распространение получила классификация САК, предложенная М. Fisher (1980). Она характеризует распространенность субарахноидального кровоизлияния по результатам КТ (табл. 1).
В мировой практике широкое распространение получила классификация САК, предложенная М. Fisher (1980). Она характеризует распространенность субарахноидального кровоизлияния по результатам КТ (табл. 1).
ДИАГНОЗ
Задачи диагностики:
- установить наличие крови в субарахноидальном пространстве головного мозга;
- провести дифференциальную диагностику с другими типами ОНМК и заболеваниями;
- выявить причину САК с целью максимально быстрого принятия решения о хирургическом лечении (при выявлении мешковидной аневризмы мозга, артериовенозной мальформации, кавернозной ангиомы).
Клинические признаки и симптомы
САК развивается остро без каких-либо предвестников и характеризуется возникновением внезапной, интенсивной головной боли, которую пациенты часто характеризуют как «худшую в жизни», «удар в голову», «растекание жидкости в голове». Головная боль достигает максимальной интенсивности в течение нескольких секунд, сопровождается тошнотой, рвотой. Однако в отдельных случаях выраженность головной боли может быть умеренной, при этом она может купироваться анальгетиками и даже проходить спонтанно. Головная боль может быть диффузной, но иногда локализуется в затылочной области.
В некоторых случаях она иррадиирует вдоль позвоночника. Другими типичными симптомами являются тошнота и рвота в 77% случаев.
Типичны кратковременная утрата сознания и быстрое развитие менингеального синдрома при отсутствии очаговых неврологических расстройств. Длительная утрата сознания свидетельствует о тяжелом кровоизлиянии, как правило, с прорывом крови в желудочковую систему, а быстрое присоединение очаговых симптомов – о субарахноидально-паренхиматозном кровоизлиянии.
Артериальная гипертензия выявляется в 50% случаев. Высокое АД в момент кровоизлияния, особенно у больных, страдающих артериальной гипертензией, может стать причиной ошибочной трактовки острого состояния как гипертонического криза.
Судорожный синдром у пациентов с САК встречается в 20%. Чаще всего он развивается в первые сутки после геморрагии и обычно у пациентов с аневризмами средней или передней мозговой артерии, страдающих АГ и имеющих внутримозговой компонент геморрагии.
В острой стадии САК нередко отмечают повышение температуры тела, которое может наблюдаться через несколько суток, обычно на 4 -й день и позже от начала заболевания.
САК может развиваться в любое время, но чаще это случается во время физической активности.
Тяжесть состояния больного в момент субарахноидального кровоизлияния и дальнейшее течение болезни зависят в первую очередь от массивности кровоизлияния и его этиологии. Наиболее тяжело протекают субарахноидальные кровоизлияния при разрыве аневризм сосудов мозга.
Анамнез
При сборе анамнеза заболевания необходимо выяснить, когда точно началось нарушение мозгового кровообращения, а также скорость и последовательность возникновения симптомов. Необходимо выявить возможные факторы риска САК.
Физикальное обследование
Физикальное обследование больного САК проводят по общепринятым правилам по системам органов (дыхательная, сердечно-сосудистая, пищеварительная, мочевыделительная и др.), детальный неврологический осмотр, оценку тяжести состояния пациента.
В ходе неврологического осмотра оценивают наличие и выраженность общемозговой симптоматики (нарушения уровня сознания, головная боль, тошнота, рвота, генерализованные судороги), менингеальных симптомов и очаговой неврологической симптоматики. Для выявления последних необходима последовательная оценка функций ЧН, двигательной системы, чувствительной и координаторной сфер, вегетативной системы и высших психических функций.
Менингеальный синдром
При осмотре больных с САК, как правило, выявляется менингеальный синдром в виде ригидности шейных и затылочных мышц, светобоязни, болей в глазах при движении, менингеальных симптомов (Кернига, Брудзинского). Отмечается общая гиперестезия, болезненность при пальпации точек выхода ветвей тройничного нерва. Часто наблюдается характерная поза больного на боку с приведенными к животу ногами и откинутой назад головой.
Очаговая симптоматика
Очаговая симптоматика в начальном периоде САК выявляется значительно реже, чем менингеальный синдром (примерно в 25% случаев), и может проявляться в виде:
- парезов черепных нервов (преимущественно отводящего и глазодвигательного нервов);
- афазии;
- одностороннего пространственного игнорирования;
- двигательного дефицита (в 10–15% случаев), как правило, в виде гемипареза при аневризмах средней мозговой артерии и нижнего парапареза при аневризме передней соединительной артерии, двустороннем кровоизлиянии.
Оценка тяжести САК
 Для определения степени тяжести САК применяются классификации Hunt-Hess (табл. 2), а также шкала Всемирной федерации нейрохирургов (табл. 3). Определение тяжести необходимо для оценки прогноза заболевания и определения показаний к хирургическому лечению.
Для определения степени тяжести САК применяются классификации Hunt-Hess (табл. 2), а также шкала Всемирной федерации нейрохирургов (табл. 3). Определение тяжести необходимо для оценки прогноза заболевания и определения показаний к хирургическому лечению.
Характер кровоизлияния оценивается по шкале М. Fiher (табл.1).
Лабораторные и инструментальные исследования
Лабораторные исследования
- общий анализ крови с подсчетом тромбоцитов;
- общий анализ мочи;
- КФК;
- МНО, АЧТВ, фибриноген;
- холестерин крови, ЛПВП, ЛПНП, триглицериды;
- электролиты крови;
- АлаТ, АсаТ, общий, прямой билирубин;
- мочевина, креатинин;
- общий белок и белковые фракции;
- определение группы крови и резус фактора.
Инструментальные исследования
КТ без применения контраста. При наличии у пациента типичной клинической картины САК всем больным показано проведение КТ головного мозга без контрастирования в экст-ренном порядке. КТ без контрастирования является предпочтительным методом, т.к. его применение дает достоверную диагностику САК, при том что он является более доступным и дешевым методом, чем МРТ. В первые 12 часов. чувствительность этого метода достигает 100%, уменьшаясь до 93% к 24 часам.
При выявлении на КТ крови в субарахноидальном пространстве пациенту проводят цифровую субтракционную ангиографию (ЦСАГ) или магнитно-резонансную ангиографию, или спиральную компьютерно-томографическую ангиографию для выявления источника кровоизлияния (аневризма, артериовенозная мальформация).
МРТ в режиме FLAIR-MRI. МРТ с использованием стандартных импульсных последовательностей является малоинформативным методом диагностики САК. Более чувствительным методом является FLAIR-MRI, так как подавление сигнала от ликвора позволяет лучше визуализировать кровоизлияние.
Цифровая субтракционная ангиография. Пациентам с диагнозом САК следует выполнять ЦСАГ с тем, чтобы выявить артериальную аневризму (АА) или артериовенозную мальформацию. Если нет времени на выполнение ЦСАГ, то следует провести магнитно-резонансную ангиографию или спиральную компьютерно-томографическую ангиографию.
Магнитно-резонансная ангиография (МРА) не заменила классическую ЦСАГ в диагностике АА. Например, чувствительность МРА при АА >5 мм составляет 85–100%, но при меньшем размере снижается до 56%. Тем не менее МРА является эффективным инструментом диагностики для беременных и лиц, у которых АА не проявилась разрывом.
Спиральная компьютерно-томографическая ангиография (СКТА) – весьма чувствительный (77–100%) и специфичный (79–100%) тест для диагностики АА, но его точность зависит от локализации и размера образования, опыта нейрорадиолога и характера изображения. Как и МРА, СКТА имеет высокую чувствительность (95–100%) при аневризмах размером >5 мм, но при размере менее 5 мм она снижается до 64–83%. Данные СКТА в 80–83% случаев идентичны данным классической ЦСАГ, а в 74% случаев проведение ЦСАГ после СКТА не дает какой-либо дополнительной информации. Поэтому в тех случаях, когда задержки, связанные с проведением ЦСАГ, крайне нежелательны или недопустимы, многие нейрохирурги оперируют пациентов, основываясь на данные только СКТА. Некоторые нейрохирурги используют только данные СКТА и при плановых операциях. Кроме того, СКТА может использоваться как вспомогательный метод наряду с ЦСАГ, потому что позволяет определить костные ориентиры, наличие кальцификатов, тромбированной части аневризмы и др. Несмотря на некоторые недостатки СКТА (артефакты, необходимость применения контраста и др.), метод все чаще применяется как вспомогательный или заменяющий ЦСАГ. Тем не менее сегодня классическая селективная ЦСАГ остается «золотым стандартом» диагностики АА, проявившихся разрывом.
Поясничная пункция выполняется в следующих случаях:
- если по данным КТ не выявлено признаков САК, но клинические данные свидетельствуют в пользу этого диагноза;
- если на основании клинических признаков есть подозрение на САК, но отсутствует возможность экстренного проведения КТ.
Как правило, при САК примесь крови в ликворе выявляется уже в первые часы после начала заболевания.
Транскраниальная ультразвуковая допплерография является доступной прикроватной методикой для оценки церебрального кровотока у больных САК, применяется в случае уже установленного диагноза САК с целью раннего выявления и контроля за ангиоспазмом, являющимся одним из осложнений САК. Это исследование позволяет выявить спазм сосудов основания мозга, определить его распространенность и выраженность. При исследовании анализируются: сохранность ауторегуляции, количество артерий, вовлеченных в ангиоспазм, замкнутость Виллизиева круга. Наибольшей клинической значимостью обладает динамика показателей. Так, увеличение линейной скорости кровотока (более 25% в день) от исходного уровня является предиктором развития вазоспазма, повышение индекса сопротивления указывает на рост внутричерепного давления.
Электроэнцефалография является неинвазивной методикой и коррелирует с церебральным метаболизмом и ишемией. ЭЭГ – доступный метод обнаружения судорожной активности и диагностики бессудорожных приступов у больных с нарушением уровня сознания.
При исследовании глазного дна может быть выявлен отек дисков зрительных нервов (как правило, отсроченный). У 10–20% больных САК выявляется преретинальное кровоизлияние (кровоизлияние в стекловидное тело или синдром Терсона).
По показаниям могут также проводиться:
- ЭКГ, холтеровское мониторирование ЭКГ;
- ЭхоКГ пациентам при наличии кардиальной патологии в анамнезе, выявленной при объективном исследовании или по данным ЭКГ;
- Р-графия легких.
Дифференциальный диагноз
При подозрении на САК дифференциальная диагностика поводится со следующими заболеваниями:
- иные типы ОНМК (ишемический инсульт, внутримозговое кровоизлияние, ТИА);
- инфекционные заболевания головного мозга (энцефалит, менингит);
- черепно-мозговая травма;
- остро развивающиеся и тяжело протекающие экзогенные и эндогенные интоксикации, сопровождающиеся менингеальными симптомами на фоне угнетения сознания;
- височный артериит;
- мигрень, первичные цефалгии (в частности, при первичной громоподобной головной боли, головной боли при физическом напряжении, сексуальной активности);
- феохромоцитома;
- острая окклюзионная гидроцефалия.
Менингеальные симптомы – основной дифференциально-диагностический признак САК. В зависимости от массивности САК они могут быть выражены в разной степени и сохраняться от нескольких суток до 3–4 недель.
Клинические признаки, свидетельствующие в пользу САК:
- относительно молодой возраст больных (чаще до 50 лет);
- внезапное начало во время активной (физической) деятельности;
- первоначальный симптом – сильнейшая головная боль;
- часто – эмоциональное возбуждение, подъем АД, гипертермия;
- выраженный менингеальный синдром;
- кровь в ликворе в 100% случаев, если спинномозговая пункция проведена не ранее 3 часов после развития симптомов.
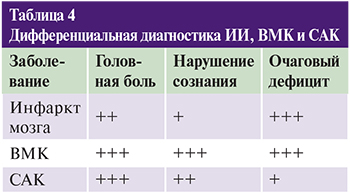 Для дифференциальной диагностики с другими типами ОНМК можно опираться на набор из трех признаков: выраженность головной боли, степень нарушения сознания и очаговая симптоматика (табл. 4).
Для дифференциальной диагностики с другими типами ОНМК можно опираться на набор из трех признаков: выраженность головной боли, степень нарушения сознания и очаговая симптоматика (табл. 4).
Осложнения САК
Ангиоспазм является одним из наиболее тяжелых и часто встречающихся осложнений САК при разрыве аневризмы головного мозга и способствует вторичному ишемическому его повреждению. Ангиоспазм развивается при разрывах аневризм и практически не наблюдается при разрывах артерио-венозных мальформаций (АВМ) и САК иной этиологии. Выраженный и продолжительный ангиоспазм вызывает резкое повышение сосудистого сопротивления и формирование «отсроченных» инфарктов мозга. Частота сосудистого спазма в 1-е сутки составляет 2–7%, на 5-е сутки – 31%, к 17-м суткам – 90,6%. Сужение артерий начинается на 3–4-е сутки от начала заболевания, максимально выражено на 7–14-й день, затем оно регрессирует.
Повторные кровотечения, обусловленные лизисом сгустка крови, прикрывающим место разрыва сосуда, развиваются у 17–26% больных с САК вследствие разрыва аневризм, у 5% – при АВМ и исключительно редко – при САК другой этиологии. В 4% наблюдений они возникают в течение 1-х суток, на протяжении последующих 4 недель их частота становится стабильной – по 1–2% в день.
Острая гидроцефалия (увеличение желудочков в течение первых 72 часов) развивается у 20–30% пациентов с САК и чаще бывает у лиц с высоким баллом по шкале Hunt-Hass и Fisher. Клиническое значение острой вентрикуломегалии после САК неоднозначно, так как у большинства пациентов она протекает бессимптомно и их состояние не ухудшается. Состояние 40–80% больных с нарушенным сознанием и гидроцефалией улучшается после вентрикулостомии.
Синдромы отека – дислокации головного мозга, развивающиеся в результате повышения внутричерепного давления вследствие патологических внутричерепных процессов (отек мозга, объемное образование, гидроцефалия, гиперперфузия). Проявляется рядом неспе-цифических симптомов, наиболее частые из которых диффузные головные боли, рвота (на высоте головной боли), тошнота, стойкая икота, брадикардия в сочетании с увеличением систолического АД, парез или паралич глазодвигательного или отводящего нерва, сонливость и нарастающее угнетение сознания, отрицательная динамика неврологического статуса, застойные диски зрительных нервов при исследовании глазного дна.
К патологическим процессам, осложняющим течение САК, также относятся сопутствующие внутримозговое кровоизлияние, прорыв крови в желудочки и тампонада желудочков кровью.
ЛЕЧЕНИЕ
Экстренную госпитализацию больных с клинической картиной САК осуществляют в первичные сосудистые отделения или региональные сосудистые центры, где после инструментального обследования определяется дальнейшая тактика ведения пациента.
Немедикаментозное лечение
Хирургическое лечение
Основой лечебной тактики при САК вследствие разрыва аневризмы является проведение раннего хирургического вмешательства по выключению аневризмы из кровотока (с целью профилактики повторных кровоизлияний) и удалению сгустков крови из базальных цистерн (с целью профилактики ангиоспазма и ишемии мозга). Оптимальный срок проведения операции – первые трое суток (72 часа) от разрыва аневризмы, т.е. до развития сосудистого спазма и ишемии мозга.
Операции на аневризме в остром периоде САК показаны:
- больным с тяжестью САК I–II степеней по Hunt-Hess независимо от срока после кровоизлияния;
- больным с тяжестью САК III степени по Hunt-Hess при легком или умеренном ангиоспазме независимо от срока после кровоизлияния;
- больным с тяжестью САК IV–V степеней по Hunt-Hess, если тяжесть состояния обусловлена внутримозговой гематомой с развитием дислокационного синдрома.
Операции на аневризме в остром периоде САК откладываются:
- у больных с тяжестью САК III–IV степени по Hunt-Hess при умеренном или выраженном и распространенном ангиоспазме;
- у больных с анатомически сложными аневризмами (гигантские аневризмы, аневризмы основной артерии);
- у больных с тяжестью САК V степени по Hunt-Hess, если тяжесть состояния не определяется наличием внутримозговой гематомы.
Выбор хирургического вмешательства:
- Хирургическое клипирование или эндовас-кулярная спиральная эмболизация разорвавшейся аневризмы должны производиться как можно раньше большинству пациентов с целью уменьшения риска повторного кровотечения после аневризматического САК.
- Рекомендована полная облитерация аневризмы во всех возможных случаях.
- Заключение о предпочтительном лечении аневризмы должно быть мультидисциплинарным, вынесенным совместно сосудистым и эндоваскулярным хирургами на основании характеристик пациента и аневризмы.
- В случаях, если разорвавшаяся аневризма расценена как не поддающаяся ни хирургическому клипированию, ни эндоваскулярной эмболизации, должно быть рассмотрено проведение эндоваскулярной эмболизации.
- При отсутствии противопоказаний должна проводиться отсроченная васкулярная визуализация (индивидуальная по типу и времени) для пациентов после эмболизации или клипирования разорвавшейся аневризмы. Также должно быть рассмотрено проведение повторного клипирования или эмболизации при клинически значимых остатках аневризмы (или при ее росте).
- Возможность проведения микрохирургического клипирования должна быть рассмотрена для пациентов с крупными (>50 мл) интрапаренхиматозными гематомами и аневризмами средней мозговой артерии. Возможность проведения эндоваскулярной эмболизации должна быть рассмотрена для пожилых пациентов (70 лет), для пациентов в тяжелом состоянии (IV/V степень по классификации Всемирной федерации нейрохирургических обществ) и для пациентов с верхушечными аневризмами базилярнй артерии.
- Стентирование разорвавшихся аневризм сопряжено с высокими показателями заболеваемости и смертности и может быть рассмот-рено только при невозможности проведения более безопасных процедур.
Прямые хирургические вмешательства на аневризме в остром периоде
Операция по наложению сосудистой клипсы (клипированию) шейки аневризмы с целью выключения аневризмы из кровотока и удалению сгустков крови с целью профилактики ангиоспазма выполняется открытым доступом через трепанационное отверстие.
Для облегчения выполнения операции и улучшения исходов могут быть использованы:
- люмбальный дренаж и выведение 15–20 мл ликвора;
- наружный вентрикулярный дренаж (при ВЖК и острой гидроцефалии);
- удаление сгустков крови из базальных цистерн (профилактика ангиоспазма);
- удаление внутримозговой гематомы;
- перфорация конечной пластинки (профилактика гидроцефалии);
Эндоваскулярные операции. Эндоваскулярное лечение аневризм головного мозга является альтернативным открытому методу их лечения:
- эндоваскулярные операции, направленные на выключение аневризмы из кровотока;
- транслюминальная ангиопластика или стентирование спазмированного сосуда могут выполняться при декомпенсированном ангиоспазме, в случае, если лечение нимодипином и 3H-терапия неэффективны.
Другие хирургические вмешательства в остром периоде САК (в случаях когда тяжесть состояния не позволяет выполнить хирургическое вмешательство на аневризме):
- наложение наружного вентрикулярного дренажа;
- наружная декомпрессия с пластикой твердой мозговой оболочки;
- удаление внутримозговой гематомы без выключения аневризмы;
- установка субдурального или вентрикулярного датчика для контроля внутричерепного давления.
Медикаментозное лечение
Консервативное лечение САК показано в следующих случаях:
- по данным ЦСАГ, МРА или СКТА отсутствуют признаки аневризмы, опухоли и других повреждений, при которых показано хирургическое лечение;
- источник кровотечения имеет локализацию, не доступную для хирургического лечения;
- очагов поражения несколько, они имеют двустороннюю локализацию, а по клиничес-кой картине и результатам ангиографии выяснить, какой из них явился источником кровотечения, невозможно;
- больной в крайне тяжелом состоянии или у него есть сопутствующие заболевания, не позволяющие выполнить хирургическое вмешательство;
- больной или члены его семьи отказываются от операции.
Базисная терапия САК
Под базисной терапией подразумеваются основные терапевтические стратегии, направ-ленные на стабилизацию состояния тяжелобольных пациентов, предупреждение и устранение основных неврологических осложнений заболевания, включая повторное кровотечение, ангиоспазм с последующей ишемией мозга, гидроцефалию и судороги. Она также включает в себя терапию различных и относительно часто развивающихся системных осложнений САК.
При терапии рекомендуется проведение мониторинга неврологического статуса, частоты сердечных сокращений, артериального давления, температуры и сатурации кислородом в течение 72 часов у больных с сохраняющимся неврологическим дефицитом. Для мониторинга неврологического статуса рекомендуется использовать шкалу инсульта NIH.
Все больные со сниженным уровнем бодрствования, наличием клинических либо нейровизуализационных признаков отека головного мозга и/или повышенного внутричерепного давления должны находиться в постели с приподнятым до 30° головным концом (без сгибания шеи!). У этой категории больных должны быть исключены или сведены к минимуму эпилептические припадки, кашель, двигательное возбуждение и боль; постельный режим с подъемом головного конца кровати на 30° и спокойная окружающая обстановка соблюдаются в течение 4-х недель (этот срок достаточен для фибропластической пролиферации и заживления разорвавшегося сосуда).
Необходим тщательный уход за больным для предупреждения осложнений со стороны дыхательной системы и мочевых путей, а также профилактика пролежней.
Исключаются действия, связанные с физичес-ким напряжением. Для облегчения акта дефекации назначают слабительные средства, а для уменьшения частоты стула и объема каловых масс назначают бесшлаковую диету. По показаниям назначают противокашлевые средства.
Питание через рот используется у больных с нормальным уровнем сознания и сохранным глоточным рефлексом. Больным с угнетенным уровнем сознания или с нарушенным глоточным рефлексом устанавливается назогастральный зонд для парентерального питания.
Больным, находящимся в состоянии оглушения или комы, устанавливается мочевой катетер.
Респираторная поддержка необходима пациентам с САК для обеспечения нормального насыщения кислородом и нормокапнии. Методы терапии включают инсуфляцию кислорода, неинвазивную ИВЛ. Всем больным с нарушением сознания до 8 баллов по шкале Глазго должна быть проведена изоляция дыхательных путей с ИВЛ в режиме нормовентиляции, избегая гипоксемии и гипервентиляции. Больным со снижением уровня сознания (10 баллов и меньше по шкале комы Глазго) показана интубация трахеи с переводом пациента на ИВЛ. Кроме того, интубация показана при аспирации или высоком ее риске при неукротимой рвоте и выраженном бульбарном или псевдобульбарном синдроме. Решение вопроса о необходимости ИВЛ принимают исходя из основных общих реанимационных положений:
- тахипноэ 35–40 в 1 мин, брадипноэ менее 12 в 1 мин;
- снижение рО2 менее 60 мм. рт.ст., увеличение рСО2 более 50 мм. рт.ст. в артериальной крови и жизненная емкость легких менее 12 мл/кг массы тела;
- нарастающий цианоз.
Управление гемодинамикой. Каждому этапу лечения соответствуют свои целевые показатели. До выключения аневризмы из кровотока терапия направлена на профилактику рецидива кровоизлияния при сохранении достаточного церебрального перфузионного давления. Рекомендуется снижение АД до целевых показателей: систолическое АД – 160 мм.рт.ст., диастолическое <110 мм. рт.ст. После окклюзии аневризмы при появлении признаков церебрального ангиоспазма необходима вазопрессорная поддержка (норадреналин, фенилэфрин или допамин). Рекомендуемый уровень систолического АД – 120–150 мм. рт.ст.
Для уменьшения риска повторного кровоизлияния необходим контроль артериальной гипертензии со стабилизацией систолического АД не выше 160 мм. рт.ст. для больных с неклипированной аневризмой. Возможно назначение одного из таких препаратов, как:
- лабеталол в дозе 5–20 мг каждые 15–20 мин в/в медленно; или в таблетках 300–1000 мг/сут в 3–4 приема;
- никардипин в среднем 5 мг/ч внутривенно, титруя дозу каждые 5–15 мин от 2,5 мг/ч до максимальной (15 мг/ч); при достижении целевого АД необходимо подбирать дозу таким образом, чтобы АД поддерживалось в требуемых пределах;
- эсмолол в/в в дозе 500 мкг/кг в течение 1 мин (нагрузочная доза), затем 50 мкг/кг в минуту в течение последующих 4 мин; поддерживающая доза – 25 мкг/кг в минуту (или менее).
Введение гипотензивных препаратов должно осуществляться осторожно, поскольку артериальная гипотензия при САК опасна развитием ишемии мозга, особенно на фоне церебрального ангиоспазма.
При возникновении артериальной гипотензии необходимо поддержание среднего АД не ниже 90 мм рт.ст. за счет создания нормо/умеренно гиперволемического состояния (центральное венозное давление – ЦВД 6–12 см вод. ст.), что достигается инфузией коллоидных и кристаллоидных растворов.
Поддержание нормоволемии и нормального уровня натрия достигается путем капельной инфузии 2–3 л в день или больше растворов глюкозы и раствора хлорида натрия. Введение жидкости является критически важным для предупреждения дефицита плазмы, который может влиять на развитие ишемии мозга. Введение жидкости нужно увеличивать больным с гипертермией.
Адекватная аналгезия. В большинстве случаев умеренную головную боль можно купировать назначением парацетамола, при выраженном болевом синдроме используется кодеин (60 мг в/м или внутрь каждые 3–4 ч), трамадол. Опиоиды назначаются только в крайних случаях.
Пациентам с возбуждением необходима седация. Предпочтительны препараты короткого действия или препараты, имеющие антагонисты, так как их применение не в состоянии замаскировать клиническое ухудшение (вследствие нарастающей гидроцефалии или повторного кровоизлияния).
Судорожный синдром. Однократные судороги в момент развития САК не имеют прог-ностической значимости в плане развития у больного последующих судорог. Назначение противоэпилептических средств с профилактической целью не рекомендуется. Абсолютным показанием для противосудорожной терапии являются указания на судороги в дебюте заболевания. Начальное ведение больных с судорожным синдромом включает инфузию диазепама (5–10 мг со скоростью 2 мг/мин; при необходимости повторно каждые 5–10 мин). Продолжительность терапии не должна превышать 3–7 дней. Пациенты с низким уровнем сознания могут иметь бессудорожный эпилептический статус, таким больным рекомендуется проведение ЭЭГ-мониторинга.
Применение церебральных Са2+-блокаторов – рекомендовано в остром периоде САК. Исследования последних лет показали, что антагонисты кальция не влияют на вазоспазм, но улучшают неврологические исходы. Пероральные формы препарата следует назначать всем пациентам с САК при условии отсутствия признаков внутричерепной гипертензии. Считается, что данный препарат снижает отсроченный неврологический дефицит, вызванный ангиоспазмом.
Нимодипин назначается в таблетированной форме по 60 мг каждые 4 ч per os или в виде постоянной внутривенной инфузии.
Магнезиальная терапия. Магний является антагонистом кальция и потенциально обладает нейропротективным эффектом. Кроме того, магний может ослаблять мощное сосудосуживающее влияние эндотелина 1. Эти свойства вызывают интерес к потенциальной роли магния в лечении САК. Но проведенные исследования не позволили доказать влияние магния на неврологический дефицит. Рекомендовано поддерживать уровень магния в пределах физиологической нормы.
Стрессовая гипергликемия связана с отсроченной церебральной ишемией и прогностически является маркером плохих краткосрочных и долгосрочных результатов после САК. Гипергликемия регистрируется в 30–100% случаев САК. Ретроспективный анализ показал, что хороший контроль гликемии значительно снижает вероятность неблагоприятного исхода через 3–6 месяцев. При этом гипогликемия меньше 3,3 ммоль/л является независимым предиктором летальности и повышает риск возникновения отсроченной церебральной ишемии и инфаркта. В исследованиях гликемии и уровня глюкозы в тканевой жидкости, полученной при микродиализе, обнаружено несоответствие между системной и церебральной гипергликемией у тяжелых пациентов с САК. Не исключено, что так называемая стрессовая гипергликемия является ответной реакцией нейроэндокринной системы на церебральную гипогликемию, которая развивается в результате нарушения доставки глюкозы при низком церебральном перфузионном давлении в результате внутричерепной гипертензии или ангиоспазме. Исходя из этого, рекомендуемый уровень гликемии при САК составляет 6,3–8,0 ммоль/л.
Гипергликемию необходимо корригировать инсулином при уровне глюкозы более 10 ммоль/л.
При гипогликемии (<3,0 ммоль/л.) показано введение 40–50 мл 10–20%-ной глюкозы в/в.
Не следует вводить растворы, содержащие глюкозу, до определения уровня гликемии, а также всем тяжелым и нестабильным пациентам с инсультом в 1–2-е сутки лечения (при отсутствии гипогликемии);
Введение инсулина повышает потребность в К+ поэтому по окончании инфузии инсулина можно перейти на введение глюкозо-калиево-инсулиновой смеси.
Лихорадка (≥38,3°C и более) является наиболее распространенным из всех медицинских осложнений у больных САК (41–72%). Лихорадка неинфекционного генеза часто встречается при церебральной недостаточности и может указывать на тяжесть течения САК. Обнаружена связь лихорадки с повышенным риском развития симптоматического вазоспазма, увеличением продолжительности пребывания в ОРИТ и неблагоприятными исходами через 3 месяца. Нормотермия должна быть целью терапевтической тактики для каждого пациента с САК. Лечение лихорадки должно быть начато с назначения жаропонижающих препаратов как терапия первой линии с последующим применением физических методов охлаждения или внутрисосудистых гипотермических устройств. При развитии повторных эпизодов лихорадки необходимо искать и лечить инфекцию.
Нутритивная поддержка. Нутритивная поддержка направлена на раннее начало энтерального питания с применением сбалансированных питательных сред. Необходимо в течение первых 2–3 суток обеспечить суточное поступление 20–30 ккал/кг/сутки. Питание пациентов следует контролировать по данным исследований азотистого баланса и непрямой калориметрии. Предпочтительным является полное энтеральное питание.
Для профилактики гастропатии рекомендовано применение блокаторов протонной помпы омепрозол 20мг/сутки, пантопрозол 20–40 мг/сутки.
Специфическое лечение САК
В настоящее время не существует эффективных методов консервативного патогенетического лечения САК, направленных на остановку кровотечения из разорвавшейся аневризмы и ограничение объема излившейся крови. Антифибринолитическая терапия может быть назначена для профилактики рецедива САК в первые 3 дня при неокклюзированной аневризме. Если планируется эндоваскулярное вмешательство, то антифибринолитики должны быть отменены за 2–4 часа. Терапия антифибринолитиками должна проводиться под контролем гемостаза и противопоказана при тромбозе глубоких вен голени.
Важными направлениями консервативной терапии является предупреждение повторных кровотечений, нормализация АД, профилактика и лечение отсроченной ишемии (ангиоспазма), острой гидроцефалии.
Профилактика повторного кровоизлияния
- основной мерой профилактики повторных кровотечений из аневризмы является ее хирургическое выключение из кровотока;
- назначение антиконвульсантов, особенно в случаях эпилептического припадка в момент кровоизлияния;
- нормализация и поддержание стабильной гемодинамики.
Профилактика и терапия церебрального ангиоспазма и ишемии мозга
- применение блокаторов кальциевых канальцев;
- поддержание нормоволемии (введение коллоидных и кристаллоидных растворов под контролем ЦВД и диуреза);
- доказанных методов лечения развившегося ангиоспазма не существует. Необходимо осуществлять мероприятия, направленные на поддержание нормальной перфузии мозга – профилактику гипотензии и гиповолемии, поддержание нормального электролитного баланса, снижение ВЧД.
Профилактика и терапия острой гидроцефалии пациентам с вентрикуломегалией и угнетением сознания после острого САК рекомендуется наложение наружного вентрикулярного или люмбального дренажа; симптоматическим пациентам с хронической гидроцефалией после САК рекомендуется временное или перманентное выведение ликвора.
Перманентное шунтирование чаще необходимо лицам старшего возраста, с высокими баллами по оценочным шкалам (тяжелым инициальным состоянием), женщинам и пациентам, у которых рано развилась вентрикуломегалия.
Предупреждение тромбоза глубоких вен и тромбоэмболия легочной артерии достигаются использованием компрессионного трикотажа и интермиттирующей компрессией с помощью пневматического устройства (пневмомассажер) после ультразвукового обследования вен нижних конечностей и исключения флотирующих тромбов.
Нейрогенная ишемия миокарда и отек легких. САК может осложниться сердечной дисфункцией и отеком легких из-за резкого роста концентрации катехоламинов. Это состояние носит название «транзиторная гиперадреналемия» и связано с раздражением диэнцефальной области в результате попадания крови на основание мозга. Сердечная дисфункция сопровождается преходящими ЭКГ-изменениями, повышением тропонина, обратимыми нарушениями подвижности стенки миокарда при эхокардиографии, гипотонией и снижением сердечного выброса. Нейрогенный отек легких обусловлен увеличением сосудистой легочной проницаемос-ти и может развиваться изолированно или в сочетании с кардиальным повреждением. Гипотония, снижение сердечного выброса и нарушение оксигенации могут привести к нарушению церебральной перфузии в условиях повышенного внутричерепного давления или нарастающего ишемического неврологичес-кого дефицита. Тропонин I повышается примерно у 35% пациентов с САК, а нарушение ритма сердца – у 35%. Нарушения сердечной деятельности, по данным ЭКГ и эхокардиографии, повышение уровня тропонина I ассоциированы с риском отсроченной цереб-ральной ишемии и повышенным риском летального исхода после САК. Рекомендуется динамическая оценка сердечных ферментов и ЭКГ-мониторинг всем пациентам с САК. Пациентам с признаками депрессии функции миокарда и отеком легких необходимо проведение эхокардиографии и мониторинга сердечного выброса. При отеке легких протективная вентиляция и эуволемия являются мишеням терапии. При лечении сердечной недостаточности следует акцентировать внимание на состояние церебральной перфузии.
Анемия. У пациентов с анемией, которым не проводилась заместительная терапия (трансфузия форменных элементов крови), риск развития отсроченного инсульта и неблагоприятного исхода через 3 месяца после САК был выше, также чаще развивалась тканевая гипоксия мозга (снижение парциального кислорода в ткани мозга, давление ≤15 мм рт.ст.) и метаболический дистресс (лактат/пируват ≥40).
В исследовании безопасности пациентов с САК, рандомизированных на целевой гемоглобин 100 г/л (6,2 ммоль/л) и 115 г/л (7,1 ммоль/л), показано, что достижение более высокого целевого гемоглобина при переливании эритроцитарной массы безопасно и возможно. Рекомендуется обеспечение уровня гемоглобина от 80 до 100 г/л (5,0–6,2 ммоль/л). При решении вопроса о проведении заместительной терапии путем переливания форменных элементов крови при анемии у тяжелых пациентов с САК с признаками анемии (гемоглобин ниже 100 г/л) рекомендуют руководствоваться определением сатурации в верхней полой вене. Ее снижение ниже 70% означает, что доставки кислорода тканям недостаточно из-за низкой кислородной емкости крови, в связи с чем для обеспечения тканевого дыхания показана трансфузия форменных элементов крови (эритроцитов).
Оценка эффективности лечения
Эффективность лечения оценивается по дос-тижению целей и задач проводимой терапии:
- полная стабилизация жизненно важных функций (дыхание, центральная гемодинамика, оксигенация, водно-электролитный баланс, углеводный обмен);
- минимизация неврологического дефицита и отсутствие неврологических осложнений (повторные кровотечения, церебральный ангиоспазм и ишемия мозга, отек и дислокация головного мозга, острая окклюзионная гидроцефалия), подтвержденное данными нейровизуализации;
- отсутствие соматических осложнений (пневмония, ТЭЛА, тромбоэмболии глубоких вен нижних конечностей, пролежни, пептические язвы, инфекции мочевыводящих путей и др.);
- восстановление повседневной независимости и по возможности трудоспособности;
- повышение выживаемости пациентов.
Осложнения и побочные эффекты лечения
Осложнения хирургического лечения аневризм сосудов головного мозга:
- интраоперационные кровотечения;
- ишемический инсульт в результате полного или частичного прекращения кровотока по артериям головного мозга вследствие тромбоза, тромбоэмболии, пережатия или перекрытия просвета сосуда эндохирургическими инструментами и т.п.;
- при эндоваскулярном лечении аневризм интраоперационные осложнения связаны с разрывом аневризмы в ходе операции, перфорацией стенки аневризмы спиралью, тромбоэмболиями ветвей церебральных артерий из полости аневризмы, частичной или полной окклюзией несущего сосуда спиралью с развитием ишемии мозга.
Осложнения и побочные эффекты медикаментозного лечения соответствуют осложнениям и побочным эффектам лекарственных средств, применяемых в терапии САК.
Ошибки и необоснованные назначения
Применение антифибринолитиков (аминокапроновая кислота, транексамовая кислота), ранее широко использовавшихся при САК, не рекомендуется, так как частота рецидивов САК снижается незначительно, а частота ишемических осложнений возрастает. Применение антифибринолитиков также способствует развитию гидроцефалии и артериальной эмболии фрагментами кровяного сгустка.
Использование кортикостероидов (например, дексаметазона) при САК, как и при других типах ОНМК, не находит подтверждения их позитивного влияния на уменьшение отека головного мозга в клинических испытаниях. При этом препараты данной группы обладают серьезными побочными эффектами (повышение свертываемости крови, уровня сахара крови, развитие желудочного кровотечения и т.д.). Все это заставляет большинство клиницистов отказаться от их применения.
Лечение пациентов с САК аспирином, эноксапарином и тирилазадом является неэффективным в терапии ангиоспазма и связанной с ним ишемии.
Эффективность применения антиоксидантов не доказана.
ПРОГНОЗ
Прогноз заболевания у больных САК зависит от многих факторов. Наиболее значимый из них – этиология кровоизлияния. САК из артериальной аневризмы сопровождается высокой летальностью и частотой повторного кровоизлияния. В 40% случаев оно заканчивается летальными исходом в ближайшее время после развития, из них 10% пациентов не успевают доставить в стационар, в течение первых суток погибают до 25%. При отсутствии хирургического лечения аневризмы до 60% больных погибают в течение первого года от начала болезни. При своевременном хирургическом лечении аневризмы риск летального исхода уменьшается втрое. При САК другой этиологии прогноз, как правило, благоприятен.
У четверти пациентов, перенесших госпитальный период, остаются существенные ограничения в образе жизни. Даже у пациентов с хорошим неврологическим восстановлением длительное время сохраняются беспокойство, депрессия, посттравматическое стрессовое расстройство и когнитивные нарушения. Около 60% пациентов, перенесших САК, жалуются на частые головные боли. Более чем у четверти пациентов развиваются нейроэндокринные нарушения, в частности гипопитуитаризм – состояние, сопровождающееся снижением концентрации циркулирующих гипофизарных гормонов с развитием клинической картины гипотиреоза, гипокортицизма и гипогонатизма различной степени выраженности.



