ЭПИДЕМИОЛОГИЯ
В западных странах спонтанные ВМК составляет 10–15% всех инсультов и является второй наиболее распространенной разновидностью ОНМК, уступая по частоте только ишемическому инсульту (ИИ). Оценки годовой заболеваемости ВМК варьируются в диапазоне от 16 до 33 случаев на 100 тыс. населения.
В РФ спонтанные ВМК также составляют 10–15% от общего числа инсультов, т.е. при численности больных ОНМК в России более 500 тыс. ежегодно среди них насчитываются от 50 до 75 тыс. пациентов с ВМК. В структуре неврологической смертности населения гипертензивные внутримозговые кровоизлияния занимают первое место. Именно эта цереброваскулярная патология является основной составляющей, определяющей уровень летальности и инвалидизации.
Средний возраст больных ВМК составляет 60–65 лет, соотношение мужчин и женщин равно 1,6:1. Риск развития этого состояния значительно повышается после 55 лет и удваивается с каждым последующим десятилетием. Летальность от ВМК достигает 40–50%, а инвалидность развивается у 70–75% выживших.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Причинами ВМК могут быть различные заболевания и патологические состояния: артериальная гипертензия, амилоидная ангиопатия, аневризмы и сосудистые мальформации ЦНС, болезни крови (эритремия, тромбофилии), васкулиты, системные заболевания соединительной ткани. Кровоизлияния могут возникать при терапии антикоагулянтами и фибринолитическими средствами. ГИ развиваются при злоупотреблении некоторыми лекарственными препаратами (например, амфетамин, кокаин), что, вероятно, связано с симпатомиметическим эффектом данных препаратов. Наиболее частыми причинами геморрагического инсульта являются гипертоническая болезнь и амилоидная ангиопатия, которая характеризуется отложением амилоида в сосудах, кровоснабжающих кору и мозговые оболочки. К настоящему времени показано, что наличие Е2- и Е4- аллелей в гене, кодирующем аполипопротеин Е, в три раза увеличивает риск повторных кровоизлияний, возникающих в результате амилоидной ангиопатии.
ВМК может возникать в виде:
- гематомы (ведущим механизмом образования являются разрывы патологически измененных стенок церебральных сосудов);
- очага геморрагического пропитывания (характеризующегося небольшими размерами очага и нечетко выраженными границами, возникает вследствие диапедеза эритроцитов из мелких сосудов);
- гематома и геморрагическое пропитывание являются различными фазами одного и того же процесса.
ВМК наиболее часто (в 60% случаев) возникает как осложнение АГ в результате развития дегенеративных изменений (липогиалиноз, фибриноидный некроз) в небольших перфорирующих артериях мозга и образования микроаневризм. Кровоизлияние наступает вследствие разрыва измененной перфорирующей артерии (в большинстве случаев – лентикулостриарной артерии или корково-медуллярных артерий) или микроаневризмы либо в результате геморрагического пропитывания. При разрыве артерии или микроаневризмы кровотечение продолжается от нескольких минут до часов, пока в месте разрыва не образуется тромб.
Гипертензивное внутримозговое кровоизлияние локализуется преимущественно в бассейнах перфорирующих артерий мозга: в области базальных ядер (50%), таламуса (15%), белого вещества полушарий большого мозга (15%), моста (10%) и мозжечка (10%).
Следующей по частоте причиной кровоизлияния в мозг является разрыв артериовенозной мальформации или мешотчатой аневризмы. Гематомы при артериовенозной мальформации обычно локализуются в белом веществе полушарий большого мозга или базальных ядрах. Разрыв аневризмы передней соединительной артерии может привести к образованию гематомы в передних отделах полушарий большого мозга; разрыв аневризмы задней соединительной артерии – к образованию гематомы в средней части височной доли; разрыв аневризмы средней мозговой артерии (СМА) – к образованию гематомы в области латеральной борозды (сильвиевой щели). Значительно реже внутримозговое кровоизлияние вызвано другими сосудистыми мальформациями – микотической аневризмой (при ИЭ), микроангиомами, кавернозными и венозными ангиомами.
В пожилом возрасте нередкая причина кровоизлияния в мозг – амилоидная ангиопатия, возникающая вследствие отложения амилоидного белка в средней оболочке и адвентиции мелких корковых артерий и артериол. По данным вскрытий, амилоидная ангиопатия как причина кровоизлияния в мозг обнаруживается в 8% случаев в возрасте до 60 лет и более чем в 60% случаев в возрасте 90 лет и старше. Эта форма амилоидной ангиопатии не связана с системным амилоидозом, она способствует возникновению милиарных аневризм и фибриноидному некрозу пораженных сосудов, которые могут разорваться при повышении АД или незначительной травме. Гематомы обычно локализуются в белом веществе с распространением в одну или несколько долей полушарий большого мозга (лобарная гематома), они нередко бывают множественными или повторяются через различные интервалы времени.
Излившаяся в мозг кровь вызывает местное разрушение и сдавление вещества мозга, а также реакцию окружающих тканей в виде локальной, а впоследствии и распространенной ишемии мозга с интракраниальной гипертензией, дислокацией и возможным вклинением мозговых структур.
Факторы риска ВМК:
- Артериальная гипертензия.
- Возраст более 50 лет.
- Курение. Повышает вероятность геморрагических ОНМК в 2,5 раза. У мужчин выкуривание 20 и более сигарет в день увеличивает относительный риск кровоизлияния в мозг приблизительно в 2 раза, у женщин 15 и более сигарет – приблизительно в 2,5 раза;
- Употребление алкоголя, приводящее к поражению печени, что в свою очередь определяет нарушение синтеза факторов свёртываемости, кроме того, имеет место прямое воздействие алкоголя на мозговые сосуды и развитие АГ.
- Низкий уровень холестерина в крови повышает вероятность развития кровоизлияния в мозг, а гиперхолестеринемия ассоциируется с низкой вероятностью кровоизлияния. Тем не менее терапия статинами не увеличивает риска внутримозгового кровоизлияния.
- Избыточная масса тела, как показано в некоторых исследованиях, коррелирует с увеличением объема кровоизлияния в желудочки мозга.
КЛАССИФИКАЦИЯ
По этиологии выделяют
- Первичные кровоизлияния в мозг (80–85%), которые наиболее часто связаны:
- с артериальной гипертензией – более 50% случаев первичных кровоизлияний;
- с церебральной амилоидной ангиопатией – до 30% случаев.
- Вторичные кровоизлияния в мозг (15–20%), которые чаще связаны:
- с внутричерепными аневризмами и артериовенозными мальформациями;
- терапией антикоагулянтами и антиагрегантами, фибринолитиками;
- коагулопатиями;
- циррозом печени;
- внутричерепными новообразованиями (кровоизлияния в опухоль);
- васкулитами;
- болезнью Мойя-мойя;
- злоупотреблением наркотическими средствами;
- эклампсией и рядом других причин.
Помимо этиологии ВМК классифицируются по локализации и объему. В подавляющем большинстве случаев (до 90%) гематомы локализуются в супратенториальных отделах мозга.
В зависимости от локализации различают лобарные, латеральные, медиальные и смешанные внутримозговые гематомы.
Лобарными называют кровоизлияния, при которых кровь не выходит за пределы коры и белого вещества соответствующей доли (или долей) головного мозга.
Кровоизлияния в подкорковые ядра (кнаружи от внутренней капсулы) принято обозначать как латеральные.
Кровоизлияния в таламус (кнутри от внутренней капсулы) – как медиальные.
Смешанными называют гематомы, распространяющиеся в пределах нескольких анатомических структур. Такие гематомы встречаются наиболее часто.
Гематомы задней черепной ямки составляют около 10% всех внутримозговых гематом. Чаще всего они образуются в мозжечке, реже – в стволе головного мозга, где их «излюбленной» локализацией является мост.
Кровоизлияния в медиальные отделы больших полушарий мозга, а также гематомы задней черепной ямки приблизительно в 30% случаев сопровождаются прорывом крови в желудочковую систему.
В зависимости от объема излившейся крови целесообразно выделять:
- большие (свыше 60 мл);
- средние (от 60 до 30 мл);
- малые (менее 30 мл) размеры кровоизлияния.
ДИАГНОЗ
Клинические признаки и симптомы
Клиническая картина внутримозгового кровоизлияния достаточно типична. Заболевание развивается остро, часто на фоне высокого АД. Характерны сильная головная боль, головокружение, тошнота и рвота, быстрое развитие очаговых симптомов, прогрессирующее снижение уровня бодрствования – от умеренного оглушения до коматозного состояния. Угнетению сознания может предшествовать короткий период психомоторного возбуждения. Субкортикальные кровоизлияния могут проявиться эпилептическим припадком.
Анамнез
При сборе анамнеза заболевания необходимо выяснить, когда точно началось нарушение мозгового кровообращения, а также скорость и последовательность возникновения тех или иных симптомов. Особенное значение придают динамике общемозговых (нарушения уровня сознания, рвота, генерализованные судороги) и очаговых (двигательные, речевые, чувствительные нарушения) симптомов.
При сборе анамнеза жизни необходимо выявить возможные факторы риска ВМК (артериальная гипертензия, курение, употребление алкоголя, избыточная масса тела) перенесённые сосудистые заболевания (например, инфаркт миокарда, острое нарушение мозгового кровообращения). Необходимо также выяснить наследственный анамнез по части сосудистой патологии у родственников больного.
Физикальное обследование
Физикальное обследование больного ВМК проводят, по общепринятым правилам, по системам органов (дыхательная, сердечно-сосудистая, пищеварительная, мочевыделительная и др.). При оценке неврологического статуса отмечают наличие и выраженность общемозговой симптоматики (нарушения уровня сознания, головная боль, тошнота, рвота, генерализованные судороги), менингеальных симптомов и очаговой неврологической симптоматики. Для выявления последних необходима последовательная оценка функций ЧН, двигательной системы, чувствительной и координаторной сфер, вегетативной системы и высших психических функций.
Количественная оценка выраженности неврологического дефицита у больных ВМК рекомендуется применение шкалы инсульта Национального института здоровья (NIH Stroke Scale) (см. главу «Ишемический инсульт»).
Применение шкалы NIH позволит объективно подходить к состоянию больного ВМК и проводить оценку неврологического статуса в период пребывания больного в стационаре. Суммарный балл определяет тяжесть и прогноз заболевания. Полученные в результате оценки по шкале NIH данные соответствуют следующей выраженности неврологического дефицита:
- 0 – состояние удовлетворительное;
- 3–8 – неврологические нарушения легкой степени;
- 9–12 – неврологические нарушения средней степени;
- 13–15 – тяжелые неврологические нарушения;
- 16–34 – неврологические нарушения крайней степени тяжести;
- 34 – кома.
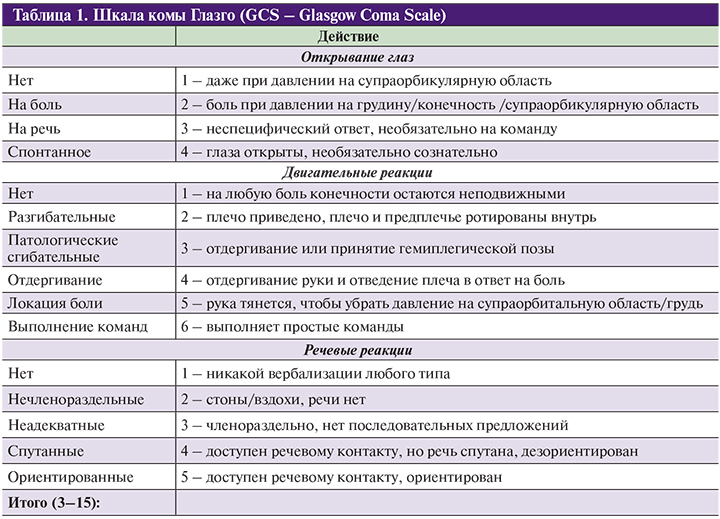
Для оценки уровня сознания используется шкала комы Глазго (табл. 1). Шкала включает оценку таких параметров, как открывание глаз, двигательная и словесная реакции. Шкала комы Глазго имеет диапазон баллов от 3 (минимальное количество баллов, означающее наиболее тяжелую степень комы) до 15 (максимальное количество баллов, означающее нормальный уровень сознания).
Всю неврологическую симптоматику при ВМК можно разделить на 4 группы симптомов:
- общемозговые;
- менингеальные;
- вегетативные;
- очаговые.
Общемозговые расстройства являются ведущими в клинической картине ВК. Развиваются головная боль, тошнота, рвота. Приблизительно у 15% пациентов возникают генерализованные эпилептические приступы. Может наблюдаться психомоторное возбуждение. В течение 1 ч может происходить нарушение сознания от оглушения до комы.
Менингеальный синдром в первые часы заболевания проявляется гиперестезией (прежде всего светобоязнью), скуловым симптомом Бехтерева. Ригидность мышц затылка, симптомы Кернига, Брудзинского формируются, как правило, позже. Более чем у трети пожилых пациентов симптомы раздражения мозговых оболочек не выявляются.
Вегетативные симптомы представлены багрово-красными, покрытыми потом кожными покровами, хриплым, стридорозным или типа Чейна-Стокса дыханием, напряженным пульсом, повышением АД, быстро возникающей гипертермией.
Очаговая симптоматика при ВК зависит от локализации поражения. Как правило, на раннем этапе заболевания выявляются афатические нарушения, парезы отдельных черепных нервов, гемипарезы, нарушения чувствительности.
Кровоизлияния в скорлупу – наиболее частая локализация ВМК (около 35% всех случаев). Симптоматика сильно варьируется в зависимости от размеров очага кровоизлияния – от легкого контралатерального гемипареза и дисфазии до глубокой комы с децеребрационной ригидностью при прорыве крови в желудочковую систему. Летальность при этом типе ВМК составляет 37%. Благоприятные исходы наблюдаются при ВМК небольшого размера, которые до появления КТ расценивали как ишемический инсульт.
Таламические кровоизлияния составляют 10–15% всех ВМК. Очаговая симптоматика зависит от места кровоизлияния внутри таламуса: гемисенсорные нарушения, апатия – при переднебоковой, гемианопсия при заднебоковой, сонливость, маленькие ареактивные зрачки – при медиальной и заднебоковой, паралич взора вверх – при медиальной, дисфазия – при левосторонней дорсальной, пространственная дезориентация – при правосторонней дорсальной локализации. Часто наблюдаются двигательные нарушения вследствие вовлечения внутренней капсулы и косоглазие.
Кровоизлияния в хвостатое ядро ответственны примерно за 5% ВМК и характеризуются преобладанием общемозговых симптомов из-за быстрого проникновения крови в желудочки, чем напоминают САК. Может наблюдаться небольшая, часто преходящая, очаговая симптоматика (гемипарез, отведение глаз в сторону очага поражения, синдром Хорнера). Основная дифференциальная диагностика проводится с АА передней соединительной артерии с прорывом крови через прозрачную перегородку в желудочковую систему. У большинства пациентов с кровоизлиянием в хвостатое ядро наблюдается хороший исход, часто без неврологического дефицита, даже после внутрижелудочкового кровоизлияния, что связано с минимальной деструкцией паренхимы мозга.
Долевые кровоизлияния – вторая по частоте локализация ВМК (25% от числа всех ВМК). Субкортикальная локализация очага при этом типе ВМК обусловливает редкое развитие глубоких форм нарушений сознания. Очаговые нарушения определяются местом ВМК: для лобно-теменной локализации характерны двигательные и гемисенсорные нарушения, отведение глаз в сторону очага поражения, для височно-теменной – дисфазия с сохранным повтором слов, для затылочной – гомонимная гемианопсия. У 25–30% больных отмечается судорожный синдром. Прогноз благоприятный по сравнению с ВМК в базальные ганглии.
Кровоизлияния в мозжечок встречаются в 5–10% случаев. Характерно отсутствие двигательных и чувствительных нарушений при сильной выраженности головокружения и рвоты. Часто наблюдаются атаксия, дизартрия, отведение глаз в сторону, противоположную очагу, ипсилатеральный периферический парез лицевого нерва. Во многих случаях такая симптоматика максимально выражена с самого начала ВМК без характерного нарастания клинических проявлений. У части же больных после периода относительной стабильности наблюдается резкое ухудшение состояния вплоть до комы и летального исхода, что обусловлено компрессией ствола мозга. Облитерация ипсилатеральной четверохолмной цистерны на КТ – ранний признак воздействия гематомы на ствол и требует проведения неотложного хирургического вмешательства для ее эвакуации.
Кровоизлияния в мост наблюдаются приблизительно в 5% случаев. Массивное двустороннее ВМК вызывает кому, тетраплегию, горизонтальную офтальмоплегию, точечные, но реагирующие на свет зрачки, нарушение дыхания и гипертермию. Одностороннее поражение проявляется межъядерной офтальмоплегией, парезом V и VII черепных нервов, различной степени двигательными и чувствительными нарушениями. Летальность при этом типе ВМК – около 60%. При вовлечении в процесс продолговатого мозга наблюдаются нистагм, ипсилатеральная гемиатаксия, икота, парез XII черепного нерва, дизартрия, синдром Хорнера, контралатеральная гемианестезия.
Кровоизлияния в средний мозг встречаются крайне редко, характеризуются парезом III черепного нерва, гемиатаксией, синдромом Хорнера, иногда гемипарезом.
Внутрижелудочковые кровоизлияния (ВЖК) являются, как правило, вторичными, то есть следствием прорыва внутрипаренхиматозного очага в желудочковую систему. Первичное ВЖК встречается в 30% случаев всех ВМК. Клиническая картина первичного ВЖК: острая головная боль, тошнота, рвота и потеря сознания при минимальном или отсутствующем очаговом дефиците. Первичные ВЖК, как и вторичные, отличаются особой тяжестью и часто приводят к летальному исходу.
Тяжесть состояния больного непосредственно после кровоизлияния и в последующие дни зависит прежде всего от выраженности общемозговых и дислокационных симптомов, в свою очередь обусловленных объемом внутримозговой гематомы и ее расположением. При обширных кровоизлияниях и кровоизлияниях глубинной локализации в клинической картине довольно быстро появляется вторичная стволовая симптоматика, обусловленная дислокацией мозга.
Для кровоизлияний в ствол мозга и обширных гематом мозжечка характерно быстрое нарушение сознания и витальных функций. Наиболее тяжело протекают кровоизлияния с прорывом в желудочковую систему. Для них характерны горметонические судороги, гипертермия, быстрое угнетение сознания, развитие стволовых симптомов.
Течение
Наиболее тяжелым периодом кровоизлияния, особенно при обширных гематомах, бывают первые 2–3 недели болезни. Тяжесть состояния больного на этом этапе обусловлена как самой гематомой, так и нарастающим в первые дни заболевания отеком мозга, что выражается в появлении и прогрессировании общемозговых и дислокационных симптомов. Отек и дислокация мозга становятся основной причиной смерти больных в остром периоде заболевания.
Для этого периода типично также присоединение или декомпенсация имевшихся ранее соматических осложнений (пневмония, нарушение функций печени и почек, сахарный диабет и др.). В связи с обездвиженностью больного большую опасность представляет тромбоэмболия легочной артерии. К концу 2–3-й недели у выживших больных начинается регресс общемозговых симптомов, на первый план выходят последствия очагового поражения мозга, в дальнейшем определяющие степень инвалидизации больного.
Лабораторные и инструментальные исследования
Лабораторные исследования
- общий анализ крови с подсчетом тромбоцитов;
- общий анализ мочи;
- КФК;
- МНО, АЧТВ, фибриноген;
- холестерин крови, ЛПВП, ЛПНП, триглицериды;
- электролиты крови;
- АлаТ, АсаТ, общий, прямой билирубин;
- мочевина, креатитин;
- общий белок и белковые фракции;
- исследования крови на ВИЧ, гепатиты В., С, сифилис;
- определение группы крови и резус фактора.
Инструментальные методы
Основные методы
КТ является методом выбора для диагностики геморрагического инсульта. Чувствительность и специфичность КТ в диагностике паренхиматозных кровоизлияний супра- и субтенториальной локализации приближается к 100%. Очаг кровоизлияния выявляется на КТ с момента его возникновения в виде зоны высокой плотности. Относительно часто в острейший период по периферии ограниченных, располагающихся в глубинных отделах полушарий гематом выявляется область отека в виде сигнала пониженной плотности. Динамика изменения сигнала от зоны кровоизлияния определяется размерами гематомы. При небольших кровоизлияниях сигнал высокой плотности может наблюдаться в течение 7–10 дней, от массивных гематом – дольше, до 3–4 недель. Эволюция сигнала от гематомы, связанная с ее рассасыванием и формированием кисты, начинается с 4–5-х суток после инсульта с периферии кровоизлияния и сопровождается понижением плотности. В дальнейшем по мере рассасывания крови зона пониженной плотности распространяется на центральные части кровоизлияния и исходом гематомы является формирование кистозной полости с гомогенным сигналом низкой плотности, идентичной плотности ЦСЖ, и четкими границами.
МРТ. В острейшую фазу ГИ МРТ обладает меньшей информативностью, чем КТ, и её проведение предпочтительнее для анализа динамики гематомы и ретроспективного изучения характера перенесенного инсульта. Изменения, наблюдаемые на МРТ у больных с кровоизлияниями, обусловлены превращением оксигемоглобина в деокси- и метгемоглобин, а затем – в ферритин и гемосидерин. Выраженность и временные параметры наблюдаемых изменений зависят от напряженности магнитного поля томографа, т.к. степень потери сигнала от деоксигемоглобина и гемосидерина на Т2-взвешенных снимках прямо связана с силой магнитного поля.
В хронической стадии в стенках кисты после ГИ находятся гемосидерин и ферритин. На Т2-взвешенных изображениях это проявляется потерей сигнала от стенок кисты (темное кольцо), наличие которого позволяет дифференцировать кисту после геморрагического инсульта от последствий ишемического инсульта.
При отсутствии нейровизуализации ошибки в распознавании характера инсульта имеют место в 1/3 всех случаев.
Дополнительные инструментальные методы:
- КТ-ангиография (КТ с контрастированием) – метод, позволяющий идентифицировать пациентов с высоким риском увеличения гематомы на основании экстравазации контраста в гематому.
- МРТ и КТ в сосудистых режимах (ангио- и венография) – достаточно чувствительные методы диагностики вторичных причин геморрагии, таких как артериовенозные мальформации, опухоли, болезнь Мойя-мойя и тромбоз церебральных вен.
- Если данные рутинной визуализации (локализация, размер зоны отека, патологический сигнал от церебральных синусах) предполагают тромбоз церебральных вен, то следует провести МР- или КТ-венографию.
- Церебральная ангиография. Дигитальная субтракционная ангиография позволяет выявить источник кровоизлияния (при подозрении на аневризму, артериовенозную мальформацию, кавернозную ангиому) для принятия решения о проведении хирургического вмешательства.
- Спинномозговая пункция. При невозможности проведения нейровизуализации люмбальная пункция является одним из значимых методов подтверждения диагноза при кровоизлиянии в мозг.
- Транскраниальная допплерография (ТКДГ) является методом, который может помочь в косвенной оценке масс-эффекта и отслеживании изменений внутричерепного давления.
- ЭКГ
По показаниям проводятся также:
- холтеровское мониторирование ЭКГ;
- ЭхоКГ проводится пациентам (с наличием кардиальной патологии в анамнезе, выявленной при объективном исследовании или по данным ЭКГ);
- рентгенография легких.
Дифференциальный диагноз
ВМК следует дифференцировать прежде всего с ИИ, так как принципы лечения этих состояний различны. Следует отметить, что не существует достоверных клинических симптомов, позволяющих дифференцировать ГИ и ИИ, поэтому для разграничения этих процессов необходимо проводить КТ и/или МРТ головного мозга.
Для ишемического инсульта характерны более медленное нарастание общемозговых симптомов, отсутствие менингеальных симптомов, в ряде случаев – наличие предвестников в виде преходящих нарушений мозгового кровообращения, нарушения сердечного ритма в анамнезе.
Определенную помощь в дифференциальной диагностике может оказать люмбальная пункция: при ишемическом инсульте ликвор имеет нормальный состав, при геморрагическом может содержать примесь крови. Необходимо подчеркнуть, что при общем тяжелом состоянии больного люмбальную пункцию лучше не делать или выполнять ее с осторожностью, поскольку выведение ликвора может вызвать дислокацию мозга.
Внутримозговые гематомы гипертонического генеза необходимо также дифференцировать от гематом другой этиологии, а также от кровоизлияний в очаг ишемии или опухоль. Большое значение при этом имеют анамнез заболевания, возраст больного, локализация гематомы в веществе мозга.
При кровоизлиянии из аневризмы гематомы имеют типичную локализацию – медиобазальные отделы лобной доли при аневризмах передней мозговой/передней соединительной артерии и базальные отделы лобной и височной долей, прилежащие к сильвиевой щели, при аневризмах внутренней сонной или средней мозговой артерии.
При МРТ можно также видеть саму аневризму или патологические сосуды артериовенозной мальформации. При подозрении на разрыв аневризмы или артериовенозной мальформации, на что в первую очередь может указывать молодой возраст больного, необходимо проведение ангиографического обследования.
Для субарахноидального кровоизлияния (САК) характерно начало с интенсивной головной боли, наличие выраженного менингеального синдрома. При САК значительно реже, чем при ВМК, наблюдается очаговая симптоматика и угнетение сознания. Диагностика проводится на основании данных нейровизуализации и ангиографии.
Для травматической субдуральной или эпидуральной гематомы характерна травма головы в анамнезе, наличие следов травмы на голове при осмотре. В типичном случае при острых травматических гематомах наблюдается кома (сопор) с анизокорией и контралатеральным гемипарезом. Точная диагностика возможна при КТ или МРТ головного мозга.
Признаки, свидетельствующие скорее в пользу ВМК:
- длительно существующая АГ;
- развитие во время эмоционального или физического перенапряжения;
- высокое АД в дебюте;
- выраженная общемозговая симптоматика;
- гиперстеническая конституция, багрово-синюшное лицо, тошнота, рвота;
- бурное развитие очаговой и общемозговой симптоматики;
- редкость преходящих нарушений мозгового кровообращения в анамнезе;
- возраст (не является определяющим фактором, но при ИИ больные, как правило, старше).
ЛЕЧЕНИЕ
Немедикаментозное лечение
Хирургическое лечение
Решение о показаниях к удалению гематомы зависит от многих факторов. Наиболее важные из них – объем и локализация излившейся крови в сочетании с состоянием больного. При обосновании операции основная цель – спасение жизни больного, поэтому большинство вмешательств выполняют в ближайшие сроки после кровоизлияния. В некоторых случаях показанием к операции может служить более эффективное восстановление очаговых неврологических нарушений. Подобные операции могут быть отсроченными.
Сравнительный анализ результатов консервативного и хирургического лечения показал, что при супратенториальных гематомах объемом до 30 мл хирургическое лечение нецелесообразно независимо от локализации гематомы, так как гематомы небольшого объема редко бывают причиной витальных нарушений. При гематомах объемом более 60 мл исход в целом хуже при консервативном лечении.
Наиболее сложно определить показания к операции при гематомах среднего объема (30–60 мл). В этих случаях прогностически значимыми могут быть степень нарушения сознания, выраженность дислокационных симптомов, локализация гематомы, выраженность перифокального отека мозга, наличие сопутствующего вентрикулярного кровоизлияния. Противопоказанием к операции считают коматозное состояние, особенно с выраженным нарушением стволовых функций, так как при попытках оперировать таких больных неблагоприятный исход (смерть или вегетативное состояние) достигает 100%. Неблагоприятна локализация гематом в глубинных структурах, а также объем гематомы более 100 мл.
При гематомах мозжечка показания к операции шире, так как гематомы этой локализации могут приводить к быстрому нарушению витальных функций.
Таким образом, хирургические вмешательства, направленные на удаление внутримозговой гематомы, показаны преимущественно больным с лобарными или латеральными гематомами объемом более 50 мл, а также больным с гематомами мозжечка.
Удаление гематомы может проводиться как открытым способом – путем энцефалотомии, так и пункционно-аспирационным методом, который может быть дополнен дробным введением фибринолитиков. Последний метод показан при отсутствии выраженной дислокации мозга и стабильном состоянии больного. Помимо удаления гематом может возникнуть необходимость в дренировании желудочков. Наложение наружных вентрикулярных дренажей показано при массивном вентрикулярном кровоизлиянии, окклюзионной водянке у больных с гематомами мозжечка, а также для контроля внутричерепного давления. При неконтролируемом отеке мозга после удаления гематомы возможно проведение декомпрессивной трепанации.
Медикаментозное лечение
Принципы консервативного лечения больных ВМК соответствуют общим принципам лечения больных с любым видом инсульта. Лечебные мероприятия следует начинать на догоспитальном этапе, оценив в первую очередь адекватность внешнего дыхания и сердечно-сосудистой деятельности. При признаках дыхательной недостаточности необходима интубация с подключением ИВЛ. В коррекции состояния сердечно-сосудистой системы наибольшее значение имеет нормализация АД: как правило, у больных с ВМК оно значительно повышено.
Лечение ВМК в стационаре предусматривает проведение базисной и специфической терапии.
Базисная терапия ВМК
Под базисной терапией подразумеваются основные терапевтические стратегии, направленные на стабилизацию состояния тяжелобольных пациентов и коррекцию тех нарушений, которые могут осложнить восстановление неврологических функций. Базисная терапия является недифференцированной и не зависит от характера инсульта (ишемический или геморрагический). Она включает поддержание функций дыхания и кровообращения, коррекцию метаболических и волемических нарушений, контроль уровня артериального давления, профилактику и лечение таких состояний, как припадки, венозные тромбозы, дисфагии, аспирационные пневмонии и другие инфекционные осложнения, коррекцию повышенного внутричерепного давления.
Рекомендации
Начальный мониторинг и ведение пациентов с ВМК должно проводиться в блоке интенсивной терапии и реанимации сосудистого отделения с врачами и сестрами, компетентными в вопросах острых нарушений мозгового кровообращения
Рекомендуется проведение мониторинга частоты сердечных сокращений, артериального давления, температуры, сатурации кислородом, неврологического статуса (с использованием шкалы инсульта NIH), в течение 72 часов у больных с сохраняющимся неврологическим дефицитом.
Всем больным со снижением уровня сознания (8 баллов и меньше по шкале комы Глазго) показана интубация трахеи. Кроме того, интубация показана при аспирации или высоком ее риске при неукротимой рвоте и выраженном бульбарном или псевдобульбарном синдроме. Решение вопроса о необходимости ИВЛ принимают исходя из основных общих реанимационных положений:
- тахипноэ 35–40 в 1 мин., брадипноэ менее 12 в 1 мин.
- снижение рО2 менее 60 мм. рт.ст., увеличение рСО2 более 50 мм. рт.ст. в артериальной крови и жизненная емкость легких менее x12 мл/кг массы тела нарастающий цианоз;
Все больные со сниженным уровнем бодрствования, наличием клинических либо нейровизуализационных признаков отека головного мозга и/или повышенного внутричерепного давления должны находиться в постели с приподнятым до 30° головным концом (без сгибания шеи!). У этой категории больных должны быть исключены или сведены к минимуму эпилептические припадки, кашель, двигательное возбуждение и боль.
Рекомендуется подача кислорода в случае снижения показателя сатурации кислородом ниже 95%.
Рекомендуется регулярный мониторинг жидкостного и электролитного баланса у пациентов с тяжелым инсультом или с расстройствами глотания.
Скрининг дисфагии должен осуществляться у всех пациентов до начала перорального питания для уменьшения риска пневмонии.
Раствор хлорида натрия 0,9% рекомендуется для восполнения водного баланса в течение первых 24 часов от начала инсульта.
Необходимо контролировать АД у всех пациентов с ВМК. Контроль АД должен быть начат незамедлительно после начала ВМК. Для пациентов с ВМК с САД от 150 до 220 мм. рт.ст. без противопоказаний для быстрой гипотензивной терапии, быстрое снижение САД до 140 безопасно, позволяет ограничить рост гематомы и, возможно, отека мозга и может быть эффективным для улучшения функционального исхода. Разумные долгосрочные целевые значения АД – САД<130 и ДАД=80. Для пациентов с ВМК с очень высоким САД>220 может быть разумным рассмотрение агрессивного снижения АД методом продолжающейся в/в инфузии и частого мониторинга АД. Для снижения АД используют эсмолол, эналаприлат, нитропруссид натрия. Предпочтение отдаётся антигипертензивным препаратам для внутривенного введения.
Рекомендовано возмещение объема жидкости при низком артериальном давлении, возникшем вследствие гиповолемии или явившимся причиной неврологического ухудшения в остром периоде инсульта. Объем парентерально вводимой жидкости (из расчета 30–35 мл/кг, может варьироваться от 15–35 мл/кг) с поддержанием гематокрита 30–33%. Для коррекции гиповолемии рекомендуется физиологический раствор хлорида натрия. Суточный баланс введенной и выведенной жидкости должен составлять 2500–2800 мл/1500–1800 мл, т.е. должен быть положительным. В случае развития отека мозга, отека легких, сердечной недостаточности рекомендуется слегка отрицательный водный баланс.
Недопустима терапия гипоосмолярными растворами (например 5%-ная глюкоза) при опасности повышения внутричерепного давления.
Рекомендуется мониторинг уровня глюкозы. Следует избегать гипер- и гипогликемии. При уровне гликемии >180 мг/дл (>10 ммоль/л) рекомендуется снижение уровня глюкозы сыворотки крови при помощи инсулина. При гипогликемии (<50 мг/дл [<2,8 ммоль/л]) рекомендуется внутривенное введение декстрозы или инфузия 10–20%-ного раствора глюкозы.
Рекомендуется поиск сопутствующей инфекции при повышении температуры тела >37,5°C.
Рекомендуется лечение лихорадки (при температуре >37,5°C) при помощи парацетамола и физического охлаждения. Особенно жестко необходимо контролировать и корригировать температуру тела пациентам с нарушенным сознанием, так как гипертермия увеличивает размер инфаркта и отрицательно влияет на клинический исход.
Профилактическое назначение антибиотиков не рекомендуется у иммунокомпетентных пациентов.
Для профилактики тромбоза глубоких вен голени всем больным показано ношение компрессионных чулок до полного восстановления нарушенных двигательных функций, прерывистая пневмокомпрессия. После того как задокументировано прекращение кровотечения, на 1–4-й день после развития ВМК, можно думать о назначении низких доз НМГ или нефракционированного гепарина (НФГ) с целью профилактики венозной тромбоэмболии у пациентов, которые ограничены в движениях.
Явные судорожные припадки следует лечить антиконвульсантами. Пациентам, у которых отмечаются ЭЭГ-признаки судорожных приступов на фоне изменения сознания, следует назначать антиконвульсанты. Не стоит назначать антиконвульсанты с профилактической целью. Для купирования судорожного синдрома применяются диазепам, кислота вальпроевая, карбамазепин, при рефрактерном эпилептическом статусе – тиопентал натрия, пропофол.
Специфическая патогенетическая терапия
Пациентам с ВМК и нормальными показателями системы свертывания крови и сосудисто-тромбоцитарного гемостаза специфическая гемостатическая терапия, направленная на остановку кровотечения, в настоящее время не рекомендуется. В этих случаях патогенетическим методом лечения является поддержание оптимального артериального давления.
Специфическая терапия ВМК при нарушениях системы свертывания крови и сосудисто-тромбоцитарного гемостаза.
Пациенты с ВМК и выраженным дефицитом факторов свертывания или тяжелой тромбоцитопенией должны получать заместительную терапию соответствующими факторами свертывания или тромбоцитами соответственно.
Пациентам с ВМК и превышением МНО на фоне приема антагонистов витамина К (АВК) (варфарин – Варфарекс, Варфарин Никомед) необходимо снижение МНО путем введения свежезамороженной плазмы (СЗП) в дозе 20 мл на 1 кг массы тела в комбинации с витамином К. Вначале в/в вводят витамин К (Викасол) в дозировке 10 мг в течение 10 мин и половину дозы СЗП (10 мл на 1 кг массы тела). Одна доза СЗП составляет 200–250 мл. После повторного измерения МНО повторяют инфузию СЗП в дозе 10 мл на 1 кг массы тела каждые 20–30 мин до восстановления необходимого уровня МНО.
Применение концентрата протромбинового комплекса у этих больных может быстрее корректировать МНО и давать меньше осложнений по сравнению с СЗП.
Пациентам с ВМК на фоне приема гепарина проводят нормализацию АЧТВ (активированного частичного тромбопластинового времени) с помощью протамина сульфата, который вводится внутривенно медленно (не быстрее 5 мг/мин). Доза протамина сульфата рассчитывается в зависимости от времени, прошедшего после последней инъекции гепарина. Если это время находится в пределах 30–60 мин после последней инъекции гепарина, то доза протамина сульфата составляет 0,5–0,75 мг на 100 МЕ гепарина, 60–120 мин – 0,375–0,5 мг протамина сульфата на 100 МЕ гепарина и >120 мин – 0,25–0,375 мг на 100 МЕ гепарина. Общая доза протамина сульфата не должна превышать 50 мг.
Пациентам с ВМК, которые принимают новые пероральные антикоагулянты (дабигатран, ривароксабан, апиксабан), для коррекции гемостаза рекомендуются антиингибиторный коагулянтный комплекс Фейба (Feiba) и другие концентраты протромбинового комплекса.
При ВМК, обусловленным тромбоцитопенией применяется тромбоцитарная масса для поддержания числа тромбоцитов на уровне >50 тыс/мкл. Польза переливания тромбоцитарной массы пациентам с ВМК, которые принимали антиагреганты, доказана недостаточно и требует дальнейшего изучения.
Не рекомендуется использование аминокапроновой кислоты и рекомбинантного фактора VIIa, т.к. они повышают риск тромбоэмболических осложнений.
Оценка эффективности лечения
Эффективность лечения оценивается по достижению целей и задач проводимой терапии:
- полная стабилизация жизненно важных функций (дыхание, центральная гемодинамика, оксигенация, водно-электролитный баланс, углеводный обмен);
- минимизация неврологического дефицита и отсутствие неврологических осложнений (отек головного мозга, судорожный синдром, острая окклюзионная гидроцефалия, дислокация), подтвержденное данными нейровизуализации (КТ, МРТ);
- отсутствие соматических осложнений (пневмония, ТЭЛА, тромбоэмболии глубоких вен нижних конечностей, пролежни, пептические язвы, инфекции мочевыводящих путей и др.);
- нормализация уровня АД;
- восстановление повседневной независимости и по возможности – трудоспособности.
Для объективизации динамического контроля эффективности лечения ВМК рекомендуется использовать шкалу инсульта NIH.
Осложнения и побочные эффекты лечения
Переливание СЗП может сопровождаться посттрансфузионными пирогенными, антигенными (негемолитическими), аллергическими и анафилактическими реакциями.
Ошибки и необоснованные назначения
Препараты, применение которых при ВМК не рекомендуется:
- эуфиллин (может вызывать синдром обкрадывания);
- хлористый кальций и викасол при нормальных показателях свертывания крови;
- аминокапроновая кислота;
- рекомбинантный фактор VIIa;
- дексаметазон, преднизолон (гормональные препараты не уменьшают отек головного мозга при инсульте);
- нифедипин (резко снижает уровень АД);
- в настоящее время отсутствуют рекомендации по лечению ВМК при помощи нейропротективных препаратов, в т.ч. ноотропов (пирацетам, ноотропил, инстенон, пикамилон и др.);
- назначение непосредственно после развития ВМК препаратов, резко форсирующих диурез (фуросемида, манитола) снижает минутный объём крови, увеличивает осмолярность плазмы и нарушает микроциркуляцию.
ПРОГНОЗ
Прогноз при геморрагическом инсульте в целом неблагоприятен. Общая летальность достигает 60–70%, после удаления внутримозговых гематом – 50%. По данным консолидированных мировых исследований, 35–50% больных умирают в первые 30 суток после церебральной геморрагии, при этом половина из них – в первые 2 суток. Только 10% больных к концу первого месяца являются независимыми в повседневной жизни и только 20% больных независимы к полугоду. Основными причинами смерти как оперированных, так и неоперированных больных бывают нарастающий отек и дислокация мозга (30–40%) и рецидив кровоизлияния (10–20%). Примерно 2/3 больных, перенесших инсульт, остаются инвалидами. Основными факторами, определяющими исход заболевания, считают объем гематомы, сопутствующий прорыв крови в желудочки, локализацию гематомы в стволе мозга, предшествующий прием антикоагулянтов. Кроме этого исходы заболевания зависят от тяжести состояния больного при поступлении (неблагоприятным фактором является оценка состояния ниже 8 баллов по шкале ком Глазго), возраста пациента старше 70 лет, сопутствующей со стороны других органов и систем патологии (заболевания сердца, печени, диабет и др.).
Кровоизлияния в мозг приводят к двум основным церебральным осложнениям тяжелого инсульта – отеку мозга и острой обструктивной гидроцефалии. Эти осложнения развиваются со 2–3-х суток инсульта и определяют его исход в основном на протяжении первых 7–10 дней.



