Введение
Статины являются эффективным фармакологическим классом препаратов для лечения дислипидемии, широко применяются в клинической практике для первичной и вторичной профилактики сердечно-сосудистых заболеваний и их осложнений. Эффективность статинов связана не только с высокой липидснижающей активностью, но и с многочисленными плейотропными эффектами, значимо влияющими на атерогенез. Вместе с тем, несмотря на эффективность и клиническую пользу статинов в лечении сердечно-сосудистых заболеваний, на протяжении последних 10 лет при их применении описаны случаи новых нежелательных реакций как со стороны когнитивных функций, так и в плане развития СД 2 типа (СД2).
Выявление случаев развития СД на фоне лечения статинами было показано после переоценки (post hoc analysis) результатов ряда крупных рандомизированных клинических исследований (РКИ), в которых СД не был включен в перечень исследуемых конечных точек, и в наблюдательных когортных исследованиях.
Накопленные данные РКИ и последующие их мета-анализы показали, что прием статинов связан с небольшим, но статистически достоверным увеличением (на 9%) риска развития СД2 [1] и что интенсивная терапия статинами в высоких дозах может определять более высокий, чем умеренные дозы, риск развития СД – на 12% [2]. В 2012 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) США обновило маркировку для всех статинов, включив предупреждение о возможном повышении уровней глюкозы и гликированного гемоглобина (HbA1c) в крови, аналогичная обеспокоенность была высказана Европейским агентством по оценке лекарственных средств (ЕМЕА) [3]. Вместе с тем применение статинов в борьбе с сердечно-сосудистыми заболеваниями имеет более выраженные преимущества (пользу), несмотря на риск развития диабета, причем снижение рисков сердечно-сосудистой заболеваемости и смертности наблюдается у пациентов как без СД, так и с его наличием [4].

Существует несколько потенциальных механизмов развития СД на фоне применения статинов (см. рисунок, табл. 1) [5–7]. Одним из механизмов служит ингибирование секреции инсулина как за счет блокирования процессов фосфорилирования и снижения действия АТФ-синтазы, так и под влиянием воздействия на потенциалзависимые кальциевые каналы в β-клетках поджелудочной железы. Статины могут непосредственно блокировать кальциевые каналы L-типа, ингибируя индуцированную глюкозой передачу сигналов в β-клетках и снижая секрецию инсулина. Другой механизм состоит в снижении экспрессии мембранного транспортера глюкозы GLUT-4, отвечающего за поглощение глюкозы как жировыми, так и мышечными клетками в присутствии инсулина. При применении статинов за счет снижения уровня GLUT-4 и чувствительности к инсулину может нарушаться утилизация глюкозы клетками, что в конечном итоге приводит к нарушению толерантности, гипергликемии и инсулинорезистентности. Также терапия статинами уменьшает содержание таких важных соединений, как коэнзим Q10, фарнезилпирофосфат, геранилгеранилпирофосфат и долихол; их истощение приводит к снижению внутриклеточной передачи сигналов, участвующих в метаболизме гликопротеинов. К другим возможным механизмам воздействия статинов на развитие СД относятся ингибирование дифференцировки адипоцитов, приводящее к уменьшению количества γ-пероксисом пролиферируемых активируемых рецепторов и CCAAT-потенцирующего связывающего белка, которые являются важным механизмом гомеостаза глюкозы; снижение содержания лептина, вызывающее ингибирование пролиферации β-клеток и секреции инсулина; снижение уровня адипонектина [5–7]. Кроме того, показано, что статины увеличивают размер частиц холестерина липопротеинов очень низкой плотности (ЛПОНП), при этом уменьшая размеры частиц липопротеинов низкой (ЛПНП) и высокой плотности (ЛПВП), а также объединенный показатель резистентности к липопротеинам и инсулину (LPIR, lipoprotein insulin resistance), что приводит к увеличению заболеваемости СД [6].
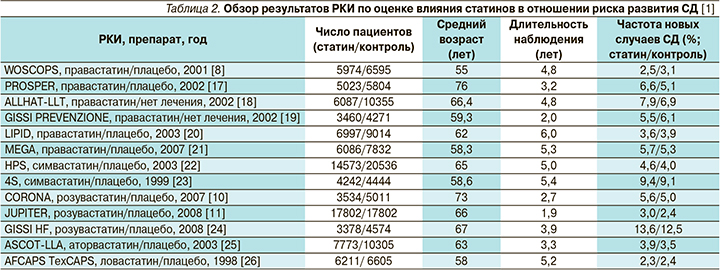
Новые случаи СД в РКИ со статинами
В первом крупном РКИ WOSCOPS (West of Scotland Coronary Prevention Study, n=6 595) по применению правастатина пациентами с гиперхолестеринемией отмечено снижение риска развития СД [8]. Однако в последующих РКИ с применением разных статинов выявлено увеличение частоты возникновения новых случаев СД.
В частности, при анализе данных исследования PROVE-IT TIMI 22 правастатин ухудшал контроль гликемии: у 3382 пациентов без анамнеза СД2 уровень HbA1c в среднем повысился на 0,12% на фоне применения дозы 40 мг и на 0,30% на фоне применения дозы 80 мг (р<0,0001) [9].
В отношении розувастатина наблюдалась аналогичная картина. В крупном РКИ CORONA (Controlled Rosuvastatin Multinational Trial in Heart Failure; n=5 011) на фоне применения розувастатина среди пожилых пациентов с хронической сердечной недостаточностью не было отмечено большей по сравнению с плацебо частоты новых случаев СД [10]. Однако в рамках другого крупного РКИ JUPITER (Justification for the Use of Statins in Primary Prevention; n=17 603) был проведен специальный анализ по оценке связи между применением розувастатина и риском развития СД [11]. Пациенты были стратифицированы на основании наличия или отсутствия по крайней мере одного из четырех основных факторов риска развития СД: метаболического синдрома, нарушения уровня глюкозы натощак, индекса массы тела ≥30 кг/м2 или гликированного гемоглобина (HbA1c) >6%. По данным анализа, у 486 участников исследования в период наблюдения развился СД – 270 случаев на розувастатине против 216 на плацебо (относительный риск [ОР]=1,25; p=0,01). По сравнению с плацебо розувастатин ускорил среднее время до постановки диагноза СД на 5,4 недели (84,3 против 89,7 недели). В подгруппе пациентов с одним или несколькими основными факторами риска СД (n=11 508) выявлен более высокий, чем в подгруппе без этих факторов (n=6095), риск развития СД: у пациентов с 1–2 факторами риска ОР=1,2 и у пациентов с 3–4 факторами ОР=1,4.
В объединенном анализе 3 крупных РКИ: TNT (Treating to New Targets, n=3 798), IDEAL (Incremental Decrease in End Points Through Aggressive Lipid Lowering, n=7 461) и SPARCL (Stroke Prevention by Aggressive Reduction in Cholesterol Levels, n=3 803), проведена оценка связи между приемом аторвастатина в высокой и низкой дозах (80 и 10 мг/сут) и риском развития СД2 [12]. Было выявлено четыре фактора риска развития СД на фоне применения статина: уровень глюкозы в крови натощак >100 мг/дл, уровень триглицеридов в крови натощак >150 мг/дл, индекс массы тела >30 кг/м2 и анамнез артериальной гипертензии. При наличии 0–1 фактора риска доза аторвастатина существенно не влияла на риск развития диабета, тогда как при наличии 2–4 факторов применение его высокой дозы значимо повышало риск СД (ОР=1,24; р=0,0027) [13].
В то же время в мета-анализе РКИ с применением питавастатина не было выявлено значимого увеличения частоты случаев СД (0,5 против 0,98% в контроле) и ОР СД составил 0,70 (ДИ – 0,30–1,61), т.е. не был статистически значимым [14].
Первые мета-анализы РКИ по оценке риска развития СД на фоне применения статинов были проведены при объединении результатов 6 проспективных крупных исследований (WOSCOPS, HPS, LIPID, JUPITER, ASCOT-LLA, CORONA) [15, 16].
В мета-анализе C.I. Coleman et al. (n=39 791) объединение данных всех РКИ не выявило достоверного увеличения риска развития СД (ОР=1,03; 96% доверительный интервал [ДИ] – 0,89–1,19). Однако анализ по отдельным препаратам статинов обнаружил различия: для правастатина снижение риска (ОР=0,84; 95% ДИ – 0,86–1,49), для аторвастатина, симвастатина и розувастатина – его повышение (ОР=1,14; 95% ДИ – 1,02–1,28) [15]. В мета-анализе S.N Rajpathak. et al. (n=57 593) включение в него всех РКИ не показало увеличения риска СД (ОР=1,06; 95% ДИ – 0,92–1,25), но при исключении WOSCOPS риск развития СД составил 13% (ОР=1,13; 95% ДИ – 1,03–1,23) [16].
В мета-анализ N. Sattar et al. включено 13 РКИ с участием 91 140 пациентов, из которых СД развился у 226 из группы статинов и 2 052 – из группы контроля, при среднем периоде наблюдения 4 года [1]. Частота развития случаев СД в группах статинов разных РКИ колебалась в диапазоне 2,3–13,6 против 2,4–12,5% в контроле (плацебо или без лечения; табл. 2).

Объединение всех РКИ показало увеличение ОР развития новых случаев СД при применении статинов до 9% (ОР=1,09; 95% ДИ – 1,02–1,17), а число пациентов, леченных статинами, необходимое для развития одного неблагоприятного случая (number needed to harm, NNH) по диабету, по сравнению с контролем составило 255 [1]. При сравнении разных препаратов статинов наиболее значимый риск ассоциировался с аторвастатином и розувастатином (табл. 3), хотя при сравнении по степени липофильности не было получено различий между липофильными и гидрофильными статинами (OР=1,10 и OР=1,08 соответственно).
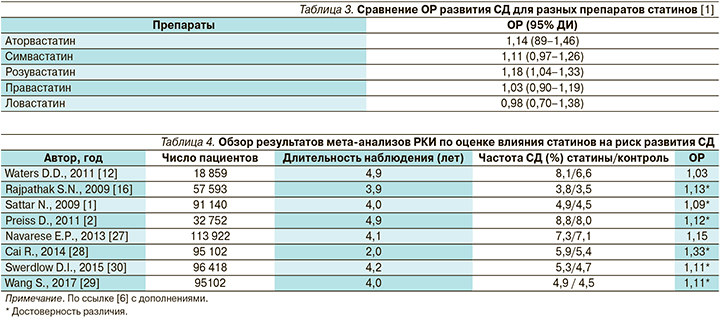
Обзор результатов мета-анализов РКИ по оценке влияния статинов на риск развития СД представлен в табл. 4 [6].
В ряде мета-анализов оценивалась связь между дозами статинов и риском развития СД. Так, в мета-анализе D. Preiss et al., объединившем 5 РКИ (PROVE IT–TIMI 22, TNT, IDEAL, SEARCH, A to Z) с участием 32 752 пациентов с ИБС, проведено изучение связи между дозами двух статинов (аторвастатин 10 мг и 80 мг, симвастатина 20–40 мг и 80 мг) и риском развития диабета [2]. При использовании интенсивной терапии статинами в высоких дозах отмечено достоверное снижение частоты сердечно-сосудистых исходов на 16% (ОР=0,84; 95% ДИ – 0,75–0,94) с одновременным повышением риска новых случаев СД на 12% (ОР=1,12; 95%ДИ –1,04–1,22) по сравнению с умеренными дозами препаратов. При проведении интенсивной терапии статинами по сравнению с применением их умеренных доз показатель NNH по диабету составил 498, тогда как число пациентов, леченных высокими дозами статинов, необходимое для предотвращения 1 случая сердечно-сосудистых исходов (number needed to treat, NNT), составило 155.
В другом мета-анализе (E.P. Navarese et al.; 17 РКИ, n=113 394) была выявлена дозозависимая связь между розувастатином и риском развития диабета: ОР новых случаев СД был на 12% выше при приеме дозы 20 мг по сравнению с 10 мг [27].
В недавнем мета-анализе S. Wang et al. (14 РКИ, n=95 102) также было подтверждено, что терапия статинами ассоциируется с риском развития СД: ОР=1,11 (95% ДИ – 1,03–1,20) [29]. Кроме того, было показано, что риск развития СД увеличивается со степенью снижения концентрации ЛПНП: так, при степени снижения >30% риск составил 18% (ОР–1,18; 95% ДИ – 1,10–1,28), при снижении на 30–40 и 40–50% – на 13 и 29% соответственно. Это предполагает использование величины снижения уровня ЛПНП в качестве маркера риска развития СД на фоне терапии статинами, при этом снижение концентрации ЛПНП более чем на 30% во время гиполипидемической терапии требует мониторинга уровня глюкозы в крови для выявления случаев развития СД в группах высокого риска.
В целом при анализе результатов РКИ сделан следующий вывод: терапия статинами связана с небольшим повышением риска новых случаев СД, особенно в подгруппе пожилых пациентов, но риск низкий как в абсолютном выражении, так и по сравнению со снижением риска коронарных событий. Принимая во внимание убедительные данные о пользе статинов для предупреждения макрососудистых осложнений у пациентов с диабетом и без него, небольшое повышение риска развития СД благоприятно компенсируется сердечно-сосудистой пользой, что предполагает сохранение клинических показаний для пациентов высокого риска.
Новые случаи СД в наблюдательных исследованиях со статинами
За последние несколько лет после публикации мета-анализов РКИ стали поступать данные наблюдательных когортных исследований со статинами, специально проводимых для изучения частоты развития новых случаев СД в реальной клинической практике.
В систематическом обзоре R.D. Beckett et al. представлены результаты 14 наб-людательных исследований, проведенных в разных странах мира (табл. 5) [31]. Все они свидетельствуют о повышенном риске развития диабета, связанного с приемом статинов: диапазон абсолютной заболеваемости составляет 3,1–22,7%; показатель NNH по сравнению с отсутствием лечения достигает 53–67. Во всех наблюдательных исследованиях показано увеличение ОР развития СД для класса статинов на уровне от 10 до 48%, но для отдельных препаратов данные могут входить в противоречие с результатами РКИ. Так, в двух исследованиях аторвастатина и симвастатина выявлен повышенный риск СД, для розувастатина данные были противоречивыми, а в отношении правастатина относительный риск был также увеличен, что входит в противоречие с результатами РКИ WOSCOPS.

Только в одном когортном исследовании, в котором оценивали риск новых случаев СД для пациентов, получавших разные группы препаратов для профилактики кардиоваскулярного риска, статины ассоциировались с более высоким риском (ОР=3,3) по сравнению с антигипертензивными препаратами, вызывающими метаболические расстройства (тиазиды, β-адреноблокаторы) или имеющими нейтральный профиль (блокаторы РААС, антагонисты кальция) – ОР=2,32 и ОР=1,59 соответственно [32].
Кроме того, в наблюдательных исследованиях изучалась связь между интенсивностью терапии статинами и возникновением новых случаев диабета. В нескольких исследованиях показано, что интенсивная терапия статинами сопряжена с более высоким риском возникновения диабета, чем применение умеренных доз этих препаратов [33–35].
Различия в риске развития новых случаев СД у пациентов, получавших статины для первичной или вторичной профилактики, также рассматривались в нескольких исследованиях. В одном крупном популяционном исследовании риск развития СД существенно не различался у пациентов, применявших статины для первичной (ОР аторвастатина – 1,20; розувастатина – 1,12; симвастатина – 1,12) или вторичной профилактики (ОР аторвастатина – 1,25; розувастатина – 1,24; симвастатина – 1,14) [36]. Полученные данные свидетельствуют, что профиль «риск–польза» был сходным для пациентов, получавших статины в качестве первичной и вторичной профилактики; на пациентах, при этом на больных, получавших статины для вторичной профилактики, продемонстрирована их польза в плане предотвращения летальных исходов в стационаре, что перевешивало риск развития диабета по сравнению с контрольной группой.
Проведен мета-анализ наблюдательных исследований по оценке риска развития СД на фоне применения статинов, в который было включено 20 исследований: 18 когортных и 2 исследования «случай–контроль» [46]. В целом риск развития диабета был существенно выше у пациентов, принимавших статины (на 44%), по сравнению с непринимавшими этих препаратов (ОР=1,44; 95% ДИ – 1,31–1,58). Оценка разных препаратов класса статинов показала класс-эффект по развитию новых случаев СД: ОР розувастатина – 1,61 (95% ДИ – 1,30–1,98), аторвастатина – 1,49 (95% ДИ – 1,31–1,70), симвастатина – 1,38 (95% ДИ – 1,19–1,61), правастатина и флувастатина – 1,39 (95% ДИ – 1,09–1,77).
Механизмы развития СД на фоне лечения статинами
Молекулярные механизмы развития статин-индуцированного СД сложны и четко не определены; было предложено несколько патофизиологических механизмов с конечным результатом снижения секреции инсулина или чувствительности к инсулину [6].
Механизмы влияния статинов на метаболизм глюкозы могут различаться в зависимости от их фармакологических свойств. Липофильные статины (такие, как аторвастатин и симвастатин) обладают неблагоприятным плейотропным действием на метаболические процессы, что повышает риск развития СД. Они способны пассивно диффундировать через мембраны печеночных клеток, но также могут легко проникать во внепеченочные ткани и нарушать различные клеточные процессы, включая ослабление секреции инсулина в ответ на гликемию и усиление инсулинорезистентности. Кроме того, проявлением плейотропного эффекта липофильных статинов является прямое модулирующее действие на функцию адипоцитов. Гидрофильные статины (такие, как правастатин и розувастатин) в меньшей степени проникают в ткань поджелудочной железы, жировую ткань, что повышает селективность в отношении клеток печени [5].
Липофильные и гидрофильные статины по-разному влияют на чувствительность к инсулину и адипонектину. Так, в сравнительном исследовании симвастатин на фоне снижения уровня адипонектина в плазме (на 10%, р=0,012) и чувствительности к инсулину (на 6%, р=0,007) значительно повышал уровень инсулина (на 127%, р=0,014), тогда как правастатин, наоборот, значительно увеличивал уровень адипонектина в плазме (на 9%, р=0,011) и чувствительность к инсулину (на 6%, р=0,008) по сравнению с исходным уровнем, но существенно не изменял уровня инсулина [47]. Аторвастатин в течение 2 месяцев терапии дозозависимо в диапазоне 10–80 мг/сут приводил к значительному повышению уровня инсулина (на 25–45%, р=0,009), снижал чувствительность к инсулину (на 1–4%, p=0,033) и уровень адипонектина (на 3–10%, р=0,1), увеличивал уровень HbA1c (на 2—5%, р=0,008) [48]. В мета-анализе W.L. Baker et al., включившем 16 РКИ (n=1146), проведена оценка влияния нескольких статинов (правастатин, симвастатин, аторвастатин, розувастатин) на чувствительность к инсулину, которая изучалась с помощью моделей MIDMOD, глюкозотолерантного теста и расчета HOMA-IR и QUICKI, при средней длительности лечения 14 недель [49]. Результаты объединения всех исследований не показывали значительного влияния статинов на чувствительность к инсулину по сравнению с плацебо/контролем (разница – 0,084; ДИ от -0,210 до 0,042, р=0,19). Обнаружено, что правастатин значительно улучшал чувствительность к инсулину (на 0,342, р=0,03), тогда как симвастатин значительно ухудшал ее (на 0,321, р=0,03); аналогичные тенденции отмечены для аторвастатина (на 0,019, р=0,87) и розувастатина (на 0,037, р=0,69). Комбинированный анализ данных аторвастатина, розувастатина и симвастатина по сравнению с плацебо/контролем показал значительное ухудшение чувствительности к инсулину (на 0,149, р=0,03). Эти результаты согласуются с мета-анализом C.I. Coleman et al. по различию в риске развития СД на фоне применения правастатина и других статинов (аторвастатин, симвастатин, розувастатин) [15].
Симвастатин, но не правастатин дозозависимо ингибировал кальциевые каналы L-типа в β-клетках поджелудочной железы и ингибировал увеличение уровня внутриклеточного кальция и глюкоза-индуцированную передачу сигналов, что сопровождалось снижением секреции инсулина в ответ на гликемию [50].
Аторвастатин, но не правастатин способствовал нарушению и замедлению дифференцировки адипоцитов и снижал экспрессию GLUT4, что уменьшало поглощение глюкозы адипоцитами [51].
С учетом наличия взаимосвязи между интенсивностью снижения уровня ЛПНП и риском развития диабета выявляется роль ЛПНП в этом процессе. Так, на фоне применения статинов наблюдается липидснижающий эффект преимущественно на уровень ЛПНП с перераспределением холестерина из системного кровотока в ткани (печень и островки поджелудочной железы). В результате окисления ЛПНП образуются продукты перекисного окисления, проявляющие мощное провоспалительное действие на макрофаги и Т-лимфоциты, что может вызывать воспалительный каскад с нарушением секреции инсулина и в конечном итоге – повреждение структурной целостности островковых β-клеток.
Вместе с тем значение имеет не только количество частиц ЛПНП, но и их размер и плотность (модифицированные ЛПНП). Показано, что статины могут увеличивать размер частиц ЛПОНП и уменьшать размер частиц ЛПНП, способствуя повышению показателя LPIR, который и ассоциируется с развитием диабета [52]. Статины различаются по влиянию на размер частиц липопротеинов, что может определять их влияние на риск развития СД. Так, в РКИ JUPITER на фоне снижения уровней ЛПНП, ЛПОНП и триглицеридов розувастатин вызывал уменьшение размера частиц ЛПНП, увеличение размера частиц ЛПОНП и снижение показателя LPIR [53].
В другом сравнительном исследовании аторвастатин через 12 недель лечения обеспечивал увеличение размера частиц ЛПНП, тогда как правастатин, наоборот, уменьшал размер частиц ЛПНП [54].
Имеется еще одно объяснение механизма развития СД на фоне применения статинов – генетический полиморфизм HMG-редуктазы. В ряде популяционных исследований установлена ассоциация между полиморфизмом HMG-редуктазы – G-аллелем гена rs17238484 (ОР=1,02; р=0,09) и Т-аллелем гена rs12916 (ОР=1,06; р<0,00000) с риском развития диабета [30].
Заключение
Индуцированный статинами СД является широко обсуждаемым явлением и привлекает внимание из-за широкого применения этих препаратов в клинической практике. В ряде мета-анализов РКИ показан невысокий (9–12%), но статистически достоверно повышенный относительный риск развития СД на фоне длительной терапии статинами [1, 2], а в мета-анализе наблюдательных исследованиях в больших когортах пациентов риск новых случаев СД достигал 44% [46].
Применение пациентами, не достигающими целевого уровня снижения ЛПНП, более высоких дозировок статинов дополнительно на 18% повышает риск развития СД [29]. В связи с этим снижение уровня ЛПНП служит наиболее оптимальным показателем оценки риска возникновения статин-индуцированного СД во время гиполипидемической терапии статинами.
Подтверждением роли статинов в повышении риска развития СД стали результаты мета-анализа Khan S.U. et al. (33 РКИ, n=163 688) по оценке эффектов липидснижающей терапии разными классами препаратов [55]. Было установлено, что только терапия статинами ассоциируется с повышением риска СД, чего не наблюдается на фоне применения ингибиторов PCSK9. Причем более интенсивное снижение уровня ЛПНП сопровождалось дополнительным увеличением риска диабета на 10% [55]. Эти результаты показывают, что среди стратегий интенсивного снижения уровня липидов умеренный риск возникновения СД может быть существенным только при использовании статинов.
Сравнение разных препаратов статинов свидетельствует о класс-эффекте по развитию новых случаев СД.
Точный механизм развития статин-индуцированной СД остается неясным, и для объяснения этой ассоциации постулируются различные механизмы, включая нарушение метаболизма глюкозы и дисфункцию β-клеток поджелудочной железы на фоне перераспределения и накопления внутриклеточного холестерина. Не исключаются и генетические факторы в виде полиморфизма гена HMGCR, влияющего на активность статинов.
По заключению комиссии Statin Diabetes Task Force (2014) тактика применения статинов в широкой клинической практике с учетом данных об их диабетогенном действии остается прежней и обоснована высокой клинической эффективностью статинов в первичной и вторичной профилактике сердечно-сосудистых исходов и смертности (снижение риска 25–30%) [56]. При этом польза применения статинов в отношении предупреждения сердечно-сосудистых исходов и смертности существенно превосходит риск развития диабета (NNT 39–77, NNH 125–250). Дополнительными рекомендациями являются измерения уровня HbA1c или глюкозы натощак до начала терапии статинами и в период лечения пациентов с повышенным риском СД (с факторами риска и предиабетом), а также выполнение рекомендаций по скринингу, диагностике и профилактике развития СД у этих больных.



