Введение
Течение инсульта нередко осложняется поведенческими и эмоциональными нарушениями, которые недостаточно диагностируются, влияют на качество жизни пациента и его родственников, негативно сказываются на включенность пациентов в реабилитационные мероприятия, сокращают социальную активность [1] и ухудшают бытовую адаптацию пациента [2–5]. Постинсультная апатия (ПА) – одно из таковых осложнений.
Роберт Марин, чьи работы послужили стимулом для исследовательского интереса в этой области, обнаружил, что апатия имеет ряд психологических особенностей. Он определил апатию как нейропсихиатрический синдром, характеризующийся недостаточностью целенаправленного поведения [6]. При этом, согласно его работам, основным симптомом апатии является потеря мотивации. Мотивацию он определяет как «направление, интенсивность и настойчивость целенаправленного поведения» [6, 7]. В нейропсихиатрической литературе рассматриваются и другие определения апатии. Рядом авторов предполагается, что ключевым при этом состоянии является не снижение мотивации, а недостаток инициативы (аспонтанность) [8]. Однако в целом определение апатии как снижение мотивации превалирует в современной литературе [9–11].
Апатия является довольно распространенным осложнением многих заболеваний [12]. Так, она выявляется у 49% пациентов с болезнью Альцгеймера, у 34% больных сосудистой деменцией, у 40% пациентов с болезнью Паркинсона, у 61% больных, перенесших черепно-мозговую травму, у 20–50% больных, перенесших острое нарушение мозгового кровообращения [12–17].
Проводятся исследования, посвященные изучению взаимосвязи ПА с возрастно-половыми и клиническими характеристиками инсульта. Согласно некоторым работам, ПА чаще возникает у пациентов старшего возраста [18–20], в ряде других исследований не выявлено ассоциации апатии с возрастом [21–23]. Также не выявлено взаимосвязи ПА с полом [21–23].
Изучается взаимосвязь наличия ПА с характеристиками инсульта. В ряде исследований не выявлено связи апатии с тяжестью инсульта и объемом поражения при нейровизуализации [18, 20, 24, 25]. В большинстве исследований сообщалось о связи между ПА и худшим функциональным восстановлением после нарушения мозгового кровообращения [25–27].
При исследовании ассоциации ПА с типом инсульта получены неоднозначные результаты, в некоторых работах отмечено преобладание апатии у пациентов с ишемическим инсультом, в других – с геморрагическим [25, 27].
Не обнаружено четкой связи между ПА и локализацией или стороной поражения. Наиболее часто сообщается о связи развития апатии с подкорковыми поражениями, в основном в области базальных ганглиев, передней части поясной извилины [11, 25, 28–30]. Эти данные согласуются с представлением о том, что передняя поясная извилина связана с мотивацией.
Цель настоящего исследования состояла в выявлении клинических особенностей и факторов риска развития ПА.
Методы
Исследование проводилось на кафедре фундаментальной и клинической неврологии и нейрохирургии ГБОУ ВПО РНИМУ им. Н.И. Пирогова на базе нейрореанимационного и неврологического отделений ГКБ № 31.
Работа проведена как проспективное наблюдение за когортой больных в течение 12 месяцев.
В исследование были включены 206 пациентов с впервые возникшим нарушением мозгового кровообращения, включение проводилось в первые сутки от развития заболевания. Среди наблюдавшихся были 115 (56%) мужчин и 91 (44 %) женщина в возрасте от 36 до 90 лет. Средний возраст больных составил 66±12 лет.
Критерии исключения: летальный исход в остром периоде инсульта, угрожающая жизни соматическая патология, невозможность связаться с родственниками больных с тяжелыми речевыми нарушениями. Установление диагноза инсульта и его патогенетического варианта проводилось по данным неврологического осмотра, нейровизуализации, дуплексного сканирования МАГ, электро- и эхокардиографии, лабораторных показателей.
У 195 (95%) пациентов инсульт был ишемическим, у 11 (5%) – геморрагическим. Типы ишемического инсульта оценивались по критериям TOAST. При оценке локализации инсульта: поражение правого полушария встречалось у 86 (42%) больных, левого полушария – у 78 (38%), инсульты в области ствола и мозжечка имели место у 40 (20%) пациентов.
Для оценки тяжести состояния пациента, выраженности очагового неврологического дефицита, динамики клинических показателей использовали шкалу NIHSS (Шкала тяжести инсульта Национальных институтов здоровья CША). Оценка проводилась на 1-е, 7-е, 14-е сутки, 1-й, 3-й, 6-й и 12-й месяцы после инсульта. Уровень самообслуживания оценивался по шкале Рэнкина на 1-е, 7-е, 14-е сутки, 1-й, 3-й, 6-й и 12-й месяцы после инсульта. Диагностика апатии производилась в соответствии с критериями Starkstein; оценка проводилась на 1-е, 7-е, 14-е сутки, 1-й, 3-й, 6-й и 12-й месяцы после инсульта (20).
Статистический анализ. Обработка полученных данных проводилась при помощи методов математической статистики, был использован метод описательной статистики и метод анализа достоверности различий. Использовался следующий программный инструментарий: STATISTICA 10.0, Microsoft Excel 2010. Обработка полученного материала состояла из следующих этапов: производился подсчет параметров распределения в каждой группе (среднее значение, стандартное отклонение) по всем показателям; проводился анализ достоверности различий между группами по непараметрическому критерию Краскела–Уоллиса, непараметрическому критерию U-Манна–Уитни, анализ достоверности различий между группами по качественному признаку с помощью непараметрического критерия хи-квадрат, углового преобразования Фишера.
Результаты исследования
В нашем исследовании частота субъективно или объективно отмечаемой ПА составила 24% (50 человек), что соответствует литературным данным. В исследовании S.E. Starkstein еt al. (2008) апатия отмечена в 22,5% [20], в исследовании Н. Brodaty (2005) частота ПА составила 26,7% [18], в работе J.M. Kennedy (2015) – 28% [22].
В целом, согласно анализу ранее проведенных исследований, апатия встречается среди 20–40% больных, перенесших церебральный инсульт [15], в обзоре J.W. Dalen после мета-анализа 49 исследований указывается средняя частота – 35% [25].
При анализе психопатологической структуры ПА выявлено, что она представляла собой два клинических варианта:
1) Типичная апатия (n=15) соответствовала критериям S.E. Starkstein и включала поведенческий (полное сокращение активности), когнитивный (понижение интереса к собственному положению и новизне) и эмоциональный (сглаживание аффекта и значительное снижение реакции на эмоциональные стимулы) компоненты.
2) Депрессивная апатия (n=33) отличалась сокращением сложных видов активности, редко – повседневной деятельности. При побуждении к активизации пациенты проявляли избегающее поведение, негативизм. Когнитивный компонент проявлял себя в виде выраженной концентрации внимания пациентов на болезни. Эмоциональная сфера отличалась снижением настроения, ощущением безнадежности.
У двоих пациентов имело место сочетание обоих видов апатии.
В исследовании была проведена оценка взаимосвязи ряда факторов риска (возраст, пол, локализация очага, тяжесть неврологического дефицита, уровень зависимости от посторонней помощи) с развитием апатии, а также их взаимосвязь с типами ПА. При разделении апатии на подгруппы пациенты с двумя видами апатии не учитывались.
При оценке взаимосвязи ПА с демографическими параметрами получены следующие данные: у пациентов с апатией средний возраст (67,2±15,3 года) был достоверно выше, чем у пациентов без апатии (64,5±11,6 года; р=0,03). При анализе среднего возраста с учетом разделения апатии на подгруппы также были получены статистически значимые различия. Показано, что пациенты с депрессивной формой апатии более пожилые (р=0,02; см. таблицу)
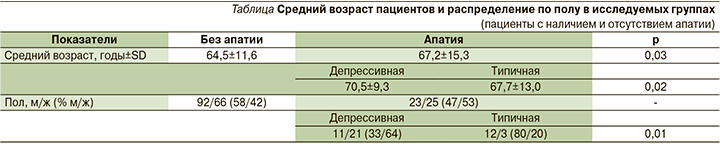
В результате сравнительного анализа по полу групп с/без апатии достоверных различий обнаружено не было. При оценке гендерной принадлежности выявлены следующие результаты: среди мужчин отмечен самый высокий процент встречаемости типичной формы апатии (80%). Среди женщин самый высокий процент встречаемости – депрессивная форма апатии (64%; см. таблицу).
Анализируя результаты предыдущих исследований в части ассоциации апатии с демографическими данными, мы обнаружили, что в ряде литературных источников ПА также ассоциирована с более старшим возрастом [18, 20], в других взаимосвязи не выявлено [22, 31]. Более частое развитие ПА у пациентов старшего возраста может быть связано с наличием коморбидной патологии, худшим функциональным восстановлением, одиночеством, наличием сопутствующей старческой астении. Отсутствие взаимосвязи ПА с гендерной принадлежностью также согласуется с результатами проведенных исследований [10, 22, 31]. Превалирование женщин над мужчинами в группе «депрессивная апатия», вероятно, связано с большей склонностью женщин к развитию депрессии [33].
При оценке взаимосвязи апатии с типом инсульта получены следующие результаты: среди пациентов с ишемическим инсультом чаще встречалась депрессивная форма ПА (р<0,05), тогда как среди больных геморрагическим инсультом – типичная форма апатии (р<0,05). Разница статистически значима. Кроме того, ПА статистически значимо чаще выявлялась при кардиоэмболическом варианте ишемического инсульта (р=0.05), при этом большинство случаев составляла группа с депрессивной апатией (р<0,05). По данным литературы, получены неоднозначные результаты о взаимосвязи наличия апатии с типом инсульта.

Большое внимание исследователями апатии, в т.ч. возникающей после инсульта, уделяется изучению ее взаимосвязи с локализацией очага поражения головного мозга [11, 25]. В нашем исследовании при анализе зависимости развития апатии от локализации очага поражения выявлено, что ПА чаще встречается при поражениях левого полушария (р=0,05; рис. 1). При рассмотрении конкретных зон поражения у больных с наличием и отсутствием апатии достоверных различий обнаружено не было, за исключением того, что ПА реже встречалась при поражении в области ствола головного мозга и достоверно чаще сочеталась с лейкоареозом (р<0,05). Согласно литературным данным, лейкоареоз коррелирует с более тяжелой инвалидизацией, плохим функциональным восстановлением и более тяжелыми когнитивными нарушениями [32]. Полученные в нашем исследовании результаты согласуются с этими представлениями.
При оценке взаимосвязи апатии с тяжестью инсульта неврологический дефицит был сильнее выражен у пациентов с ПА, различия статистически значимы во всех точках, кроме 7-х и 28-х суток (рис. 2). При анализе среднего балла по шкале тяжести инсульта у пациентов c учетом разделения на подгруппы выявлена статистически значимая разница на сроках 6 и 12 месяцев (р<0,05). Наибольший неврологический дефицит отмечен у пациентов с типичной формой апатии (р<0,05).
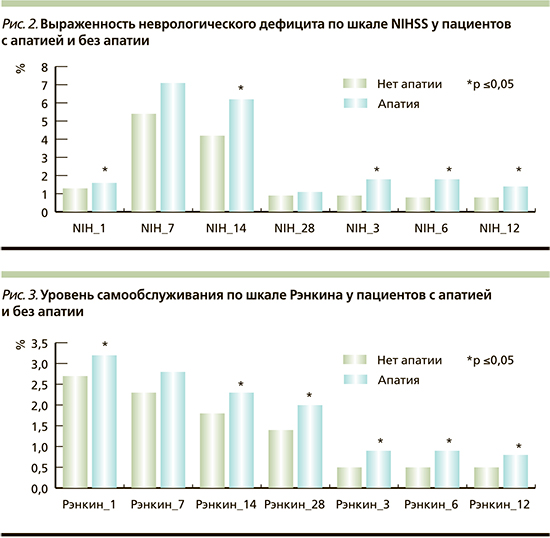
При изучении взаимосвязи апатии со степенью инвалидизации показано, что пациенты с наличием апатии имеют больший балл по шкале Рэнкина, чем пациенты без апатии, т.е. более зависимы от посторонней помощи. Статистически значимые различия получены во всех точках, кроме 7-х суток (р<0,05; рис. 3). При анализе с учетом разделения на подгруппы выявлено, что наибольший балл имели пациенты с типичной апатией, разница статистически значима через 6 и 12 месяцев (р<0,05)
Почти во всех ранее проведенных исследованиях получены данные о связи апатии после инсульта с инвалидностью и худшим исходом реабилитации [12, 25]. Это говорит о том, что к наличию апатии должно быть обращено серьезное внимание при постановке реабилитационного диагноза, планировании реабилитационных мероприятий с привлечением психиатра в состав мультидисциплинарной бригады.
Обсуждение
Таким образом, в нашем исследовании было установлено, что ПА является гетерогенным расстройством и представлена двумя клиническими типами: типичной и депрессивной апатией. ПА была ассоциирована с более старшим возрастом, левосторонней локализацией очага, более тяжелым неврологическим дефицитом и лейкоареозом. Кроме того, пациенты с ПА хуже адаптированы в быту, сильнее зависимы от посторонней помощи. При этом выявлено, что разные типы ПА по-разному связаны с рядом факторов риска: депрессивная апатия чаще встречается у более пожилых пациентов и у женщин, в то время как типичная – чаще у мужчин. Кроме того, среди пациентов с ишемическим инсультом чаще встречалась депрессивная форма апатии, среди пациентов с геморрагическим инсультом – типичная форма. Неоднородность апатии описывалась ранее в ряде публикаций [2, 19, 33, 34].
Заключение
Полученные данные говорят о целесообразности дальнейшего изучения психических расстройств у больных инсультом, в т.ч. ПА. Это поможет открыть новые возможности более дифференцированной терапии постинсультных аффективных расстройств, что позволит значительно улучшить качество жизни больных, перенесших инсульт.



