Многоплодие в настоящее время остается важнейшей проблемой акушерства из-за развития многочисленных сопутствующих осложнений, в первую очередь невынашивания беременности и преждевременных родов, во многом определяющих исходы многоплодных беременностей [1–5].
Частота самопроизвольного наступления многоплодной беременности составляет 2,5–3% [6–8]. В результате применения вспомогательных репродуктивных технологий (ВРТ) многоплодие возникает в 4–16 раз чаще, чем при естественном оплодотворении [3, 8, 9], что обусловлено поздним репродуктивным возрастом матери, применением стимуляции овуляции и проведением экстракорпорального оплодотворения (ЭКО) с переносом более одного эмбриона [10]. Все вышесказанное подтверждает целесообразность изучения особенностей течения и исходов многоплодной беременности, наступившей в программах ЭКО, что и определило цель данной работы.
Материалы и методы
В соответствии с вышеуказанной целью нами обследовано 669 беременных с дихориальной диамниотической (ДХДА) двойней. Оценены течение и исходы беременности у пациенток двух групп: в I группу вошли 266 (39,8%) наблюдаемых, беременность у которых наступила в результате применения ВРТ; во II группу включены 403 (60,2%) пациентки, у которых беременность двойней наступила спонтанно. Критерием исключения из исследования явился монохориальный тип плацентации.
Диагноз ДХ двойни у всех 669 пациенток был установлен в I триместре беременности на основании визуализации при УЗИ двух плодных яиц и двух хорионов, при наличии слившихся хорионов– по «лямбда» признаку у основания межплодовой перегородки.
У 53 из 266 (19,9%) пациенток I группы (ВРТ), которым в программе ЭКО перенесены 3 или 4 эмбриона, в I триместре произведена редукция 1–2 эмбрионов до двойни.
В дальнейшем на протяжении беременности наблюдаемым обеих групп проводилось УЗИ: с 16 по 34 недели – 1 раз в 4 недели, далее – 1 раз в 2 недели. Дискордантность по предполагаемой массе плодов (ПМП) определяли по формуле:
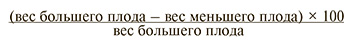
Диагноз задержки роста (ЗР) плода/плодов ставили на основании УЗИ, при котором диагностировали снижение ПМП одного или обоих плодов менее 10-го перцентиля. Фетометрию и УЗ-допплерографию кровотока при ЗР плода/плодов повторяли в зависимости от степени изменения кровотока в артерии пуповины (АП): при положительном диастолическом компоненте кривой спектра кровотока в АП – с периодичностью 2 раза в 1–2 недели, при «нулевом» или реверсном диастолическом компоненте с обязательной оценкой пульсационного индекса (ПИ) в венозном протоке и средней мозговой артерии (СМА) до 26 недель – еженедельно, далее – 2 раза в неделю.
Ухудшение состояния плодов оценивали на основании выявленных изменений кровотока в АП, венозном протоке, централизации кровотока плода, маловодия. Всем пациенткам в 18–20 недель проводилась трансвагинальная эхография (ТВЭ) с измерением длины шейки матки (ШМ). Уменьшение длины ШМ менее 25 мм расценивали как фактор риска преждевременных родов. Физическое развитие детей при рождении оценивали по специальным нормативам развития плодов и новорожденных для многоплодной беременности [11].
Статистический анализ
Для статистической обработки данных применяли пакет программ IBM SPSS Statistics 23. Для определения нормальности распределения использовали обобщенный тест Д'Агостино–Пирсона. Данные с нормальным распределением представляли как среднее значение (стандартное отклонение), для их сравнения использовали t-test. Данные с распределением, отличным от нормального, представляли как медиану (интерквартильный размах), для их сравнения использовали критерий Манна–Уитни. Качественные данные представляли как абсолютное значение (n) и %, для их сравнения использовали точный тест Фишера. Для оценки связи между частотой развития гестационных осложнений и возрастом пациенток было рассчитано отношение шансов (odds ratio, OR) с доверительным интервалом (ДИ) в 95%. Результаты считали статистически значимыми при p<0,05.
Результаты
Полученные нами данные показали, что пациентки I группы были статистически значимо старше (32,43 [4,82] года), чем беременные II группы (28,74 [4,88] года; p=0,02). В I триместре у беременных I группы (ВРТ) по сравнению с наблюдаемыми II группы (спонтанные двойни) чаще развивались такие осложнения, как анемия (29,3% и 19,1%; р<0,001), угроза прерывания беременности (59,8% и 35,9%; р<0,001), начавшийся выкидыш (39,8% и 24,6%; р=0,02).
Во II триместре у пациенток I группы, беременность которых наступила в результате ВРТ, сохранялся высокий риск невынашивания по сравнению с беременными после естественного зачатия. В сроки 14–22 недели гестации выкидыш произошел у 11 из 669 (1,6%) обследованных, статистически значимо чаще у пациенток I группы (у 9 из 266 [3,4%]), чем II (у 2 из 403 [0,5%]; р<0,001). Причиной позднего выкидыша были: редукция плода/плодов (у 6 наблюдаемых из I группы), истмико-цервикальная недостаточность (у 3 – из I группы, у 2 – из II). Частота позднего выкидыша в I группе после редукции плода/плодов составила 11,3% (6 из 53), а длительность беременности – 32,7 (6,7) недели, что было меньше (р=0,03), чем у беременных I группы без редукции – 34,9 (3,8) недели. Это позволи ло нам расценивать редукцию плода/плодов как дополнительный фактор риска невынашивания и преждевременных родов при многоплодии.
Истмико-цервикальная недостаточность (ИЦН) в сроки от 15 до 28 недель гестации диагностирована у 65 из 658 (9,9%) беременных с двойней. ИЦН в 3,3 раза чаще отмечена при индуцированном многоплодии (у 44 из 257 [17,1%]; р<0,001), чем при спонтанных двойнях (у 21 из 401 [5,2%]). Стоит отметить, что развитию ИЦН в I группе способствовал поздний репродуктивный возраст пациенток [37 и более лет] (OR 2,86; 95% ДИ 1,37–6,02; p=0,005); во II группе беременных влияние возраста на развитие ИЦН было статистически незначимо (OR 1,33; 95% ДИ 0,29–6,00; p=0,12).
У 48 из 65 (73,8%) пациенток проведена коррекция ИЦН (32 – из I группы, 16 – из II). У 25 из 48 (52,1%) беременных с выраженным укорочением шейки матки (длина ШМ менее 15 мм), в том числе у 5 – с пролабированием плодного пузыря, в сроки 15–22 недель (18,3 [3,4] недели) были наложены швы на шейку матки. У 23 из 48 (47,9%) пациенток при укорочении ШМ менее 25 мм в более поздние сроки (22–28 недель, 25,4 [4,6] недели) вводился акушерский пессарий. У 40 (из 48) пациенток с укорочением ШМ, наряду с серкляжем и введением акушерского пессария, назначался микронизированный вагинальный прогестерон. У 17 из 65 (26,2%) беременных с пролабированием плодного пузыря после 28-й недели гестации коррекция ИЦН не выполнялась. Благодаря проведенному лечению (серкляж, акушерский пессарий, вагинальный прогестерон) у 48 пациенток удалось пролонгировать беременность на 14,3 (3,4) недели, что было больше (р=0,02), чем у 17 нелеченых пациенток – 5,5 (1,4) недели. Полученные результаты позволили сделать вывод об эффективности коррекции ИЦН посредством серкляжа при выраженном укорочении ШМ в сроки до 22 недель, в том числе при пролабировании плодного пузыря, и акушерского пессария – в более поздние сроки (после 22 недель), что согласуется с мнением современных авторов о необходимости коррекции ИЦН при многоплодии [7, 12]. Клинически значимый дискордантный рост плодов (разница в ПМП 20% и более), по данным фетометрии, после 31 недели беременности выявлен у 79 из 603 (13,1%) наблюдаемых обеих групп; из них у 23 – диагностирована ЗР плода/плодов (ПМП<10го перцентиля). В то же время селективная задержка роста плода (разница в ПМП более 25% при ЗР одного плода менее 10-го перцентиля) в 31–39 недель выявлена у 47,8% (11 из 23); различия между группами статистически незначимы (р=0,37).
Частота ЗР плода/плодов к концу II триместра по данным фетометрии составляла 28,3% (186 из 658) и статистически значимо не различалась между группами (р=0,23). По мере прогрессирования беременности число пациенток с внутриутробной задержкой роста плода/плодов увеличивалось с 28,3% до 41,3% (249 из 603) в 31–39 недель, что, по-видимому, обусловлено конкурентным сосуществованием двух плодов. При этом ЗР одного плода имела место у 185 из 249 (74,3%) пациенток обеих групп (ПМП<5-го перцентиля – у 12), ЗР обоих плодов – у 64 (25,7%) (ПМП <5-го перцентиля – у 8). В отличие от первой половины беременности, в течение которой частота ЗРП не различалась между группами, в сроки 31–39 недель гестации ЗРП чаще (р=0,04) отмечалась в I группе (46,2%), чем во II (38,4%).
Маловодие статистически значимо чаще (р<0,001) выявлялось у беременных с индуцированным многоплодием (6,6%) по сравнению с группой пациенток со спонтанным многоплодием (2,7%), что объясняется большей частотой ЗРП в I группе. Как правило, маловодие отмечалось при выраженной ЗРП (ПМП <5-го перцентиля).
При УЗ-допплерографии во II и III триместрах у беременных с индуцированным многоплодием и спонтанными двойнями различия в значениях ПИ в маточных артериях (МА) оказались статистически незначимы (p=0,23–0,67). Также не выявлено различий в значениях ПИ в левой и правой МА (p=0,12–0,45). Дикротическая выемка в одной или обеих МА в середине беременности отмечена у 198 беременных, из них у 153 (77,3%) пациенток в дальнейшем развилась преэклампсия.
Средние значения ПИ в АП были выше при индуцированных двойнях (I группа), чем при спонтанных (II группа), в сроки: 20–21 неделя (1,32 [0,17] и 1,08 [0,10], соответственно; р=0,01), 24–25 недель (1,18 [0,23] и 1,03 [0,12]; р=0,03), 35–36 недель (0,97 [0,29] и 0,83 [0,15]; р=0,02), 37–38 недель (0,95 [0,25] и 0,82 [0,16]; р=0,03). Однако следует подчеркнуть, что у 127 из 257 (49,4%) пациенток I группы значения ПИ в МА и АП не выходили за пределы 5-го и 95-го перцентилей разработанных нами нормативных показателей [13]. У 98 (38,1%) беременных имели место изолированные нарушения кровотока в системе мать–плацента–плод (МПП), у 32 (12,5%) – сочетанные нарушения в нескольких звеньях системы МПП. Обращает внимание, что во II группе беременных показатели кровотока в системе МПП были лучше: у 14% отмечались изолированные нарушения, а сочетанные только у 5,2% (против 12,5% – в I группе; р<0,001). Следует отметить, что сочетанные нарушения системы МПП были выявлены у 17 из 20 (85%) беременных I и II групп с выраженной ЗР плода/плодов (ПМП <5-го перцентиля).
Преэклампсия (ПЭ) развилась у 253 из 658 (38,4%) пациенток с двойней. И хотя статистически значимых различий по частоте возникновения ПЭ между группами беременных не выявлено (p=0,32), однако отмечено более раннее (р=0,02) начало ПЭ и бóльшая частота тяжелых форм (р=0,03) в I группе (23,4 [5,6] недели; 22,8%), чем во II (26,3 [6,5] недели; 14,3%). У 6 пациенток тяжесть ПЭ явилась показанием к досрочному родоразрешению в 22–31 неделю. Поздний репродуктивный возраст (37 и более лет) способствовал развитию тяжелых форм ПЭ как в I группе пациенток (OR 2,15; 95% ДИ 1,04–4,45; p=0,005), так и во II (OR 3,37; 95% ДИ 1,33–8,54; p=0,001).
Частота анемии у беременных с двойней возрастала на протяжении беременности с 23,2% (в I триместре) до 42,4% (в III триместре), однако статистически значимых различий в частоте данного осложнения в III триместре между I и II группами не обнаружено (р=0,12).
У беременных I группы чаще, чем у пациенток II группы, выявлен гестационный сахарный диабет (ГСД): 13,6% против 8,5% (р=0,01).
Преждевременная отслойка нормально расположенной плаценты (ПОНРП) или предлежащей плаценты, сопровождающаяся кровотечением различной степени выраженности, в сроки 24–37 недель гестации отмечена у 27 из 658 (4,1%) пациенток с двойней. И хотя различия между группами статистически незначимы (р=0,42), в I группе кровотечение, обусловленное ПОНРП или предлежащей плаценты, возникало в более ранние (р=0,02) сроки беременности (32,5 [1,9] недели), чем во II группе (34,6 [1,5] недели).
Одной из основных проблем многоплодной беременности, во многом определяющей перинатальные исходы, являются преждевременные роды (ПР). В нашем исследовании ПР в сроки от 22 до 37 недель гестации произошли у 317 из 658 (48,2%) наблюдаемых. Таким образом, ПР произошли почти у половины беременных с двойней, что согласуется с данными мировой литературы – 50–60% [3, 4, 14, 15].
При этом следует отметить, что очень ранние и ранние ПР (в 22–31 недель) произошли у 8,4% беременных двойнями; ПР, включая поздние ПР (в 31–37 недель) – у 39,8%. Последнее можно объяснить высокой частотой индуцированных родов, связанных с различными осложнениями многоплодной беременности.
Обращает внимание, что частота наступления очень ранних и ранних ПР на 22–31-й неделе чаще наблюдалась в I группе беременных (ВРТ): 13,2% против 5,2% – у беременных II группы со спонтанными двойнями (р=0,01). Разница между группами беременных в частоте ПР в сроки 31–37 недель была менее выраженной (46,3% и 35,7%), хотя и статистически значимая (р=0,04). Роды в срок произошли у половины беременных двойнями (341 из 658; 51,8%); при этом своевременно реже рожали пациентки, у которых применялись ВРТ (40,5%), чем беременные со спонтанными двойнями (59,1%) [р=0,03].
Антенатальные потери у беременных с двойнями составили 1,3% (17 из 1316 плодов). В сроки 22–31 недели погибли 9 плодов, в сроки 32–38 недель – 17. У 6 беременных с двойней антенатально погибли оба ребенка, у 5 – один из двойни. ЗР менее 5-го перцентиля и асфиксия выявлены у 12 из 17 (70,6%) погибших плодов, диссоциация в ПМП со вторым плодом более 25% (селективная задержка плода) – у 5 (29,4%). При использовании ВРТ антенатальные потери были в 2,1 раза выше, чем при спонтанных двойнях: 1,9% (10 из 514) и 0,9% (7 из 802) соответственно (р<0,001).
Через естественные родовые пути родили 262 из 658 (39,8%) пациенток. Следует отметить, что рожали самостоятельно реже беременные I группы: 19,1% против 53,1% – из II группы (р<0,001). При родоразрешении через естественные родовые пути возникали такие осложнения, как слабость родовой деятельности – у 50 из 262 (19,1%), дискоординация родовой деятельности – у 24 (9,2%), отслойка плаценты – у 8 (3,1%); различия между группами статистически незначимы (р=0,12, р=0,09, р=0,36, соответственно).
Оперативно абдоминальным путем в сроки 22–39 недель родоразрешены 387 из 658 (58,8%) пациенток обеих групп. При этом чаще (р=0,04) беременные родоразрешались оперативно в сроки 31–36 недель (64,9%), чем в сроки 37–39 недель (56,6%). У беременных с индуцированным многоплодием КС выполнялось чаще (80,2%), чем у пациенток со спонтанными двойнями (45,1%) (р<0,001). Частота выполнения КС в экстренном порядке статистически значимо не различалась между I и II группами: 62,1% и 70,7% соответственно (р=0,07). В то же время частота планового КС у беременных I группы составляла 37,9% против 29,3% – во II группе наблюдений (р=0,02).
Показаниями к плановому КС у пациенток с двойнями явились: неголовное предлежание первого или обоих плодов, ЗР плода/плодов, ПР, тяжесть ПЭ и отсутствие эффекта от проводимой терапии, первичная слабость родовой деятельности, рубец на матке после операции КС. У беременных I группы (ВРТ) дополнительными показаниями к КС были: поздний репродуктивный возраст пациентки (старше 37 лет), длительный анамнез бесплодия, неэффективность предыдущих ЭКО.
КС на втором плоде произведено у 9 из 658 (1,4%) наблюдаемых (2 – из I группы, 7 – из II) в связи с коллизией плодов (1), выпадением пуповины (2), запущенным поперечным положением второго плода (6).
Гипотоническое кровотечение в послеродовом периоде возникло у 45 из 658 (6,8%) рожениц. Следует указать, что кровотечение отмечалось в 3,5 раза реже (р<0,001) в I группе (у 2,7%), чем во II (у 9,4%), что, по-видимому, можно связать с большей частотой родов через естественные родовые пути у пациенток со спонтанным многоплодием, а также более высокой частотой планового КС в I группе. Кровотечение возникало в 2,4 раза чаще (р=0,01) при самостоятельных родах (10,7%), чем при операции КС (4,5%).
Всего у 658 пациенток родились живыми 1285 из 1316 (97,6%) детей: 95,5% – в I группе (ВРТ), 99% – во II (спонтанные двойни). Интранатально погибли 14 (1,1%) плодов. Практически все погибшие в родах плоды были из I группы – 13 (2,5%) против 1 (0,1%) – из II группы (р<0,001). У 5 пациенток в родах погибли оба плода, у 4 – один плод. У 11 погибших интранатально плодов была выраженная задержка роста (ПМП <5-го перцентиля), у 3 – асфиксия при тазовом предлежании плода.
Практически половина детей (604 из 1285) родились преждевременно: в сроки 22–31 недель – 89 (52 – из I группы, 37 – из II), в сроки 31–37 недель – 515 (232 – из I, 283 – из II). Своевременно родился 681 (53%) ребенок: 207 (40,3%) – из I группы, 474 (59,1%) – из II (р=0,02).
Анализ параметров физического развития 1285 новорожденных показал, что у недоношенных детей (604) эти показатели в наблюдаемых группах статистически значимо не различались (р=0,18–0,45). У доношенных детей I группы (207) по сравнению с доношенными детьми II группы (474) были меньше масса тела (2691,6 [318,4] и 2747,5 [342,3] г соответственно; р=0,02), массо-ростовой показатель (55,9 [5,1] и 56,6 [5,4]; р=0,03) и окружность груди (31,2 [1,7] и 31,6 [1,7] см; р=0,03). В то же время рост и окружность головы у доношенных новорожденных статистически значимо не различались между группами наблюдения (р=0,12 и р=0,32 соответственно). Суммарная масса детей 6000 г и более в 2,6 раза реже выявлялась в I группе: 2,7% против 7,1% – во II группе (р<0,001), с чем, по-видимому, также связана меньшая частота гипотонических кровотечений в I группе наблюдений. Важно подчеркнуть, что у трети пациенток (15 из 45) с гипотоническим кровотечением суммарная масса детей превышала 6000 г.
Оценка по шкале Апгар у 604 недоношенных детей I и II групп на 1-й минуте составила 7,66 (1; 8) балла, на 5-й минуте – 8,55 (4;10) балла; у 681 доношенного – 7,90 (5;9) и 8,85 (6;10) балла соответственно; различия между группами были статистически незначимы (р=0,25). Асфиксия чаще (р<0,001) диагностирована у детей, рожденных в сроки 22–31 недель (у 38 из 66; 57,6%) и 31–36 недель (у 20; 30,3%), чем у доношенных (у 8; 12,1%).
Дыхательные расстройства различной степени выраженности при рождении были выявлены у 492 из 1285 (38,3%) детей. В связи с дыхательной недостаточностью в искусственной вентиляции легких (ИВЛ) нуждались 142 из 492 (28,9%) новорожденных, во вспомогательной вентиляции с постоянным положительным давлением (CPAP) – 156 (31,7%). Различия между группами статистически незначимы (р=0,46).
У 202 из 1285 (15,7%) детей диагностированы отечный синдром, внутрижелудочковые кровоизлияния (ВЖК) 2–4 степени, вегето-висцеральная дисфункция и другие патологии; различия между группами были статистически незначимы (p=0,12). У 43(3,3%) детей выявлены врожденные пороки развития (дефект межжелудочковой перегородки, водянка яичек, полидактилия и пр.); различия между I и II группами также статистически незначимы(р=0,32): у 18 из 491 (3,7%) и 25 из 794 (3,1%).
В постнатальном периоде умерли 22 из 604 (3,6%) недоношенных детей (преимущественно в сроки 24–29 недель): 3,9% – из I группы; 3,4% – из II группы (p=0,24). Причиной смерти явились недоношенность, дыхательная недостаточность, ВЖК 4 степени и внутриутробная инфекция.
Таким образом, общие перинатальные потери у беременных с двойнями составили 4% (53 из 1316) в обеих группах. При практически одинаковых показателях постнатальной гибели детей общие потери статистически значимо различались между группами наблюдений за счет антеи интранатальных потерь и были в 2,8 раза выше в группе индуцированного многоплодия: 6,6% против 2,4% – в группе спонтанных двоен (р=0,01).
Обсуждение
Как показали наши исследования, при беременности двойней, наступившей в результате использования ВРТ, по сравнению со спонтанными двойнями, наблюдалась статистически значимо бóльшая частота гестационных осложнений: анемии в I триместре, позднего выкидыша, ИЦН, ПР, ЗР плода/ плодов в сроки 31–39 недель, маловодия, ГСД, что согласуется с данными литературы [5, 7, 9, 12, 16]. Также установлено, что поздний репродуктивный возраст пациенток (37 и более лет)в обеих группах оказывал статистически значимое влияние на возникновение тяжелых форм ПЭ, в группе ВРТ поздний репродуктивный возраст был дополнительным фактором риска развития ИЦН. Именно с более высокой частотой многочисленных гестационных осложнений можно связать тот факт, что показатели физического развития доношенных детей в I группе (ВРТ) были меньше, чем у новорожденных из спонтанных двоен.
Особое внимание среди акушеров и неонатологов уделяется состоянию детей, родившихся от матерей после применения ВРТ [13, 17–19]. Ряд авторов [18, 20] отмечают, что состояние новорожденных при многоплодной беременности после ЭКО по шкале Апгар оценивалось как удовлетворительное в 1,6–2 раза реже, чем при спонтанном многоплодии. В нашем исследовании число детей, родившихся в состоянии асфиксии, не различалось между группами. Это подтверждает нашу точку зрения, что на состояние детей в большей степени влияет не способ наступления беременности, а преимущественно гестационный возраст при рождении.
В некоторых работах выявлена взаимосвязь проведения ВРТ с последующим формированием пороков развития у детей [21, 22]. A. Pinborg et al. [23] в результате длительных наблюдений показали, что в последние годы прослеживается тенденция к снижению частоты пороков развития у детей, рожденных в результате применения ВРТ, что связано, по мнению авторов, как с совершенствованием репродуктивных технологий, так и с сокращением длительности бесплодия и более молодым возрастом родителей. Мы согласны с мнением A. Pinborg et al. [23], учитывая, что в нашем исследовании различия по частоте пороков развития у детей между группами наблюдения оказались статистически незначимы.
В исследовании R. Klemetti et al. [24] было показано, что перинатальная смертность была выше при индуцированном, чем при спонтанном многоплодии. В то же время S.R. Murray et al. [25] указали, что непосредственно ВРТ не влияют на этот показатель, подчеркивая связь перинатальной смертности при многоплодии, в первую очередь, с недоношенностью. Мы склонны согласиться с обоими авторами. Действительно, в нашем исследовании перинатальные потери были в 2,8 раза больше при беременности, наступившей в результате использования ВРТ, чем при спонтанном многоплодии (6,6% и 2,4% соответственно), что, вероятно, объясняется более высокой частотой гестационных осложнений у пациенток с индуцированным многоплодием; и, по нашим данным, именно недоношенность во многом определяет неблагоприятные перинатальные исходы у беременных в группе ВРТ.
Заключение
Многоплодная беременность, наступившая в результате применения ВРТ, по сравнению со спонтанным многоплодием, входит в группу высочайшего риска по частоте возникновения многочисленных гестационных осложнений.
Использование ВРТ не влияет на состояние здоровья новорожденных из двойни, частоту развития у них различных заболеваний и пороков развития. Тем не менее общие перинатальные потери у пациенток с индуцированным многоплодием в 2,8 раза больше, чем при спонтанных двойнях, в основном за счет антеи интранатальных потерь.
Выявленная нами бóльшая частота неблагоприятных перинатальных исходов при индуцированной многоплодной беременности по сравнению со спонтанными двойнями еще раз подчеркивает необходимость ограничения числа переносимых эмбрионов до одного.



