ЭПИДЕМИОЛОГИЯ
Многочисленные когортные исследования в разных странах демонстрировали неоднозначную заболеваемость ТИА, которая варьировалась от 0,37 до 1,1 на 1000 человек в год. Подобно инсультам, риск ТИА значительно увеличивается с возрастом. В одном из британских исследований заболеваемость ТИА среди лиц старше 85 лет достигла 6,41 на 1000. По данным Cardiovascular Health Study (1993), распространенность ТИА составляла 2,7% среди мужчин 65–69 лет и 1,6% среди женщин того же возраста, а у лиц 75–79 лет она увеличивалась до 3,6% и 4,1% у мужчин и женщин соответственно. При этом у лиц, перенесших инсульт, ТИА в анамнезе отмечаются в довольно значительном числе случаев – от 7 до 40%. Полагают, что столь большой разброс объясняется рядом факторов, в том числе различными критериями диагностики ТИА в разных исследованиях. Многие ТИА остаются недиагностированными.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
К развитию ТИА как к одному из вариантов острого нарушения мозгового кровообращения могут привести различные факторы риска.
Ведущим фактором риска является атеросклероз магистральных артерий головы с формированием гемодинамически значимых стенозов и эмбологенных бляшек. Почти в 90% наблюдений развитие ТИА обусловлено атеротромбозом сонных артерий, чаще в месте их бифуркации на наружную и внутреннюю.
Вторым по распространенности фактором является наличие тромбов в полостях сердца и на его клапанах при фибрилляции предсердий (ФП), дилатационной кардиомиопатии, инфаркте миокарда, искусственных клапанах сердца, бактериальном и небактериальном эндокардите.
Значительно реже ТИА развиваются в результате:
- коагулопатии;
- ангиопатии, обусловленной артериальной гипертензией, сахарным диабетом или иными причинами;
- аномалии развития (перегиб, удвоение, гипо- или аплазия) сонной или позвоночной артерий, коарктации аорты;
- экстравазальной компрессии позвоночных артерий патологически измененными шейными позвонками;
- диссекции сонной или позвоночной артерий.
Основным механизмом развития ТИА является попадание микроэмболов из магистральных артерий головы или сердца в мелкие сосуды головы. Это сопровождается острым, но обратимым (без формирования инфаркта) критическим снижением кровоснабжения участка головного мозга в определенном артериальном бассейне. Ключевым моментом патогенеза ТИА является именно обратимая локальная ишемия мозга, развивающаяся при снижении церебральной перфузии ниже 18–22 мл на 100 г/мин. (при норме в 50–60 мл на 100 г/мин), что является функциональным порогом ишемии.
Преходящее падение кровотока в зоне, дистальнее места окклюзии артерии, приводит к появлению очаговой симптоматики. При восстановлении кровотока в результате механизмов ауторегуляции, открытия коллатералей наблюдается регресс фокальных симптомов и завершение сосудистого эпизода. В случае дальнейшего падения перфузии ниже порога обратимых изменений (8–10 мл на 100 г/мин) формируется инфаркт мозга.
КЛАССИФИКАЦИЯ
Общепризнанной классификации ТИА не существует.
В клинической практике нередко пользуются классификацией, соответствующей классификации ишемического инсульта (классификация TOAST), согласно которой выделяются следующие варианты ТИА:
- атеротромботическая – вследствие атеросклероза крупных артерий, приводящего к их стенозу или окклюзии. При фрагментации атеросклеротической бляшки или тромба развивается артерио-артериальная эмболия, также включаемая в данный вариант инсульта;
- кардиоэмболическая – наиболее частыми причинами являются мерцание предсердий, клапанный порок сердца, инфаркт миокарда, особенно давностью до 3 мес;
- лакунарная — вследствие окклюзии артерий малого калибра, поражение которых связано с артериальной гипертензией или сахарным диабетом;
- ТИА, связанная с другими более редкими причинами – неатеросклеротическими васкулопатиями, гиперкоагуляцией, гематологическими заболеваниями, гемодинамическим механизмом развития фокальной ишемии мозга, расслоением стенки артерий;
- ТИА неизвестного происхождения, к которому относят инсульты с неустановленной причиной или с наличием двух и более возможных причин, когда невозможно поставить окончательный диагноз.
ДИАГНОЗ
Основными задачами диагностики ТИА являются:
- исключение инфаркта мозга в первые часы от развития ТИА;
- исключение иных заболеваний, имеющих сходную с ТИА клиническую картину;
- определение этиологии ТИА с целью своевременного начала целенаправленной профилактики инфаркта мозга.
Диагностический алгоритм при ТИА такой же, как и при ишемическом инсульте.
Учитывая высокий риск развития ишемического инсульта у больного с ТИА, обследование и лечение должны быть проведены незамедлительно в условиях стационара.
Клинические признаки и симптомы
ТИА – цереброваскулярное заболевание с преходящими неврологическими симптомами. Симптомы при ТИА в большинстве своем такие же, как и у пациентов с ишемическим инсультом, и включают одностороннюю слабость в конечностях, затруднения речи, нарушения чувствительности, затруднения при ходьбе. Поскольку эти симптомы носят временный характер, они часто оцениваются на основании рассказа пациента, диагноз ТИА ставится ретроспективно, так как на момент осмотра больного специалистом очаговая неврологическая симптоматика уже отсутствует (рис. 1).
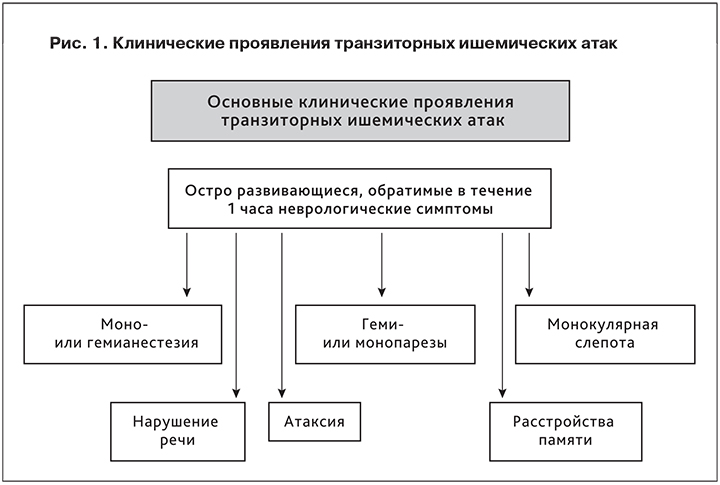
ТИА в системе сонных артерий проявляются преходящими моно- или гемипарезами, чувствительными нарушениями (моно- или гемианестезиями), расстройствами речи.
ТИА в вертебробазилярной системе характеризуются кратковременными вестибулярными и мозжечковыми расстройствами (атаксией, сис-темным головокружением, дизартрией). Иногда наблюдается гемианопсия или преходящее нарушение зрения на оба глаза.
Преходящая слепота. Транзиторная монокулярная слепота (ТМС), или amaurosis fugax, – сос-тояние чаще односторонней, внезапно возникающей кратковременной (обычно в течение нескольких секунд) утраты зрения вследствие преходящей ишемии в области кровоснабжения глазничной, задней цилиарной артерий или артерии сетчатки. Нарушение зрения чаще описывается больным как «штора» или «заслонка», которая надвинулась сверху вниз или снизу вверх. Иногда потеря зрения ограничена верхней или нижней половиной поля зрения. Обычно ТМС возникает спонтанно, без провоцирующих факторов, однако порой может вызываться ярким светом, изменением положения тела, физическими упражнениями или горячей ванной. Болевые ощущения для ТМС не характерны.
Транзиторная глобальная амнезия (ТГА) – уникальный синдром, при котором больной, чаще среднего возраста, внезапно теряет кратковременную память при относительной сохраннос-ти памяти на отдаленные события. Сознание пациента и ориентация в собственной личности не нарушены, но имеет место неполная ориентация в пространстве и окружающей обстановке. Отмечается стереотипное повторение одних и тех же вопросов, растерянность. Этиология этого драматического синдрома остается неизвестной, его пытаются объяснить ишемией гиппокампально-форникальной системы. Некоторые авторы считают данную патологию эпилептическим феноменом или вариантом мигрени. Эпизоды ТГА часто запускаются определенными факторами, такими как эмоциональные переживания, боль, половой акт. Приступы обычно длятся от нескольких десятков минут до нескольких часов. Восстановление памяти после приступа полное. Как правило, полностью или частично пациент вспоминает и события, происходящие во время эпизода амнезии. Неврологического дефицита при этом не бывает. Склонность к повторению небольшая, частота редкая – 1 раз в несколько лет.
Дифференциальный диагноз
Для того чтобы провести дифференциальную диагностику ТИА и заболеваний, ее имитирующих, необходимы тщательный сбор анамнеза, клиническое обследование, пальпация и аус-культация сонных артерий (при наличии систолического шума в месте бифуркации общей сонной артерии на наружную и внутреннюю – в области угла нижней челюсти, контралатерально имевшей место неврологической симптоматики, можно с большой долей вероятности предполагать развитие ТИА), а также соответствующие методы визуализации (рис. 2).
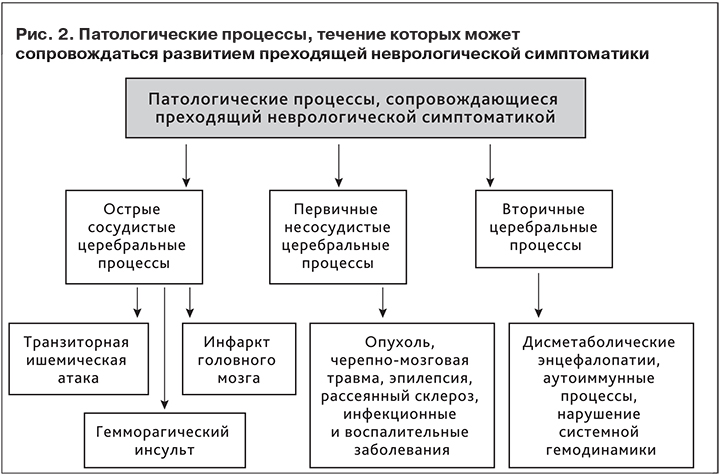
Сложность диагностики ТИА обусловлена широкой неспецифической палитрой симптоматики, определяющей необходимость проведения диффернциальной диагностики. Дифференциальный диагноз проводят с различными патологическими процессами, которые могут проявляться преходящими неврологическими нарушениями:
- ишемический инсульт с быстрым регрессом очаговой сиптоматики;
- геморрагический инсульт с быстрым регрессом очаговой сиптоматики;
- опухоль головного мозга;
- черпно-мозговая травма;
- парциальный эпилептический приступ;
- ассоциированная мигрень;
- демиелинизируюшее заболевание;
- гипервентиляционный синдром;
- конверсионое расстройство;
- аутоиммунные процессы;
- гипогликемическое состояние и др. дисметаболические процессы.
- Симптомы, не характерные для ТИА:
- нарушение сознания;
- изолированное несистемное головокружение;
- общая слабость;
- обморок;
- мерцающая (сверкающая) скотома;
- изолированный звон в ушах;
- недержание мочи и/или кала;
- поэтапное прогрессирование симптомов (особенно сенсорных), вовлекающих несколько частей тела;
- острые нарушения поведения.
Лабораторные и инструментальные исследования
Лабораторные исследования
Основные методы:
- общий клинический анализ крови с определением гематокрита и подсчетом тромбоцитов;
- общий анализ мочи;
- международное нормализованное отношение (МНО), активированное частичное тромбопластиновое время (АЧТВ), протромбиновое время, фибриноген;
- глюкоза крови;
- общий холестерин, липопротеиды высокой и низкой плотности, триглицериды;
- электролиты крови (калий, натрий, кальций, хлориды);
- активность трансаминаз, общий прямой билирубин;
- мочевина, креатинин;
- креатин-фосфокиназа, С-реактивный белок;
- общий белок.
Дополнительные (по показаниям):
- определение антифосфолипидных антител;
- выявление различных гиперкоагулопатий;
- определение гомоцистеина;
- белковые фракции;
- анализ крови на ВИЧ, сифилис, гепатиты В, С;
- молекулярно-генетические тесты при подозрении на наследственные синдромы (MELAS, CADASIL Фабри и др).
Инструментальные исследования
Основные методы
Основными методами диагностики ТИА являются визуализирующие исследования (мозга, сосудов, сердца), которые позволяют:
- исключить ишемический и геморрагический инсульт (инфаркт мозга, гематому, субарахноидальное кровоизлияие);
- провести дифференциальную диагностику с несосудистыми заболеваниями мозга;
- определить механизм развития ТИА (атеротромбоз крупного сосуда, кардиальный источник эмболии) и избрать рациональную профилактику инсульта.
Компьютерная и магнитно-резонансная томография
Проведение магнитно-резонансной томографии (МРТ) или компьютерной томографии (КТ) головы показано всем пациентам, у которых на основании клинической картины имеется подозрение на ТИА.
Методом выбора нейровизуализации при подозрении на ТИА является МРТ с использованием диффузионно-взвешенных изображений (ДВИ режим), которая обеспечивает наиболее точную раннюю оценку ишемических повреждений головного мозга.
Если МРТ противопоказана (наличие у пациентов кардиостимуляторов, металлических скобок на аневризме, металлических клапанов сердца) или недоступна, проводится рентгеновская КТ. Данный метод позволяет проводить дифференциальную диагностику со спонтанными и травматическими внутричерепными кровоизлияниями.
Срочные ультразвуковые исследования сосудов головы и шеи
Обязательным компонентом диагностики больного ТИА является неинвазивная ультразвуковая визуализация сосудов шеи и желательно внутричерепных сосудов. Этот метод дает возможность выявить стено-окклюзирующее поражение каротидных сосудов и определить необходимость выполнения хирургическо восстановления мозгового кровотока.
Дуплексное сканирование (ДС) магистральных (экстракраниальных) артерий головы (МАГ) применяется для диагностики стенозов, потенциально эмбологенных атеросклеротических бляшек в МАГ, нарушения целостности сосудистой стенки с формированием внутристеночной (интрамуральной) гематомы и наличия анатомических аномалий. По результатам ДС дополнительно получают информацию о кровотоке, гемодинамических нарушениях и степени их выраженности.
Транскраниальная допплерография (ТКДГ) церебральных артерий с микроэмболодетекцией позволяет оценить состояне интракраниальных артерий и обнаружить циркуляцию в них эмболов.
Магнитно-резонансная ангиография (МРА) или КТ-ангиография показаны в случаях, когда ДС не дает надежного результата. Как правило, это имеет место при развитии ишемии в вертебрально-базилярной системе.
Дополнительные инструментальные методы (нап-равлены на уточнение факторов риска ТИА):
ЭхоКГ показана при подозрении на кардиоэмболический механизм ТИА в тех случаях, когда данные анамнеза и/или объективного осмотра указывают на возможность кардиологической патологии, когда возраст пациента превышает 45 лет, а также когда результаты исследования сосудов шеи, головного мозга и исследования показателей крови не выявили причину ТИА. Трансэзофагальная ЭхоКГ более информативна, чем трансторакальная, в определении патологии межпредсердной перегородки (септальная аневризма, открытое овальное окно и др.), предсердных тромбов и заболеваний клапанов.
Каротидная ангиография является стандартной процедурой диагностики перед выполнением каротидной эндартерэктомии. Она также показана пациентам с ТИА в том случае, если ДС и МРТ (КТ-ангиография) дают противоречивые результаты или если их проведение невозможно.
ЭЭГ показана пациентам, у которых есть необходимость провести дифференциальную диагностику ТИА и эпилептического приступа.
Холтеровское суточное мониторирование ЭКГ по показаниям.
Суточное мониторирование АД по показаниям.
Осмотр глазного дна, периметрия по показаниям.
Формирование диагноза
В клиническом диагнозе ТИА отражается сосудистая система или бассейн, в котором произошла преходящая ишемия мозга (синдром сонной артерии или синдром вертебральнобазилярной артериальной системы), а также фоновый процесс, приведший к острому сосудистому осложнению в виде ТИА, аналогично тому, как это формулируется при инсульте. Два вида ТИА имеют собственные коды в международной классификации болезней – преходящая слепота (amaurosis fugax), наступающая вследствие эмболии глазной артерии и транзиторная глобальная амнезия, развивающаяся при двусторонней ишемии медиобазальных отделов височных долей.
ЛЕЧЕНИЕ
Согласно международным рекомендациям по ведению пациентов с ишемическим инсультом и транзиторными ишемическими атаками при подозрении на ТИА пациенты должны быть незамедительно госпитализированы в отделение для лечения острых нарушений мозгового кровообращения (рис. 3). Такой подход обусловлен высоким риском развития у них инсульта в ближайшие часы, а также необходимостью проведения дифферециальной диагностики с другими заболеваниями и состояниями, напоминающими ТИА.
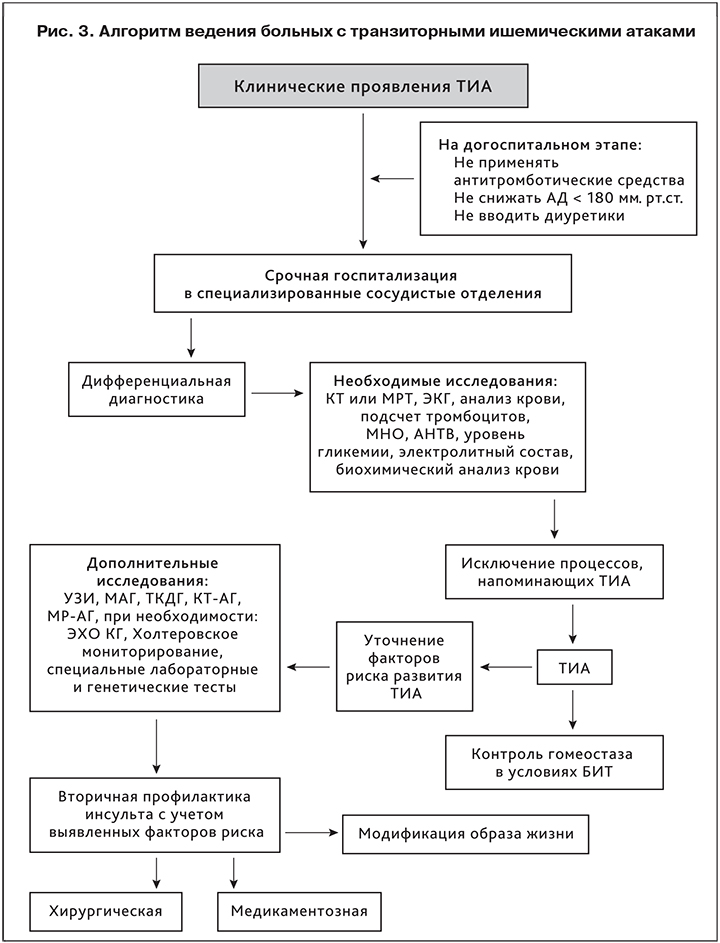
Лечение и вторичная профилактика инсульта у пациентов с ТИА неразделимы и начинаются с момента установления диагноза.
Немедикаментозное лечение
Хирургическое лечение:
- является ведущим направлением лечения пациентов, перенесших ТИА, а также профилактикой инсульта при наличии гемодинмически значимого стеноза (≥70%) или острой окклюзии МАГ;
- ангиохирургическое восстановление кровотока рекомендуется проводить в течение 24 часов после ТИА;
- при наличии индивидуальных противопоказаний к проведению операции в остром периоде решение о хирургическом вмешательстве принимается в плановом порядке на протяжении ближайших 6 месяцев;
- чаще проводится каротидная тромбэндартерэктомия. Стентирование сосудов осуществляется в особых случаях (сложный прямой доступ к сосуду, высокий риск периоперационных осложнений, рестеноз после каротидной эндартерэктомии и др.);
- до и после оперативного лечения проводится антиагрегантная терапия.
Медикаментозное лечение
Экстренная патогенетическая терапия ТИА на госпитальном этапе в условиях нейрососудистого отделения должна проводиться в объеме терапии ИИ, особенно в первые сутки заболевания, когда в большинстве случаев и клиническая, и инструментальная (КТ, МРТ) диагностика еще не дают убедительных доказательств в пользу того или иного варианта.
Как и при ИИ, терапевтические мероприятия состоят из базисной и специфической терапии.
Базисная терапия (включает контроль над основными функциями организма и поддержание гомеостаза):
- коррекция АД – желательно поддерживать уровень легкой артериальной гипертензии 160–180/90–100 мм рт.ст., не допускать значительного снижения АД, особенно у пациентов с двусторонним стенозом сонных артерий;
- контроль уровня глюкозы крови, при гипергликемии выше 11 ммоль/л — консультация эндокринолога в отношении инсулинотерапии, при гипогликемии ниже 3,3 ммоль/л – введение раствора глюкозы;
- контроль водно-электролитного баланса во избежание повышения гематокрита и снижения реологических свойств крови;
- электрокардиография – при выявлении аритмии – суточный мониторинг и консультация кардиолога.
При необходимости снижения АД при выраженной артериальной гипертензии (>220/120 мм. рт.ст.) предпочтение отдается следующим препаратам:
- кардиоселективный β-адреноблокатор ультракороткого действия эсмолол вводится в/в в дозе 500 мкг/кг в течение 1 мин (нагрузочная доза), затем 50 мкг/кг в минуту в течение последующих 4 мин; поддерживающая доза – 25 мкг/кг в минуту (или менее);
- блокатор α1-адренорецепторов урапидил назначают в дозе 12,5–25 мг (1 ампула содержит 5 мл 0,5%-ного раствора, т.е. 25 мг). Это количество препарата вводят в/в медленно в течение 5 мин. Препарат начинает действовать через 3–5 мин. Продолжительность действия – 4–6 ч. При недостаточном эффекте введение той же дозы повторяют (с интервалом не менее 15 мин). Эффективная доза может варьироваться от 25 до 100 мг. Если гипотензивный эффект оказывается недостаточно стойким, назначают медленную капельную инфузию препарата;
- ИАПФ каптоприл (применяется сублингвально в дозе 25 мг), эналаприл перорально в начальной дозе 5 мг, эналаприлат (вводится внутрь внутривенно медленно или капельно в течение 5 мин в дозе 1,25 мг каждые 6 ч).
- в случаях, резистентных к указанной терапии, возможно использование внутривенной инфузии периферического вазодилататора нитроп-руссида натрия (начинают вводить со скоростью 0,5 мг на 1 кг массы тела в минуту под постоянным контролем АД).
Специфическая антитромботическая терапия
Антитромботическая терапия пациентов с ТИА начинается незамедлительно, выполняя как лечебную, так и профилактическую функции, учитывая высокий риск инсульта в первые дни от развития ТИА. Выбор препарата определяется вариантом ТИА – кардиоэмболическим и некардиоэмболическим.
При некардиоэмболическом варианте развития ТИА назначается один их тромбоцитарных антиагрегантов:
- ацетилсалициловая кислота (Кардиомагнил, Тромбо-асс, Кардио АСК, Аспирин кардио и др.) в дозе 325 мг/сут в течение 48 часов с переходом на 50–100 мг/сут (из расчета 1 мг на кг веса пациента);
- клопидогрел (Плавикс, Эгитромб) 75 мг;
- дипиридамол (75 мг 3 раза в день);
- малые дозы (25 мг) аспирина+200 мг дипиридамола медленного высвобождения в капсулах 2 раза в сутки (Агренокс).
При кардиоэмболическом механизме развития ТИА (чаще всего в результате ФП) терапией выбора являются пероральные антикоагулянты:
- варфарин применяется с обязательным контролем МНО с поддержанием его на уровне 2–3. Начальная доза варфарина – 2,5 мг, при необходимости дозу наращивают до достижения целевого уровня МНО – 2–3. Контроль МНО и наращивание дозы на 1,25 мг осуществляется 1 раз в неделю. После титрования дозы контроль МНО уряжается до 1 раза в месяц. Варфарин применяется для профилактики повторного ТИА или инсульта при различных кардиальных источниках тромбов, как клапанных (особенно при искусственных клапанах сердца), так и неклапанных;
- так называемые новые оральные антикоаглянты рекомендуется применять только при неклапанной ФП: дабигатран по 150 или 110 мг (лицам старше 80 лет) 2 раза в сутки, ривароксабан по 20 или 15 мг(при среднетяжелых нарушениях функции почек) 1 раз в сутки, апиксабан по 5 или 2,5 мг (лицам старше 80 лет при массе тела <60 кг или креатинине сыворотки ≥133 мкМоль/л) 2 раза в сутки. При выраженном нарушении функции почек все антикоагулянты противопоказаны.
При наличии противопоказаний к пероральным антикоагулянтам назначается АСК в дозе 325 мг/сут в течение 48 часов с переходом на 50–100 мг/сут.
Оценка эффективности лечения
У пациента, перенесшего ТИА, критериями эффективности лечения являются:
- полный регресс неврологического дефицита;
- стабилизация жизненно важных функций и гомеостаза;
- нормализация лабораторных показателей;
- достижение целевых значений АД;
- восстановление кровотока, подтвержденное результатами ангиографических исследований и ультразвуковыми методами.
Осложнения и побочные эффекты лечения
Наиболее частым осложнением антитромботической терапии является кровотечение. При назначении даной терапии необходимо выяснить наличие потенциальных источников кровотечений у больного.
К факторам риска возникновения кровотечений относятся:
- состояние свертывающей системы крови;
- возраст старше 65 лет;
- артериальная гипертензия;
- нарушение функции почек и печени;
- кровотечение в анамнезе;
- язвенная болезнь в анамнезе;
- употребление алкоголя или наркотиков;
- сопутствующая терапия (НПВС, кортикостероидами);
- комбинированная антитромботическая терапия.
Но даже при опасности кровотечения в большинстве случаев риск разития инфаркта мозга или миокарда после перенесенной ТИА выше, чем риск кровотечений.
Ошибки и необоснованные назначения
Грубыми ошибками являются:
- отказ от госпитализации пациентов с ТИА;
- назначение антитромботической терапии на догоспитальном этапе;
- введение диуретиков на догоспитальном этапе;
- отсутствие мониторинга жизненно важных функций и ограниченные возможности оказания адекватной помощи пациентам с ТИА;
- стремление к снижению артериального давления при умеренной артериальной гипертензии.
ПРОГНОЗ
При своевременной экстренной госпитализации больного с ТИА и адекватной неотложной терапии симптомы ТИА претерпевают обратное развитие.
Более чем у половины пациентов, перенесших ТИА, сохраняется угроза развития сердечно-сосудистых осложнений, таких как инсульт, инфаркт миокарда, сосудистая смерть.
Риск развития инсульта в течение 3 месяцев после ТИА соствляет от 10 до 20%. У половины их них инфаркт мозга формируется в первые 2 дня после преходящей неврологической симптоматики.
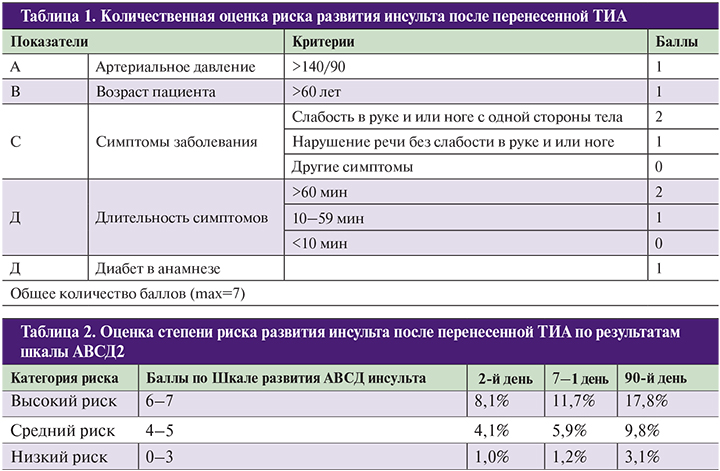
Для прогнозирования риска развития инсульта после перенесенной ТИА разработана шкала AВCД2 (табл. 1, 2).
Почти 60% из перенесших ТИА больных умирают в течение 5 лет от других сердечно-сосудистых заболеваний.
После ТИА рекомендуется постоянная терапия с целью профилактики инсульта и других сердечно-сосудистых заболеваний.
Ведение пациентов, перенесших ТИА на амбулаторном этапе лечения
Профилактика повторных ТИА и инсульта
Антитромботическая терапия продолжается практически пожизненно, особенно для пациентов, имеющих высокий риск развития инсульта по шкале AВCД2 .
Пациентам с артериальной гипертензией с целью профилактики повторых ТИА и инсульта показана постоянная атигипертензивная терапия. Целевой уровень АД определяется индивидуально, но он не должен быть ниже 130/80 мм. рт.ст. при хирургически неустраненном одностороннем стенозе сонной артерии более 70% диаметра сосуда и ниже 150 мм. рт.ст. – при гемодинамически значимом стенозе сонных артерий с двух сторон. Выбор антигипертензивного препарата определяется наличием сопутствующих и фоновых заболеваний.
При атеротромботических процессах, особенно при наличии рыхлых эмбологенных бляшек в сонных артериях, а также на фоне дслипидемии показано назначение статинов.
Модификация образа жизни (отказ от вредных привычек, соблюдение диеты, рациональная двигательная активность).
Для активации процессов восстановления ишемизированных нейронов, поддержания эндогенных защитных механизмов нервной ткани, стимуляции нейропластичности мозга целесообразно назначение препаратов нейротрофического ряда. Одним из доказанных препаратов этой группы является Церебролизин, содержащий в своём составе фрагменты нейротрофических факторов, биологически активные пептиды и аминокислоты. В исследовании ECOMPASS с помощью современных методик нейровизуализации (трактография/фМРТп) продемонстрировано раннее и более полное раскрытие потенциала нейропластичности в группе комбинированной терапии (Церебролизин+реабилитационные мероприятия). В нескольких отечественных рандомизированных исследованиях (Гусев Е.И., Чуканова Е.И.) было показано, что добавление Церебролизина к стандартному лечению пациентов с ХИМ (10 мл в/в в течение 10 дней каждые полгода) или перенесших инсульт (20 мл в/в в течение 10 дней с повторным курсом через полгода) снижает количество вновь возникших/повторных инсультов и ТИА.
Профилактика когнитивных расстройств после перенесенных ТИА
Когнитивные нарушения (КН) выявляются почти у 40% пациентов, перенесших ТИА или «малые инсульты». Чаще КН выявляются у лиц пожилого и старческого возраста, у которых сосудистый процесс может стимулировать прогрессирование субклинически протекающей нейродегенерации.
В настоящее время с позиций доказательной медицины показана роль регулярной физической нагрузки на профилактику КН у пациентов, перенесших инсульт или ТИА.
Имеет значение проведение когнитивного тренинга, разноплановой сенсорной стимуляции, сохранение социальных контактов.
Целесообразным также является подключение медикаментозной поддержки когнитивных функций препаратами нейрометаболического ряда. Желательно, обладающими дополнительными свойствами, направленными на патогенетические механизмы цереброваскулярных заболеваний и уменьшение патологического воздействия фоновых заболеваний. С этих позиций хорошо зарекомендовали себя такие лекарственные средства, как депротеинизированный гемодериват (Актовегин) и цитиколин (Цераксон®). Оба препарата обеспечивают умеренное, но стабильное улучшение памяти и поведения пациентов с КН.
В исследовании ARTEMIDA показано достоверное улучшение когнитивных функций у пациентов с ишемическим инсультом, принимавших на протяжении 6 месяцев Актовегин в дозе 2000 мг в/в капельно 3 недели с последующим пероральным приемом 1200 мг/сут в течение 21 недели. Стойкий терапевтический эффект сохранялся еще на протяжении 6 месяцев после отмены терапии.
В многочисленных клинических испытаниях доказана положительная роль цитиколина для пациентов в остром периоде инсульта и на этапе реабилитации. В исследовании IDEALE отмечена эффективность и безопасность перорального приема цитиколина (1 г/сут) у лиц пожилого возраста с умеренными сосудистыми КН.



