Гестационная трофобластическая болезнь (ГТБ) – это общее название группы пролиферативных изменений трофобласта, включающей хорионкарциному, эпителиоидную трофобластическую опухоль и трофобластическую опухоль плацентарного ложа (ТОПЛ) [1]. Частота встречаемости ГТБ варьирует в разных регионах: от 0,6 до 1,1 на 1000 беременностей – в Европе и Северной Америке, 2 на 1000 беременностей – в Японии и 1 на 160 – в Индии и на Востоке [2].
ТОПЛ – это неворсинчатая опухоль, возникающая на плацентарной части трофобласта. Характеризуется инфильтрирующим ростом с внедрением в стенку сосудов и замещением их гладкомышечных элементов гиалиновым материалом [3]. Часто осложняется разрушением серозной оболочки матки и массивным кровотечением. ТОПЛ составляет 0,23–3% всех ГТБ, являясь самой редкой патологией из вышеперечисленных [1, 3]. В литературе описаны всего около 300 случаев развития этой опухоли. Чаще всего ТОПЛ встречается у женщин репродуктивного возраста и может развиваться как после нормальной беременности (61% всех случаев), так и после выкидыша (9%), искусственного аборта (8%), внематочной беременности, мертворождения и преждевременных родов (3%) [4].
 Впервые о существовании ТОПЛ сообщили Kurman, Scully и Norris в 1976 г., когда описали 12 клинических случаев этой болезни. Названа она была ими «трофобластическая псевдоопухоль» в связи с подозрением на доброкачественное течение процесса [5], хотя ранее похожие неоплазии определяли как атипичную саркому, ассоциированную с беременностью [6]. В 2000 г. International Federation of Gynecology and Obstetrics (FIGO) была принята классификация, действующая для всех форм ГТБ (таблица).
Впервые о существовании ТОПЛ сообщили Kurman, Scully и Norris в 1976 г., когда описали 12 клинических случаев этой болезни. Названа она была ими «трофобластическая псевдоопухоль» в связи с подозрением на доброкачественное течение процесса [5], хотя ранее похожие неоплазии определяли как атипичную саркому, ассоциированную с беременностью [6]. В 2000 г. International Federation of Gynecology and Obstetrics (FIGO) была принята классификация, действующая для всех форм ГТБ (таблица).
Патогенез ТОПЛ не изучен полностью, перед исследователями всех стран до сих пор остается ряд нерешенных вопросов. Большинство авторов сходятся во мнении, что в патогенезе ТОПЛ значимую роль играет развивающийся при оплодотворении сбой контроля кариотипа, приводящий к удвоению отцовских хромосом при одновременной потере материнских [5]. Это определяет развитие анеуплодии в оплодотворенной яйцеклетке. Такой дефект кариотипа ведет к нарушению развития трофобласта, а следовательно, и к развитию ГТБ, в том числе и ТОПЛ [5, 7]. Но проведенные крупные генетические исследования установили, что при ТОПЛ чаще встречаются диплоидия, тетраплоидия, а не анеуплоидия, как при других формах ГТБ [8]. Кроме того, ученые выявили в некоторых изученных случаях полное отсутствие Y-хромосомы при наличии гаплоидной пары X-хромосомы. В то же время неизвестно, как именно Х-хромосома детерминирует опухолевую трансформацию трофобласта [9].
Учитывая исключительную редкость ТОПЛ, судить о ее морфологии можно, основываясь, как правило, лишь на немногочисленных сообщениях о случаях возникновения этой патологии в клинической практике [10]. Тем не менее известно о двух крупных исследованиях, проведенных учеными из Великобритании и Китая, результаты которых приблизили нас к пониманию ТОПЛ [11]. Основная проблема заключается в отсутствии большой выборки пациентов. Итак, ТОПЛ представляет собой злокачественную мономорфную опухоль, берущую начало из промежуточных клеток трофобласта с признаками синцитио- и цитотрофобласта [12]. Промежуточные клетки трофобласта обычно большие, полигональные, с круглым или плеоморфным гиперхроматическим ядром, с прозрачной, или амфофильной, или эозинофильной обильной цитоплазмой. Промежуточные клетки такого типа в норме располагаются в месте имплантации эмбриона, непосредственно способствуя процессу нидации, так как имеют склонность к местной инвазии, что, в свою очередь, и определяет агрессивное прорастание миометрия у ТОПЛ [4, 7, 13].
Методом иммуногистохимии (ИГХ) при ТОПЛ выявляется высокая экспрессия плацентарного лактогена, CD 146, а также ассоциированного с беременностью протеина-А [11]. Ассоциированный с беременностью протеин-А является маркером промежуточных клеток трофобласта и именно поэтому очень важен для дифференциальной диагностики ТОПЛ и эпителиоидной трофобластической опухоли [9, 12]. На ранних стадиях в сыворотке крови плацентарный лактоген может не определяться, зато достаточно хорошо обнаруживается методом ИГХ в биопсийном материале [3]. Таким образом, плацентарный лактоген является хорошим диагностическим маркером ранней ТОПЛ. β-Субъединица хорионического гонадотропина человека (β-ХГЧ), как и р63, обычно экспрессируется в минимальном количестве клеток [14]; отмечается незначительная экспрессия Ki-67, α-ингибина, CK 8/18 [5, 15].
Β-ХГЧ в крови нарастает медленно (средний уровень 132 мМЕ/мл), что также позволяет дифференцировать ТОПЛ от других форм ГТБ [8]. Высокий уровень β-ХГЧ и глубокая инфильтрация миометрия могут быть предикторами раннего метастазирования в легкие, печень, влагалище, кишечник, мозг, лимфатические узлы или даже через плаценту в плод [2, 7]. Но на ранних стадиях β-ХГЧ в крови может и не определяться. Кроме того, уровень сывороточного β-ХГЧ не совсем адекватно отражает опухолевую прогрессию и часто дает ложноотрицательные результаты [16]. Во всех случаях после хирургического лечения исходно повышенный уровень β-ХГЧ снижается и достигает негативной отметки в течение месяца, а в дальнейшем стабилизируется [5, 7].
M. Stichelbout et al. изучали возможности практического применения маркера SALL4 для дифференциальной диагностики хорионкарциномы и ТОПЛ [17]. Так, было показано, что высокая экспрессия SALL4 наблюдается при хорионкарциноме и отсутствует при ТОПЛ и эпителиоидной трофобластической опухоли. Изученный авторами маркер p63 положителен при эпителиоидной трофобластической опухоли и отсутствует при ТОПЛ. Описанные особенности экспрессии ИГХ-маркеров очень важны для дифференциальной диагностики, так как каждая из форм ГТБ требует персонализированного подхода к терапии [11]. Тем не менее был зарегистрирован единственный случай одновременного наличия эпителиоидной трофобластической опухоли и хорионкарциномы у пациентки в Австралии в 2013 г. [7].
ТОПЛ отличается сравнительно медленным ростом, причем период времени от ее бессимптомного развития до возникновения яркой клинической картины занимает от 2 месяцев до нескольких лет. Обычно ТОПЛ манифестирует рядом неспецифических симптомов, таких как тошнота, рвота, боли в животе [1, 6, 8, 17]. В 95% случаев присутствуют жалобы на дисциркуляторные маточные кровотечения. В яичниках иногда развиваются лютеиновые кисты [10, 11]. Реже наблюдаются галакторея, вирилизация, нефротический синдром, полицитемия, а также β-ХГЧ-индуцированный гипертиреоз [6]. На поздних стадиях заболевания присоединяются симптомы, связанные с метастатическим поражением органов. Таким образом, клиническая картина ТОПЛ абсолютно неспецифична и непредсказуема [18].
Первичная опухоль плацентарного ложа обычно локализуется в области дна или тела матки [1, 2, 5]. Некоторыми авторами описаны случаи внематочной локализации. Например, известны ТОПЛ, располагавшиеся в шейке матки. Такое расположение, возможно, является следствием шеечной беременности или миграции опухолевых клеток при спонтанном регрессе ТОПЛ дна или тела матки [13]. В целом ТОПЛ внематочной локализации достаточно редки, и, хотя зарегистрированы несколько случаев поражения маточных труб, яичников, описан лишь единственный случай ТОПЛ периуретральной локализации [15]. В месте локализации поражения всегда выражены некроз тканей и кровоизлияния [19].
В исследовании Hyman et al. подробно описаны особенности метастазирования при ТОПЛ. Так, наиболее часто отдаленные метастазы были обнаружены в мозге, печени, позвоночнике и влагалище. В почки и надпочечники ТОПЛ дает метастазы в минимальном проценте случаев [15]. Лимфогенные метастазы, по данным разных источников, встречаются в 10–35% случаев. Horowitz et al. в 2016 г. опубликовали данные, согласно которым в 5,9% ТОПЛ метастазы в лимфатических узлах присутствуют уже во время постановки диагноза [14].
Диагностика ТОПЛ представляет значительные трудности для специалистов, особенно на ранних стадиях. Причиной этого является отсутствие специфической клинической картины, низкие уровни β-ХГЧ в сыворотке крови, малый объем поражения матки. Только морфологическое исследование с применением ИГХ-анализа способно достоверно подтвердить диагноз [8]. Значимую роль в ошибочной диагностике ТОПЛ играет редкость патологии, отсутствие компетентных знаний в этой области со стороны специалистов, что связано с малой изученностью этой проблемы [20]. В связи с этим клиническое мышление врачей не всегда учитывает наличие ТОПЛ. В сообщении French Trophoblastic Disease Reference Center приблизительно 30% пациенткам при первичном обращении был поставлен диагноз эктопической беременности. В 7 из 18 случаев (40%) первичный диагноз был поставлен неверно [14, 16].
В литературе имеется ограниченное количество сообщений, описывающих основные характеристики ТОПЛ, выявленных инструментальными методами. Zhao et al. описали 3 типа ТОПЛ, определяющихся при трансвагинальной сонографии с цветовым допплеровским картированием: тип 1 – гетерогенная солидная масса в полости матки с низкой или умеренной степенью васкуляризации; тип 2 – гетерогенная солидная масса в миометрии с низкой или высокой степенью васкуляризации; тип 3 – полостное образование в миометрии с крайней высокой степенью васкуляризации [11].
На магнитно-резонансной томографии (МРТ) ТОПЛ также выглядит неспецифично: часто наблюдается деформация изображения матки, вызванная поражением миометрия или эндометрия опухолью, которая обычно изоинтенсивна по отношению к нормальному миометрию на T1-взвешенных изображениях и гиперинтенсивна по отношению к миометрию на T2-взвешенных изображениях. Также наблюдается диффузный неоднородный рисунок матки с потерей зональной анатомии. Были описаны две модели васкуляризации ТОПЛ: гиперваскулярный тип, при котором визуализация опухоли усиливается после введения контраста, и гиповаскулярный тип, при котором опухоль визуализируется гораздо меньших размеров. Визуализация при гиповаскулярном типе поражения незначительно улучшается после введения гадолиния [13].
Наряду с МРТ, может быть использована и компьютерная томография. Этот метод применяют для диагностики очагов отдаленного метастазирования. Об эффективности использования позитронной эмиссионной томографии с фтордезоксиглюкозой данных в настоящее время недостаточно [6].
Дифференциальную диагностику ТОПЛ следует проводить со злокачественными формами ГТБ, а также с доброкачественными трофобластическими разрастаниями, регрессирующими спонтанно.
В отличие от других типов ГТБ, ТОПЛ характеризуется низкой чувствительностью к химиотерапии [7, 9]. В Великобритании был применен опыт лечения пациенток с метастатическими ТОПЛ с использованием только химиотерапии, и в 60% случаев отмечен частичный ответ или его полное отсутствие [10]. Хотя гистерэктомия позволяет радикально удалить опухоль, в случаях с обширным метастатическим поражением хирургического вмешательства недостаточно, а факт низкой чувствительности ТОПЛ к химиотерапии имеет решающее значение в исходе заболевания [12]. Итак, ТОПЛ, локализованная в матке, может быть радикально удалена только посредством гистерэктомии с расширенной лимфаденэктомией, но случаи с отдаленными метастазами требуют включения в стандарт лечения комбинированной химиотерапии [5]. У женщин репродуктивного периода и в пременопаузе яичники обычно сохраняют, если нет признаков их поражения или данных за наличие рака яичников у близких родственников [17]. Некоторыми авторами описаны случаи органосохраняющих операций на матке в группе женщин, желающих сохранить фертильность. Однако такой вариант лечения всегда связан с прогнозируемыми рисками, так как, во-первых, невооруженным глазом нельзя точно определить степень опухолевого прорастания тканей, во-вторых, из-за контактной кровоточивости опухоли затрудняется визуализация, в-третьих, не исключается диссеминация опухолевых клеток по всей поверхности матки [1, 6, 7, 11]. Использование трансвагинальной сонографии имеет огромное значение для определения резидуальной опухоли, так как гистероскопически далеко не всегда удается добиться радикального иссечения ТОПЛ в пределах здоровых тканей; то есть всегда есть риск рецидивирования [7].
Даже после радикальной гистерэктомии частота рецидивов достигает 30%. Таким образом, хирургическое лечение при ТОПЛ является основным, в отличие от хорионкарциномы. В общем, пациенты с ТОПЛ имеют достаточно хороший прогноз, если заболевание выявляется на ранних стадиях, когда предпочтение отдается радикальному хирургическому лечению [13].
Для больных со второй и третьей стадиями болезни возможно назначение в качестве монотерапии этопозида или актиномицина D в течение 5 дней. Пациентам с факторами риска – высоким индексом пролиферации Ki-67, метастатическим поражением при четвертой стадии заболевания – показано назначение химиопрепаратов по схеме EP/EMA (этопозид и препараты платины или этопозид, метотрексат с фолиевой кислотой, актиномицин D) или TE/TP (паклитаксел, цисплатин/паклитаксел, этопозид) [14]. В некоторых источниках сообщается об успешном опыте использования адъювантной лучевой терапии. Больные с экстрапульмональными метастазами проходят достаточно агрессивный курс химиотерапии; такая тактика лечения увеличивает медиану общей выживаемости, по данным Hyman, до 12,6 месяца [12, 14]. В одном недавно опубликованном наблюдении сообщается о регрессе метастатических очагов в легких с нормализацией уровня β-ХГЧ, но с сохранением первичной опухоли в матке, после четырех курсов химиотерапии с использованием этопозида, метотрексата, актиномицина D, циклофосфамида, винкристина [11].
К факторам риска развития ТОПЛ относятся позднее менархе, олиго- и аменорея, прием комбинированных оральных контрацептивов. Но до сих пор отсутствует единое мнение по поводу основных прогностических факторов развития ТОПЛ [1, 2, 8, 9]. Считается, что имеет значение период времени, прошедший с момента последней беременности. Длительность этого периода всеми авторами признается как наиболее чувствительный фактор прогноза, причем, чем он длиннее, тем хуже прогноз. Некоторые исследователи считают факторами прогноза высокий уровень β-ХГЧ (>10 000 мМЕ/мл), возраст ≥40 лет, высокий митотический индекс Ki-67, число беременностей >2 в анамнезе, размер опухоли >30 мм, глубокую инвазию в миометрий (более ½ толщины). Хотя уровни β- ХГЧ не коррелируют со степенью опухолевой агрессии, это достаточно чувствительный маркер для мониторинга опухолевого ответа на терапию [1, 3, 5, 12] в случае его исходного повышения.
Согласно данным литературы, именно стадия болезни является основным прогностическим фактором ТОПЛ. Десятилетняя выживаемость больных с ТОПЛ I стадии с маточной локализацией составляет 90%, для больных с II–IV стадиями – около 50%. При ТОПЛ внематочной локализации прогноз хуже [7].
В 2009 г. International Society for the Study of Trophoblastic Disease (ISSTD) создало первую базу данных пациенток с ТОПЛ/эпителиоидной трофобластической опухолью. На XVIII конгрессе ISSTD в 2015 г. был представлен самый масштабный анализ 326 пациенток из 20 научно-исследовательских институтов всего мира. Зарегистрировать пациентку в базе данных можно, перейдя по ссылке http//:stdc.group.shef.ac.uk/psttuhr/index.html [17].
В отделении онкогинекологии ФГБУ «НМИЦ онкологии» в течение последних 5 лет на лечении находились 4 больные с ТОПЛ. Приводим описание клинического наблюдения.
Клиническое наблюдение
 Пациентка А., 30 лет, в ноябре 2013 г. перенесла преждевременные повторные роды без осложнений. В течение года кормила ребенка грудью. После прекращения лактации менструальный цикл не восстановился, по поводу чего пациентка обратилась к гинекологу по месту жительства. На основании данных ультразвукового исследования (УЗИ) и уровня β-ХГЧ в сыворотке крови был поставлен диагноз неразвивающейся беременности. В мае 2015 г. в условиях стационара было выполнено лечебно-диагностическое выскабливание матки. Заключение гистологического анализа содержало описание эндометрия в фазе обратного развития после нарушенной беременности. По истечении 6 месяцев после проведения данной процедуры менструальный цикл восстановлен не был. На повторном УЗИ патологии органов малого таза не было обнаружено. Β-ХГЧ, по результатам неоднократных измерений, находился в пределах 230–300 мМЕ/мл. Однако внимание врача на повышение β-ХГЧ в сыворотке крови акцентировано не было. В январе 2016 г., спустя 2 года и 3 месяца после родов, пациентка стала отмечать у себя появление нерегулярных маточных кровотечений. Самостоятельно обратилась в ФГБУ «НМИЦ онкологии», где при комбинированном сонографическом исследовании было обнаружено узловое образование стенки матки. При нормальных уровнях онкомаркеров СА-125, Не4, РЭА β-ХГЧ оставался повышен до 293 мМЕ/мл. Было решено провести пациентке диагностическое выскабливание полости матки под контролем гистероскопии, после чего был получен обильный крошковидный соскоб, макроскопически не напоминающий ни пузырный занос, ни ткань при неразвивающейся беременности. Гистологическое исследование соскоба обнаружило обширные пласты промежуточного трофобласта имплантационного типа с отложением фибрина, очагами некроза и полным отсутствием ворсин хориона. Клиническая картина, повышенный уровень β-ХГЧ и данные гистологического исследования соответствовали ТОПЛ. Для подтверждения диагноза ТОПЛ был проведен ИГХ-анализ, который определил высокий уровень экспрессии плацентарного лактогена. Данный маркер обладает высокой чувствительностью и специфичностью в отношении ТОПЛ.
Пациентка А., 30 лет, в ноябре 2013 г. перенесла преждевременные повторные роды без осложнений. В течение года кормила ребенка грудью. После прекращения лактации менструальный цикл не восстановился, по поводу чего пациентка обратилась к гинекологу по месту жительства. На основании данных ультразвукового исследования (УЗИ) и уровня β-ХГЧ в сыворотке крови был поставлен диагноз неразвивающейся беременности. В мае 2015 г. в условиях стационара было выполнено лечебно-диагностическое выскабливание матки. Заключение гистологического анализа содержало описание эндометрия в фазе обратного развития после нарушенной беременности. По истечении 6 месяцев после проведения данной процедуры менструальный цикл восстановлен не был. На повторном УЗИ патологии органов малого таза не было обнаружено. Β-ХГЧ, по результатам неоднократных измерений, находился в пределах 230–300 мМЕ/мл. Однако внимание врача на повышение β-ХГЧ в сыворотке крови акцентировано не было. В январе 2016 г., спустя 2 года и 3 месяца после родов, пациентка стала отмечать у себя появление нерегулярных маточных кровотечений. Самостоятельно обратилась в ФГБУ «НМИЦ онкологии», где при комбинированном сонографическом исследовании было обнаружено узловое образование стенки матки. При нормальных уровнях онкомаркеров СА-125, Не4, РЭА β-ХГЧ оставался повышен до 293 мМЕ/мл. Было решено провести пациентке диагностическое выскабливание полости матки под контролем гистероскопии, после чего был получен обильный крошковидный соскоб, макроскопически не напоминающий ни пузырный занос, ни ткань при неразвивающейся беременности. Гистологическое исследование соскоба обнаружило обширные пласты промежуточного трофобласта имплантационного типа с отложением фибрина, очагами некроза и полным отсутствием ворсин хориона. Клиническая картина, повышенный уровень β-ХГЧ и данные гистологического исследования соответствовали ТОПЛ. Для подтверждения диагноза ТОПЛ был проведен ИГХ-анализ, который определил высокий уровень экспрессии плацентарного лактогена. Данный маркер обладает высокой чувствительностью и специфичностью в отношении ТОПЛ.
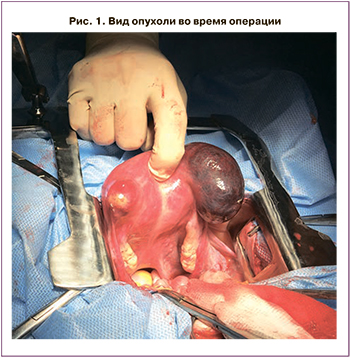
Так как ТОПЛ ограничивалась телом матки без прорастания подлежащих тканей и наличия отдаленных метастазов, то процесс был отнесен к I стадии, согласно классификации FIGO. В связи с этим первым этапом лечения было рекомендовано проведение хирургического лечения в объеме нервосберегающей расширенной экстирпации матки с маточными трубами и дренированием брюшной полости. Макроскопически яичники имели обычное строение. В области дна и трубных углов матки со стороны серозы определялись лакуны от 1 до 8 см в диаметре, заполненные кровянистым содержимым. В полости матки, в области дна и боковых стенок располагалась опухоль, проникающая в миометрий до 12 мм при толщине стенки матки 30 мм. В области образования лакун опухоль распространялась до серозы (рис. 1–3).
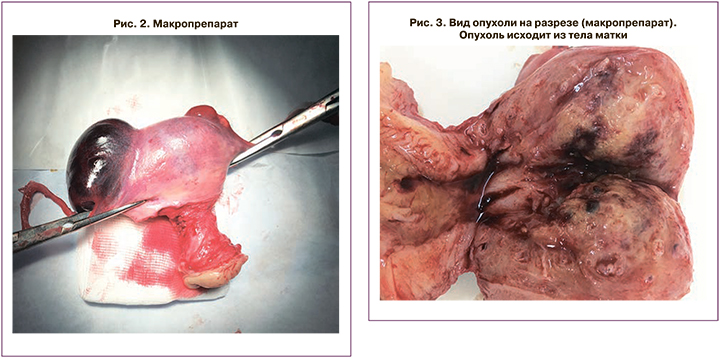
Гистологически новообразование соответствовало строению ТОПЛ. Уже через 12 дней после операции уровень β-ХГЧ снизился до 5,6 мМЕ/мл, а через 1 месяц составлял 0,06 мМЕ/мл. В настоящее время пациентка А. продолжает находиться под наблюдением в ФГБУ «НМИЦ онкологии» без признаков возобновления заболевания.
В трех других случаях ТОПЛ больные также были радикально прооперированы в отделении онкогинекологии (в соответствии с рекомендациями лечения ТОПЛ при I стадии). На настоящий момент средний срок наблюдения за больными составляет 34,6 месяца. В течение данного периода ни у одной больной не зарегистрировано прогрессирования заболевания: уровень β-ХГЧ находится в пределах референсных значений, по данным инструментальных методов обследования (УЗИ, СРКТ) рецидива и отдаленных метастазов не зафиксировано.
Заключение
ТОПЛ – самая редкая опухоль из группы ГТБ, которая была описана относительно недавно. Недостаточность точных сведений об этой патологии связана с очень малой выборкой пациентов, так как с момента открытия этой опухоли в 1976 г. до наших дней было описано всего около 300 случаев. Главной особенностью ТОПЛ является исходная резистентность к химиотерапии, в связи с чем на первый план выходит хирургическое лечение. В случае отсутствия отдаленных метастазов экстирпации матки обычно достаточно, об этом говорит 90% 10-летняя выживаемость пациенток с I стадией ТОПЛ. В продемонстрированном нами клиническом случае за 44 месяца наблюдения в постоперационном периоде состояние пациентки остается стабильным, признаков прогрессирования зарегистрировано не было. Таким образом, имеет большое значение ранняя постановка диагноза, когда опухоль ограничена маткой и может быть радикально удалена, а также отсутствует необходимость назначения химиотерапии. Ввиду крайней редкости ТОПЛ, а также отсутствия патогномоничных симптомов заболевания крайне важно, чтобы больные обследовались и лечились в профильных специализированных онкологических учреждениях, имеющих опыт лечения таких больных.



