Введение
Сердечно-сосудистые заболевания, основой которых считается инфаркт миокарда (ИМ), характеризуются значительной распространенностью и смертностью в промышленно развитых странах [1]. Критическим компонентом кардиоваскулярной патофизиологии является экстрацеллюлярный матрикс (ЭЦМ), который служит хранилищем для широкого спектра молекул, выделяющихся в результате повреждения или старения [2]. Главную роль в деградации субстратов ЭЦМ (коллагена, эластина, фибронектина, ламинина, протеогликанов) и не-ЭЦМ (интерлейкина-1β – ИЛ-1β, -6, латентного трансформирующего фактора роста-β, фактора некроза опухолей-α, интерферона γ) миокарда и в ослаблении фиброзной атеросклеротической капсулы играет воспалительный процесс, индуцированный матриксными металлопротеиназами (MMP), особенно MMP-9 [3, 4]. Усиленное высвобождение ММР-9, продуцируемой многими типами клеток (макрофагами, Т-лимфоцитами, эндотелиальными клетками, нейтрофилами, макрофагами, фибробластами), играет ключевую роль в развитии острых коронарных событий, включая острый коронарный синдром (ОКС) [5, 6], ИМ [7, 8], аритмии [9].
Дестабилизация атеросклеротических бляшек с разрушением ЭЦМ остается непредсказуемой, но, сопровождаясь увеличением экспрессии и активности MMP-9, определяет стратегию и пути решения проблемы стабилизации поражения [10–12]. Большое значение имеет изучение динамики показателей ММР-9 у пациентов с кардиоваскулярной патологией, потому что избыточная экспрессия ММР-9 может быть как вредной, так и полезной [13], а уровни MMP-9 в плазме до начала впервые возникших коронарных событий могут иметь прогностическое значение. Циркулирующий ММР-9 увеличивается с 1-го дня и остается повышенным до 7-го дня ИМ, коррелирует с концентрациями ИЛ-6, C-реактивного белка и фибриногена [13]. Этот механизм может представлять важную терапевтическую мишень [14]. В то же время мы до сих пор не до конца понимаем сложность механизмов действия ММР-9 [13] и их участие в развитии различных форм ишемической болезни сердца (ИБС). Имеются данные о значительном снижении уровня ММР-2, а также симптомов сердечной недостаточности при раннем применении аторвастатина [15]. Высказываются предположения о торможении статинами синтеза ММР наряду с подавлением экспрессии медиаторов воспаления, способствующих разрыву поверхности бляшек [16]. Однако вопрос влияния разных доз статинов на систему MMP далек от окончательного разрешения [17, 18].
Цель работы: исследовать уровни ММР-9 у больных ОКС без подъема сегмента ST (ОКС БП ST) и выявить влияние разных доз аторвастатина на ММР-9 и показатели, характе-ризующие состояние оксидативного стресса.
Методы
Были обследованы 68 пациентов (47 мужчин и 21 женщина) с ОКС БП ST (средний возраст – 55,6±3,6 года) со сроком дестабилизации течения заболевания не более суток. Сорока восьми пациентам диагностирована нестабильная (прогрессирующая) стенокардия (НС), 20 – Q-негативный ИМ. Все больные, получавшие стандартную терапию (ацетилсалициловую кислоту, β-адреноблокатор, ингибитор аниотензинпревращающего фермента, низкомолекулярный гепарин), были разделены на три группы в зависимости от назначенной дозы аторвастатина: 22 пациента 1-й группы – 20 мг/сут; 24 пациента 2-й группы – 40 мг/сут, 22 пациента 3-й группы – 60 мг/сут. В группу сравнения вошли 30 больных ИБС со стабильной стенокардией напряжения II функционального класса, контрольную группу составили 15 практически здоровых лиц. Все обследованные лица были сопоставимыми по возрасту и полу.
Помимо опроса, физикального и общеклинического обследований всем пациентам были проведены электрокардиография (ЭКГ) в 12 стандартных отведениях и исследование уровней тропонина-I. Содержание ММР-9 в сыворотке крови определяли иммуноферментным методом с использованием тест-систем ММР-9 – «QuantikineТМ; R&D Systems» (Великобритания). Про- и антиоксидантный статус крови оценивали по содержанию малонового диальдегида (МДА) и сульфгидрильных групп (SH-групп). Определение МДА в сыворотке крови проводили по реакции с тиобарбитуровой кислотой, SH-групп – с реактивом Эллмана [19]. Содержание стабильного метаболита NO (NO2) в плазме крови определяли спектрофотометрическим методом по реакции Грисса [20]. Лабораторные исследования проводили при поступлении больных в стационар и после 4 недель лечения.
Статистическую обработку проводили, используя программы MS Excel 10 и Wizard-Statistics (США). При нормальном распределении в сравниваемых группах использовали критерий Стьюдента (t-критерий) с представлением данных в виде среднего значения (Х), стандартной ошибки среднего значения (m) и указаний статистически значимого уровня p<0,05.
Результаты
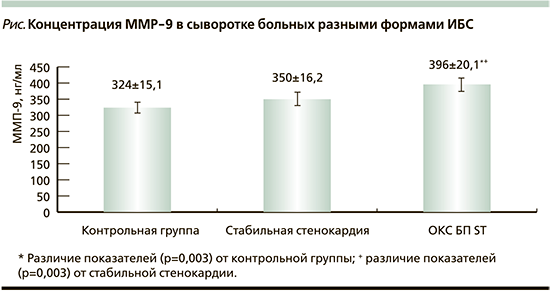
В исследовании не было выявлено различий уровня ММР-9 в сыворотке крови между пациентами со стабильной стенокардией и лицами контрольной группы (p>0,05). У больных ОКС БП ST значения ММР-9 были статистически значимо выше не только по сравнению с контрольной группой, но и с пациентами со стабильной стенокардией (см. рисунок). Повышенные концентрации ММР-9 у больных ОКС БП ST по сравнению с больными стабильной стенокардией напряжения свидетельствовали об участии данной ММР в дестабилизации течения ИБС, что подтверждается другими авторами [21]. Однако положительный опыт применения статинов с целью уменьшения продукции ММР при ОКС [22] требует изучения дозозависимых эффектов препаратов этой группы.
Так, по данным нашего исследования изменения уровней ММР-9 в сыворотке крови у больных 1-й группы до и после лечения аторвастатином в дозе 20 мг/сут в течение 4 недель были статистически недостоверными (p>0,05). Применение аторвастатина в дозе 40 мг/сут больными 2-й группы также не привело к статистически значимому снижению концентрации ММР-9 относительного ее исходного уровня (р=0,108). Между пациентами 2-й и 1-й групп уровни ММР-9 после 4-недельного лечения также статистически не различались (р=0,41). В результате лечения аторвастатином 60 мг/сут уровень ММР-9 снизился и оказался статистически значимо ниже по сравнению с его исходной величиной в 3-й группе и величинами показателя в 1-й группе после лечения (табл. 1).
Такие результаты могут свидетельствовать об определенной специфичности ММП-9 для оценки противовоспалительного эффекта аторвастатина в этой группе больных.

Наши данные служат подтверждением исследования S. Blankenberg et al., считающих ММР-9 маркером оценки эффективности лечения больных ОКС [23]. Далее оказалось, что у больных ОКС БП ST на фоне лечения аторвастатином (табл. 2) уменьшение содержания маркера эндогенного синтеза NO (нитрита) в 1-й и 2-й группах было незначительным (p>0,05) и только в 3-й группе наблюдалось статистически значимое снижение нитрита на 27,6% (p=0,012).
По показателю МДА в сыворотке крови после курсового лечения аторвастатином обнаружено его статистически значимое понижение в каждой из групп исследования: в 1-й – на 28,5% (p=0,025), во 2-й – на 23,1% (p=0,02) и наиболее выраженное (на 52%) – в 3-й (p=0,01). Положительный терапевтический эффект аторвастатина носил дозозависимый характер не только на прооксидантные (МДА), но и на антиоксидантные (SH-группы) маркеры. Так, концентрация SH-групп достигала статистически значимого увеличения во 2-й (на 21,4%; p=0,02) и более выраженного – в 3-й группах (на 27,2%; p=0,01). Исходя из этого, можно предположить, что гуморальные показатели, характеризующие состояние оксидативного стресса, должны служить мишенью терапевтических воздействий [24].
Обсуждение
Таким образом, у больных ОКС БП ST повышение протеолитической активности подтверждается увеличением концентрации ММР-9. Эти изменения происходят на фоне оксидативного стресса, создающего условия как для активации синтеза индуцибельной NO, так и для его ускоренного разрушения [25, 26]. Применение аторвастатина в высоких дозах оказывает более выраженное влияние на генерацию MMP-9, что может способствовать локальному снижению воспалительного статуса в сосудах человека и специализированной терапии атеросклероза [10]. Определенная специфичность ММР-9 позволяет и впредь изучать ее для оценки противовоспалительной эффективности статинов с целью улучшения прогнозирования и результатов фармакотерапии ИБС [27, 28].
Выводы
Установлено значительное повышение концентрации ММР-9 в сыворотке крови больных ОКС БП ST, что свидетельствует об их участии в процессе дестабилизации течения ИБС.
Аторвастатин оказывает дозозависимый противовоспалительный и значимый антиоксидантный эффект у больных ОКС БП ST в дозе 60 мг/сут в течение 4-недельного лечения.
Генерацию ММР-9 можно рассматривать в качестве специфического маркера противовоспалительного действия аторвастатина при ОКС БП ST.
Вклад авторов. Концепция и дизайн исследования – В.В. Горбань, Д.Н. Калашник. Сбор и обработка материала – Д.Н. Калашник. Статистическая обработка данных – Д.Н. Калашник. Написание текста – Д.Н. Калашник, В.В. Горбань. Редактирование – В.В. Горбань.



