В настоящее время во всем мире проводится вакцинация от новой коронавирусной инфекции, вызванной SARS-CoV-2. Доля вакцинированного населения достигает в некоторых странах высоких цифр, например, на Мальте составляет 73,8%. В России доля вакцинированного населения на 02.07.2021 составила 11,98% (https://yandex.ru/covid19/stat).
Несмотря на широкое применение вакцинации во всем мире в научной литературе имеются ограниченные данные о влиянии различных видов вакцин на репродуктивную функцию человека [1–4]. Возможное негативное влияние вакцин на репродуктивные органы и ткани связывают с развитием аутоиммунного процесса с вовлечением гонад, других эндокринных органов или развитием антифосфолипидного синдрома (АФС). Также бесплодие часто является вторичным состоянием на фоне развития ревматических заболеваний в рамках синдрома ASIA. Так, у женщин при системной красной волчанке (СКВ) часто развивается аутоиммунный оофорит, и, как следствие, преждевременная недостаточность яичников, у мужчин – нарушение сперматогенеза. У трети женщин с СКВ выявляется АФС. У женщин с аутоиммунным тиреоидитом нередко нарушается менструальный цикл, развивается бесплодие, отмечается повышенный риск репродуктивных потерь [5, 6]. Индукция АФС теоретически может быть ассоциирована с вакцинацией. Например, IgM антитела, вырабатываемые после введения столбнячного анатоксина, взаимодействуют как с токсином, так и с кардиолипином, связанным с β2-гликопротеином-1 (β2-ГП-1). Кроме того, было экспериментально установлено, что введение столбнячного анатоксина вместе с адъювантами (гидроксидом алюминия или глицеролом) вызывает развитие АФС у мышей предрасположенной линии, ранее не имевших аутоиммунных заболеваний [7]. В другом исследовании было показано, что иммунизация мышей субъединичной вакциной на основе пептидов цитомегаловируса, также приводит к развитию подобного синдрома [8]. Наличия гомологии между столбнячным анатоксином или другими антигенами, использованными для вакцинации, и пептидами человека, и применения адъювантов может быть достаточно, чтобы вызвать развитие АФС, и, соответственно, нарушение функции репродуктивной системы [9].
На данный момент на стадии проведения находится несколько исследований по изучению влияния вакцинации от COVID-19 на репродуктивную функцию человека (www.clinicaltrials.gov). Опубликованы данные одного исследования, в котором не было выявлено негативного влияния вакцинации на сперматогенез у мужчин [10]. Аналогичные данные получены российскими исследователями [11]. В отношении влияния вакцинации от COVID-19 на женскую репродуктивную функцию опубликованы данные единственного исследования, в котором не было выявлено негативного влияния вакцинации на исходы программ вспомогательных репродуктивных технологий [12]. В связи с важностью и малой изученностью проблемы исследование влияния вакцины от COVID-19 на репродуктивную функцию у женщин является чрезвычайно актуальным. Поскольку из всех отечественных вакцин только вакцина Гам-КОВИД-Вак (Спутник V) прошла все стадии клинических испытаний, именно эта вакцина была выбрана для изучения влияния на овариальный резерв у женщин [13].
Целью исследования было оценить влияние вакцины Гам-КОВИД-Вак (Спутник V) на овариальный резерв и уровень антифосфолипидных антител у женщин репродуктивного возраста.
Материалы и методы
В проспективное исследование была включена 51 женщина, которой была проведена вакцинация от SARS-CoV-2, вакциной Гам-КОВИД-Вак (Спутник V). Критериями включения в исследование были возраст от 18 до 45 лет, сохраненная менструальная функция, нормальный овариальный резерв, отсутствие в анамнезе COVID-19, отрицательный результат исследования на SARS-CoV-2 методом ПЦР и отрицательные результаты тестов на IgG антитела к SARS-CoV-2 перед вакцинацией. Критериями невключения были противопоказания к вакцинации согласно инструкции, беременность и период лактации, онкологические заболевания любой локализации, ревматические и аутоиммунные заболевания, туберкулез, хронические системные инфекции, отягощенный аллергологический анамнез, проводимая гормональная терапия, в том числе гормональная контрацепция, и любая вакцинация за 30 дней до включения в исследование, лечение иммуноглобулинами и иммуномодулирующими препаратами за 3 месяца до включения в исследование. Критериями исключения были заболевание COVID-19 в период вакцинации, серьезная нежелательная реакция, требующая отмены ввода 2-й дозы вакцины, отказ пациентки от дальнейшей вакцинации.
Обследование пациенток проводилось дважды – непосредственно перед вакцинацией и через 90 дней после введения 1-го компонента вакцины: проводился осмотр врача акушера-гинеколога, взятие крови на 2–5-й день менструального цикла, ультразвуковое исследование (УЗИ) органов малого таза на 5–7-й день менструального цикла с оценкой количества антральных фолликулов (КАФ).
Определение концентрации фолликулостимулирующего гормона (ФСГ), антимюллерова гормона (АМГ) и эстрадиола выполнялось в сыворотке крови электрохемилюминесцентным методом на автоматическом иммунохимическом анализаторе «Cobas е411» (Roche Diagnostics GmbH, Германия) с использованием коммерческих наборов данного производителя. Определение концентрации тиреотропного гормона (ТТГ) выполнялось в сыворотке крови иммунохемилюминесцентным методом на автоматическом иммунохимическом анализаторе «IMMULITE 2000» (Siemens, США). Исследование сыворотки крови на антифосфолипидные антитела (АФА) классов M и G: к кардиолипину (аКЛ), β2-гликопротеину-1 (аβ2-ГП-1), аннексину V (аАн V), фосфатидилсерину (аФС), выполнялось с помощью иммуноферментного анализа с использованием наборов «ORGENTEC Diagnostika» (Германия). Также проводилось определение антител класса IgG к SARS-CoV-2 в сыворотке крови с помощью иммуноферментного анализа с использованием тест-системы «Набор реагентов для выявления антител класса G к spike белку SARS-CoV-2 методом иммуноферментного анализа» (НПО «Диагностические системы», Россия). Измерение результатов производилось на спектрофотометре «Infinite F50» (TECAN, США).
Овариальный резерв у женщин оценивался на основании определения АМГ, ФСГ и КАФ. Овариальный резерв считали нормальным при уровне АМГ≥1,2 нг/мл, уровне ФСГ<12 МЕ/л, КАФ≥ 5 фолликулов в обоих яичниках [14].
Статистический анализ
Для статистического анализа использовался пакет статистических программ Statistica 10 (США). Данные были представлены абсолютными показателям и % для категориальных данных, медианами (с интерквартильным размахом, 25%–75%) для количественных данных. Сравнение данных проводилось методами попарного тестирования - с применением парного t-критерия Вилкоксона для связанных выборок в виду ненормального распределения данных для всех величин. Нормальность распределения данных оценивалась с использованием критерия Шапиро–Уилка. Корреляционный анализ проводили с использованием критерия Спирмена. Различия между статистическими величинами считали статистически значимыми при р<0,05.
Исследование было одобрено комиссией по этике ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России.
Результаты
Возраст женщин составил 31,0 (26,0–36,0) лет, индекс массы тела (ИМТ) – 22,7 (19,4–25,5) кг/м2.
При оценке клинико-анамнестических данных было выявлено, что заболеваемость пациенток была низкая: 4 (7,8%) женщины указали на наличие эндометриоза, 4 (7,8%) – миомы матки, 2 (3,9%) – полипов эндометрия, 2 (3,9%) – синдрома поликистозных яичников (СПКЯ), 7 (12,9%) – доброкачественных заболеваний шейки матки, 12 (23,5%) – хронического тонзиллита,12 (23,5%) – хронического гастрита, 3 (5,9%) – хронического цистита, 4 (7,8%) – полиноза.
Вакцинация в целом переносилась пациентками хорошо, не было отмечено серьезных нежелательных явлений на введение вакцины. Реакция на введение вакцины чаще отмечалась после введения 2-го компонента и была кратковременной (1–2 дня). У 34 (66,7%) женщин отмечалась местная реакция в месте введения вакцины, у 39 (76,5%) – субфебрильная температура, у 6 (11,7%) – фебрильная температура, у 23 (45,1%) – симптомы интоксикации в виде головной боли и/или миалгии. 3 (5,9%) женщины не отметили у себя каких-либо реакций на введение вакцины.
Специфические IgG антитела к SARS-CoV-2 были выявлены у всех вакцинированных пациенток, и только у одной пациентки (1,9%) их уровень не достиг порогового значения позитивности.
При сравнении средних параметров гормонального профиля и КАФ не было отмечено значимого изменения уровня гормонов и КАФ до и после вакцинации (таблица).
При сравнении динамики изменения уровня АМГ, ФСГ и КАФ у пациенток позднего репродуктивного возраста (ПРВ) (≥37 лет, n=11) по сравнению с пациентками раннего репродуктивного возраста (РРВ) (<37 лет, n=40) не было выявлено значимой разницы. Дельта уровня АМГ в группе ПРВ составила 0,10 (-0,24–0,50) нг/мл, в группе РРВ – 0,07 (-0,19–0,55) (р>0,05). Дельта уровня ФСГ в группе ПРВ составила (-0,30) (-1,80–0,90) МЕ/л, в группе РРВ (-0,15) (-0,77–1,20) МЕ/мл (р>0,05).
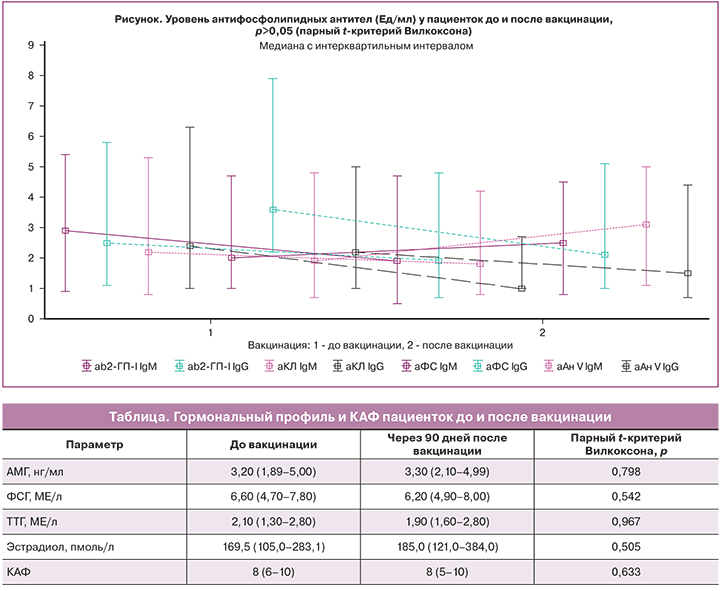
Далее был проанализирован уровень АФА до и после вакцинации (рисунок). Наблюдалось незначительное снижение уровня а-β2-ГП-I IgM, аКЛ IgG, аФС IgG и аАн V IgG и повышение аАн V IgM после вакцинации по сравнению с исходными значениями. При этом почти у всех пациенток уровень АФА не превысил референсные значения. Повышение АФА за пределы референсных значений наблюдалось только у 3 (5,9%) женщин.
Для анализа изменения овариального резерва в зависимости от уровня АФА был проведен корреляционный анализ зависимости изменения уровня АМГ, ФСГ и АФА, в результате которого не было выявлено значимых корреляционных связей (р>0,05).
На сегодняшний день отсутствуют данные по влиянию вакцины на овариальную функцию у женщин. Вместе с тем, опубликованы исследования, указывающие на возможное негативное влияние перенесенного заболевания COVID-19 на репродуктивную функцию. Так, в ряде работ выявлена широкая представленность рецепторов SARS-CoV-2 (ангиотензин превращающего фермента (ACE2), трансмембранной сериновой протеазы 2 (TMPRSS2), CD147 (басигина)) в репродуктивных органах и тканях человека [15–19]. В исследовании китайских коллег при проведении многомерного иерархического линейного регрессионного анализа показано, что заболевание COVID-19 было значимо ассоциировано со снижением уровня АМГ (β=-0,191; 95% ДИ: -1,177–0,327; р=0,001), что свидетельствует о том, что заболевание COVID-19 может быть причиной снижения функции яичников [20].
Заключение
Настоящее исследование является первым, посвященным изучению влияния отечественной вакцины Гам-КОВИД-Вак на овариальную функцию и уровень АФА, как маркера аутоиммунных процессов, у женщин. Все пациентки, включенные в исследование, имели нормальный овариальный резерв и не имели серьезных соматических заболеваний. У них также были исключены все факторы, которые могли бы как-то повлиять на избыточный аутоиммунный ответ.
Полученные данные свидетельствуют о том, что вакцина Гам-КОВИД-Вак не оказывает негативного влияния на овариальный резерв у женщин, в том числе у пациенток позднего репродуктивного возраста. Кроме того, не отмечается повышение уровня АФА, а также связи изменения уровня ФСГ, АМГ и АФА, что косвенно свидетельствует об отсутствии изменения репродуктивной функции аутоиммунного генеза под влиянием вакцины. Данное исследование продолжается, объем исследуемой группы в общей сложности составит 200 женщин.



