ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России, Москва, Россия
Актуальность. В период пандемии и масштабной вакцинации от COVID-19 особо важное значение приобретают исследования влияния различных видов вакцин на репродуктивную функцию человека. Предполагается возможность негативного воздействия вакцинации на репродуктивные органы и ткани в результате развития аутоиммунного процесса, вовлекающего гонады. В настоящее время проводятся исследования по влиянию вакцинации от коронавирусной инфекции, вызванной SARS-CoV2, на репродуктивную функцию мужчин и женщин. Опубликованы результаты трех исследований, в которых не было выявлено негативного влияния вакцинации на сперматогенез у мужчин.
Цель. Оценить влияние вакцины Гам-КОВИД-Вак (Спутник V) на сперматогенез, гормональный профиль и уровень антифосфолипидных антител у мужчин.
Материалы и методы. В проспективное исследование было включено 45 мужчин, которым была проведена вакцинация от COVID-19 вакциной Гам-КОВИД-Вак (Спутник V). Критериями включения в исследование были возраст от 18 до 55 лет, отсутствие в анамнезе заболевания COVID-19, отрицательный результат исследования на SARS-CoV-2 методом ПЦР и отрицательные результаты тестов на IgG-антитела к SARS-CoV-2 перед вакцинацией, отсутствие тяжелых соматических заболеваний. Обследование пациентов проводилось дважды – непосредственно перед вакцинацией и через 90 дней после введения 1-го компонента вакцины. Оценивалась спермограмма, проводилось определение уровня ФСГ, ЛГ, ТТГ и тестостерона общего, исследование крови с помощью иммуноферментного анализа на антифосфолипидные антитела (АФА) классов M и G к кардиолипину (аКЛ), β2-гликопротеину-1 (аβ2-ГП-1), аннексину V (аАн V), фосфатидилсерину (аФС), а также на IgG-антитела к SARS-CoV-2.
Результаты. Не было отмечено значимого изменения параметров спермограммы и уровня гормонов до и после вакцинации, в том числе у мужчин с умеренной патоспермией (олигоастено- и/или тератозооспермией). Уровень АФА после вакцинации не повышался по сравнению с исходным уровнем. Также не было отмечено связи динамики уровня антиспермальных антител, АФА и параметров спермограммы, что косвенно свидетельствует об отсутствии изменений репродуктивной функции, связанных с этим аутоиммунным фактором, после вакцинации у мужчин.
Заключение. Проведенное исследование является одним из первых, посвященных изучению влияния отечественной вакцины Гам-КОВИД-Вак на сперматогенез, гормональный профиль и уровень АФА у мужчин. Полученные результаты свидетельствуют о том, что применение вакцины Гам-КОВИД-Вак не оказывает негативного влияния на репродуктивную функцию у мужчин.
векторная вакцина
COVID-19
SARS-CoV-2
Гам-КОВИД-Вак (Спутник V)
сперматогенез
тестостерон
аутоиммунные состояния
антифосфолипидные антитела
Одним из эффективных способов профилактики новой коронавирусной инфекции SARS-CoV-2 является вакцинация. В 2020 г. была зарегистрирована вакцина Гам-Ковид-Вак, содержащая фрагмент генетического материала SARS-CoV-2 [1]. В настоящее время во всем мире проводится вакцинация от новой коронавирусной инфекции SARS-CoV-2, однако доля вакцинированных людей в разных странах колеблется от 75,6% (Мальта) до 0,01% (Уганда). В России на 05.07.2021 доля вакцинированного населения составила 12,19% (https://yandex.ru/covid19/stat). Несмотря на доказанную высокую эффективность вакцины Гам-Ковид-Вак в отношении профилактики тяжелых форм новой коронавирусной инфекции, у многих мужчин вызывает опасение возможное влияние вакцинации на репродуктивное здоровье. Одной из причин, послужившей началом изучения влияния вакцины Гам-Ковид-Вак на репродуктивное здоровье, выступает возможное влияние вакцинации на развитие аутоиммунных заболеваний с вовлечением гонад [2–4].
За все время вакцинации в литературе накоплено мало данных о влиянии различных видов вакцин на репродуктивную функцию человека [5–7]. Вакцина Гам-Ковид-Вак является комбинированной векторной вакциной, в основе которой использован аденовирусный вектор. В работе Talotta et al., опубликованной в 2021 г., было сделано предположение о том, что вакцины на основе аденовирусных векторов могут вызывать нарушения регуляции синтеза интерферонов (ИФН) типа I [8]. Изменения синтеза ИФН типа I теоретически могут приводить к иммуновоспалительным ревматическим заболеваниям, среди которых следует выделить системную красную волчанку (СКВ), антифосфолипидный синдром (АФС) и ревматоидный артрит (РА) [9].
Согласно результатам мета-анализа Bin Wang et al. (2017), включающего 16 обсервационных исследований, вакцинация повышает риск развития СКВ и РА [10]. Кроме этого, было экспериментально установлено, что введение столбнячного анатоксина вместе с адъювантами у предрасположенной линии мышей сопровождалось развитием АФС [11, 12]. Потенциальное влияние вакцинации на развитие иммуновоспалительных ревматических заболеваний и, как следствие, на репродуктивное здоровье мужчин, позволяет по-новому взглянуть на патогенез аутоиммунных реакций, развивающихся у предрасположенных лиц в ответ на введение в организм веществ-адъювантов (ASIA-синдром). На данный момент на стадии проведения находится несколько исследований по влиянию вакцинации от SARS-CoV2 на репродуктивную функцию человека (www.clinicaltrials.gov). Результаты недавно опубликованных единичных исследований не показали негативного влияния вакцинации на сперматогенез у мужчин [13–15]. В связи с этим изучение влияния вакцины от COVID-19 на репродуктивную функцию у мужчин является актуальным научным исследованием. Поскольку из всех отечественных вакцин только вакцина Гам-КОВИД-Вак (Спутник V) прошла все стадии клинических испытаний, она была взята для изучения влияния на сперматогенез у мужчин [16].
Целью исследования было оценить влияние вакцины Гам-КОВИД-Вак (Спутник V) на сперматогенез, гормональный профиль и уровень антифосфолипидных антител у мужчин.
Материалы и методы
В проспективное исследование было включено 45 мужчин, которым была проведена вакцинация от инфекции, вызываемой SARS-CoV-2, вакциной Гам-КОВИД-Вак (Спутник V). Критериями включения в исследование были возраст от 18 до 55 лет, нормальные или субнормальные параметры спермограммы перед вакцинацией, отсутствие в анамнезе COVID-19, отрицательный результат исследования на SARS-CoV-2 методом ПЦР и отрицательные результаты тестов на IgG антитела к SARS-CoV-2 перед вакцинацией. Критериями невключения были противопоказания к вакцинации согласно инструкции, онкологические заболевания любой локализации, ревматические и аутоиммунные заболевания, туберкулез, хронические системные инфекции, отягощенный аллергологический анамнез, проводимая гормональная терапия и любая вакцинация за 30 дней до включения в исследование, лечение иммуноглобулинами и иммуномодулирующими препаратами за 3 месяца до включения в исследование. Критериями исключения были COVID-19 в период вакцинации, серьезная нежелательная реакция, требующая отмены ввода 2-й дозы вакцины, отказ пациента от дальнейшей вакцинации.
Определение концентрации лютеинизирующего гормона (ЛГ), фолликулостимулирующего гормона (ФСГ), общего тестостерона выполнялось в сыворотке крови электрохемилюминесцентным методом на автоматическом иммунохимическом анализаторе «Cobas е411» (Roche Diagnostics GmbH, Германия) с использованием коммерческих наборов данного производителя. Определение концентрации тиреотропного гормона (ТТГ) выполнялось в сыворотке крови иммунохемилюминесцентным методом на автоматическом иммунохимическом анализаторе «IMMULITE 2000» (Siemens, США). Исследование сыворотки крови на антифосфолипидные антитела (АФА) классов M и G: к кардиолипину (аКЛ), β2-гликопротеину-1 (аβ2-ГП-1), аннексину V (аАн V), фосфатидилсерину (аФС), выполнялось с помощью иммуноферментного анализа с использованием наборов «ORGENTEC Diagnostika» (Германия). Также проводилось определение антител класса IgG к SARS-CoV-2 в сыворотке крови с помощью иммуноферментного анализа с использованием тест-системы «Набор реагентов для выявления антител класса G к spike белку SARS-CoV-2 методом иммуноферментного анализа» (НПО «Диагностические системы», Россия). Измерение результатов производилось на спектрофотометре «Infinite F50» (TECAN, США).
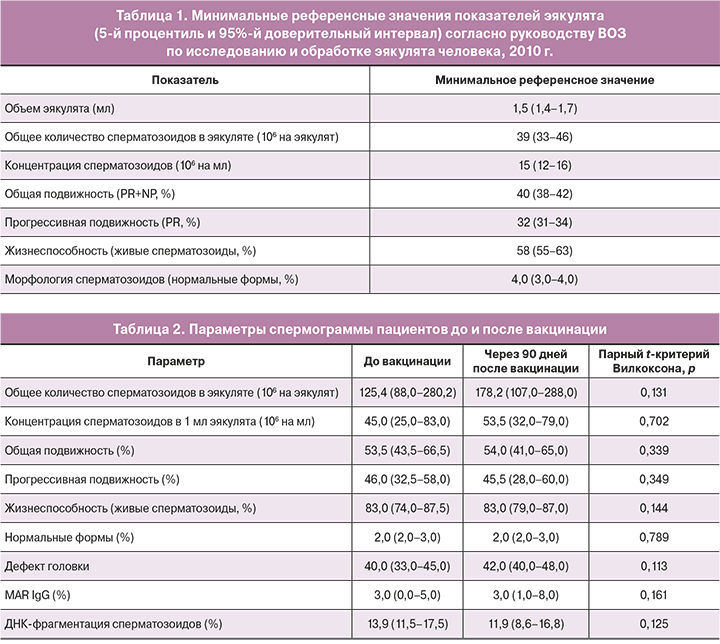
Для оценки патологии эякулята (патоспермия) руководствовались референсными значениями показателей эякулята, согласно лабораторному руководству ВОЗ [17] (табл. 1).
Критериями патоспермии считали:
- олигозооспермия – снижение концентрации сперматозоидов ниже <15 млн/мл;
- астенозооспермия – снижение подвижности сперматозоидов ниже нормальных значений (общая подвижность <40%, сперматозоиды с прогрессивным движением <32%);
- тератозооспермия – повышение количества сперматозоидов с аномальной морфологией (>96%).
Дополнительно проводили количественное определение антиспермальных антител IgG с использованием латексных частиц на поверхности сперматозоидов (норма ≤ 50%) и определение ДНК-фрагментации сперматозоидов методом TUNEL (норма <15%).
Статистический анализ
Для статистического анализа использовался пакет статистических программ Statistica 10 (США). Данные были представлены абсолютными показателям и % для категориальных данных, медианами (с интерквартильным размахом) для количественных данных. Сравнение медиан проводилось методами попарного тестирования – с применением парного t-критерия Вилкоксона для связанных выборок в виду ненормального распределения данных для всех величин. Нормальность распределения данных оценивалась с использованием критерия Шапиро–Уилка. Корреляционный анализ проводили с использованием критерия Спирмена. Различия между статистическими величинами считали статистически значимыми при р<0,05.
Исследование было одобрено комиссией по этике ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России.
Результаты
Возраст мужчин составил 36,0 (30,0–44,0) лет, индекс массы тела (ИМТ) – 25,9 (23,5–28,7) кг/м2.
При оценке клинико-анамнестических данных было выявлено, что заболеваемость пациентов была низкая и была представлена бронхиальной астмой – у 2 (4,4%), артериальной гипертонией – у 1 (2,2%), хроническим тонзиллитом – у 2 (4,4%), хроническим гастритом – у 3 (6,7%), хроническим простатитом – у 3 (6,7%), полинозом – у 3 (6,7%) мужчин.
Вакцинация в целом переносилась пациентами хорошо, не было отмечено серьезных нежелательных явлений на введение вакцины. Реакция на ведение вакцины чаще отмечались после 2-го компонента и была кратковременной (1–2 дня). У 7 (15,5%) пациентов отмечалась местная реакция в месте введения вакцины, у 43 (95,5%) – субфебрильная температура, у 13 (28,9%) – симптомы интоксикации в виде головной боли и/или миалгии.
Специфические антитела к SARS-CoV-2 IgG были выявлены почти у всех вакцинированных пациентов, только у 3 (6,7%) пациентов их уровень не достиг порогового значения позитивности.
При сравнении средних параметров спермограммы до и после вакцинации не было получено значимых отличий, включая уровень антиспермальных антител класса G и ДНК-фрагментацию сперматозоидов (табл. 2).

При сравнении динамики параметров спермограммы до и после вакцинации у мужчин с патоспермией (n=17) по сравнению с мужчинами с нормоспермией (n=28) не было выявлено значимой разницы. Дельта концентрации сперматозоидов в 1 мл эякулята у пациентов с патоспермией составила 0,5 (-19,0–8,7), с нормоспермией – 7,0 (-11,0–29,0) (р>0,05). Дельта общей подвижности сперматозоидов у пациентов с патоспермией составила –3,0 (-5,0–1,0)%, с нормоспермией – 3,0 (-5,0–1,0)% (р>0,05). Дельта числа нормальных форм сперматозоидов у пациентов с патоспермией составила 0,0 (0,0–0,0), с нормоспермией – 0,0 (0,0 – 0,0) (р>0,05). Лейкоцитоспермии с концентрацией лейкоцитов более 1 млн/мл не наблюдалось ни у одного пациента как до, так и после вакцинации. При сравнении средних параметров гормонального профиля до и после вакцинации также не было получено значимых отличий показателей (табл. 3).
 Далее был проанализирован уровень АФА до и после вакцинации (рисунок). Наблюдалось незначимое снижение уровня а-β2-ГП-I IgG, аКЛ IgM и аФС IgG после вакцинации по сравнению с исходными значениями. При этом уровень АФА у всех пациентов не превысил референсные значения.
Далее был проанализирован уровень АФА до и после вакцинации (рисунок). Наблюдалось незначимое снижение уровня а-β2-ГП-I IgG, аКЛ IgM и аФС IgG после вакцинации по сравнению с исходными значениями. При этом уровень АФА у всех пациентов не превысил референсные значения.
Был проведен корреляционный анализ зависимости изменения параметров спермограммы (общее количество сперматозоидов, общая подвижность сперматозоидов, жизнеспособность, процент морфологически здоровых форм, процент прогрессивно-подвижных форм) и АФА класса M и G к аКЛ, аβ2-ГП-1, аАн V и аФС, в результате которого не было выявлено значимых связей (r<0,20, р>0,05).
В отличие от отсутствия влияния вакцины на сперматогенез у мужчин, имеются данные о негативном влиянии перенесенной COVID-19 на репродуктивную функцию. Была выявлена широкая представленность рецепторов для SARS-CoV-2 (ангиотензин превращающего фермента (ACE2), трансмембранной сериновой протеазы 2 (TMPRSS2), CD147 (басигина)) в репродуктивных органах и тканях человека [18–22]. Следует подчеркнуть, что спайковый белок SARS связывается с рецептором ACE2, способствуя проникновению вируса в клетку-мишень [23]. В исследовании Haghpanah A. et al. было показано, что проникновение вируса SARS-CoV-2 в сперматогонии, клетки Лейдига, а также клетки Сертоли может приводить к изменению уровня половых гормонов, повышению ДНК фрагментации, а также к снижению подвижности сперматозоидов [24]. Опубликованные результаты других работ подтверждают негативное влияние COVID-19 на сперматогенез [25] и гормональный профиль мужчин [26]. Нельзя исключить, что взаимодействие вируса SARS-CoV-2 с рецептором ACE2 может инициировать развитие специфического эпидидимоорхита за счет формирования системного васкулита [27, 28].
Заключение
Настоящее исследование является одним из первых, в котором было проведено изучение влияния отечественной вакцины Гам-КОВИД-Вак на сперматогенез, гормональный профиль и уровень АФА у мужчин. Все пациенты, включенные в исследование, исходно имели нормальные или субнормальные показатели спермограммы и не страдали от серьезных соматических заболеваний. У них также были исключены все факторы, которые могли бы как-то повлиять на избыточный аутоиммунный ответ.
Согласно полученным предварительным данным, вакцина Гам-КОВИД-Вак не оказывает негативного влияния на сперматогенез и гормональный профиль у мужчин, в том числе у мужчин с умеренной патоспермией (олигоастено- и/или тератозооспермией). Кроме того, вакцинация не вызывает повышения уровня АФА, а также антиспермальных антител (MAR), что косвенно может свидетельствовать об отсутствии изменений репродуктивной функции аутоиммунного генеза под влиянием вакцины. Исследование будет продолжено с включением в исследуемую группу 200 мужчин.
- Минздрав России зарегистрировал первую в мире вакцину от COVID-19. Министерство здравоохранения Российской Федерации11.08.2020. Дата обращения: 11 августа 2020 г. Архивировано 12 августа 2020 г.
- Перминова С.Г. Бесплодие у женщин с аутоиммунной патологией щитовидной железы. Медицинский совет. 2012; 7: 40-4.
- Toussirot É., Bereau M. Vaccination and induction of autoimmune diseases. Inflamm. Allergy Drug Targets. 2015; 14(2): 94-8. https://dx.doi.org/10.2174/1871528114666160105113046.
- Зайцевская С.А., Долгушина Н.В., Сухих Г.Т. Влияние вакцин на репродуктивную систему. Акушерство и гинекология. 2020; 9: 5-10. https://dx.doi.org/10.18565/aig.2020.9.5-10.
- Wacholder S., Chen B.E., Wilcox A., Macones G., Gonzalez P., Befano B. et al. Risk of miscarriage with bivalent vaccine against human papillomavirus (HPV) types 16 and 18: pooled analysis of two randomised controlled trials. BMJ. 2010; 340: c712. https://dx.doi.org/10.1136/bmj.c712.
- Panagiotou O.A., Befano B.L., Gonzalez P., Rodríguez A.C., Herrero R., Schiller J.T. et al. Effect of bivalent human papillomavirus vaccination on pregnancy outcomes: long term observational follow-up in the Costa Rica HPV vaccine trial. BMJ. 2015; 351: h4358. https://dx.doi.org/10.1136/bmj.h4358.
- Wiesen A.R., Littell C.T. Relationship between prepregnancy anthrax vaccination and pregnancy and birth outcomes among US army women. JAMA. 2002; 287(12): 1556-60. https://dx.doi.org/10.1001/jama.287.12.1556.
- Talotta R., Robertson E.S. Antiphospholipid antibodies and risk of post-COVID-19 vaccination thrombophilia: The straw that breaks the camel's back? Cytokine Growth Factor Rev. 2021; 60: 52-60. https://dx.doi.org/10.1016/j.cytogfr.2021.05.001.
- Насонов Е.Л., Авдеева А.С. Иммуновоспалительные ревматические заболевания, связанные с интерфероном типа I: новые данные. Научно-практическая ревматология. 2019; 55(4): 452-61.
- Wang B., Shao X., Wang D., Xu D., Zhang J.A. Vaccinations and risk of systemic lupus erythematosus and rheumatoid arthritis: A systematic review and meta-analysis. Autoimmun. Rev. 2017; 16(7): 756-65. https://dx.doi.org/10.1016/j.autrev.2017.05.012.
- Zivkovic I., Stojanovic M., Petrusic V., Inic-Kanada A., Dimitrijevic L. Induction of APS after TTd hyper-immunization has a different outcome in BALB/c and C57BL/6 mice. Am. J. Reprod. Immunol. 2011; 65(5): 492-502. https://dx.doi.org/10.1111/j.1600-0897.2010.00922.x.
- Cruz-Tapias P., Blank M., Anaya J.M., Shoenfeld Y. Infections and vaccines in the etiology of antiphospholipid syndrome. Curr. Opin. Rheumatol. 2012; 24(4): 389-93. https://dx.doi.org/10.1097/BOR.0b013e32835448b8.
- Safrai M., Reubinoff B., Ben-Meir A. BNT162b2 mRNA Covid-19 vaccine does not impair sperm parameters. medRxiv preprint. May, 2021. https://dx.doi.org/10.1101/2021.04.30.21255690.
- Елагин В.В., Адамян Л.В., Вечорко В.И., Дорошенко Д.А., Дашко А.А., Филиппов О.С., Степанян А.А., Медведева И.В. Вакцинация против COVID-19 и репродуктивное здоровье мужчин (предварительные данные). Проблемы репродукции. 2021; 27(4). https://dx.doi.org/10.17116/repro2021270410.
- Gonzalez D.C., Nassau D.E., Khodamoradi K., Ibrahim E., Blachman-Braun R., Ory J., Ramasamy R. Sperm parameters before and after COVID-19 mRNA vaccination. JAMA. 2021 Jun 17. https://dx.doi.org/10.1001/jama.2021.9976. Online ahead of print.
- Logunov D.Y., Dolzhikova I. V, Shcheblyakov D. V, Tukhvatulin A.I., Zubkova O.V., Dzharullaeva A.S. et al. Safety and efficacy of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine: an interim analysis of a randomised controlled phase 3 trial in Russia. Lancet. 2021; 397(10275): 671-81. https://dx.doi.org/10.1016/S0140-6736(21)00234-8.
- World Health Organization. WHO laboratory manual for the examination and processing of human semen. 5th ed. 2010. 287p.
- Li M.Y., Li L., Zhang Y., Wang X.S. Expression of the SARS-CoV-2 cell receptor gene ACE2 in a wide variety of human tissues. Infect. Dis. Poverty. 2020; 9(1): 45. https://dx.doi.org/10.1186/s40249-020-00662-x.
- Jing Y., Run-Qian L., Hao-Ran W., Hao-Ran C., Ya-Bin L., Yang G. et al. Potential influence of COVID-19/ACE2 on the female reproductive system. Mol. Hum. Reprod. 2020; 26(6): 367-73. https://dx.doi.org/10.1093/molehr/gaaa030.
- Smedts A.M., Lele S.M., Modesitt S.C., Curry T.E. Expression of an extracellular matrix metalloproteinase inducer (basigin) in the human ovary and ovarian endometriosis. Fertil. Steril. 2006; 86(3): 535-42. https://dx.doi.org/10.1016/j.fertnstert.2006.01.042.
- Li K., Nowak R.A. The role of basigin in reproduction. Reproduction. 2019; REP-19-0268.R1. https://dx.doi.org/10.1530/REP-19-0268.
- Долгушин Г.О., Романов А.Ю. Влияние SARS-COV-2 репродукцию человека. Акушерство и гинекология. 2020; 11: 6-12.
- Walls A.C., Park Y.J., Tortorici M.A., Wall A., McGuire A.T., Veesler D. Structure, function, and antigenicity of the SARS-CoV-2 spike glycoprotein. Cell. 2020; 181(2): 281-92. e6. https://dx.doi.org/10.1016/j.cell.2020.02.058.
- Haghpanah A., Masjedi F., Alborzi S., Hosseinpour A., Dehghani A., Malekmakan L., Roozbeh J. Potential mechanisms of SARS-CoV-2 action on male gonadal function and fertility: Current status and future prospects. Andrologia. 2021; 53(1): e13883. https://dx.doi.org/10.1111/and.13883.
- Holtmann N., Edimiris P., Andree M., Doehmen C., Baston-Buest D., Adams O., Kruessel J.S., Bielfeld A.P. Assessment of SARS-CoV-2 in human semen – a cohort study. Fertil. Steril. 2020; 114(2): 233-8. https://dx.doi.org/10.1016/j.fertnstert.2020.05.028.
- Ma L., Xie W., Li D., Shi L., Ye G., Mao Y. et al. Evaluation of sex-related hormones and semen characteristics in reproductive-aged male COVID-19 patients. J. Med. Virol. 2021; 93(1): 456-62. https://dx.doi.org/10.1002/jmv.26259.
- Xu J., Qi L., Chi X., Yang J., Wei X., Gong E. et al. Orchitis: a complication of severe acute respiratory syndrome (SARS). Biol. Reprod. 2006; 74(2): 410-6. https://dx.doi.org/10.1095/biolreprod.105.044776.
- La Marca A., Busani S., Donno V., Guaraldi G., Ligabue G., Girardis M. Testicular pain as an unusual presentation of COVID-19: a brief review of SARS-CoV-2 and the testis. Reprod. Biomed. Online. 2020; 41(5): 903-6. https://dx.doi.org/10.1016/j.rbmo.2020.07.017.
Поступила 14.07.2021
Принята в печать 20.07.2021
Драпкина Юлия Сергеевна, к.м.н., врач отделения вспомогательных репродуктивных технологий в лечении бесплодия им. профессора Б.В. Леонова,
ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России. E-mail:
julia.drapkina@gmail.com 117997, Россия, Москва, ул. Академика Опарина, д. 4.
Долгушина Наталия Витальевна, д.м.н., заместитель директора – руководитель департамента организации научной деятельности,
ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России. Тел.: +7(495)438-49-77. E-mail:
n_dolgushina@oparina4.ru.
117997, Россия, Москва, ул. Академика Опарина, д. 4.
Шатылко Тарас Валерьевич, к.м.н., врач-уролог отделения андрологии и урологии, ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России.
Тел.: +7(927)620-49-25. E-mail:
dialectic.law@gmail.com. 117997, Россия, Москва, ул. Академика Опарина, д. 4.
Николаева Марина Аркадьевна, д.м.н., в.н.с. лаборатории клинической иммунологии ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России.
Тел.: +7(495)438-11-83. E-mail:
MNikolaeva@oparina4.ru. 117997, Россия, Москва, ул. Академика Опарина, д. 4.
Менжинская Ирина Владимировна, к.м.н., с.н.с. лаборатории клинической иммунологии, ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России.
Тел.: +7(915)345-06-59. E-mail:
i_menzinskaya@oparina4.ru. 117997, Россия, Москва, ул. Академика Опарина, д. 4.
Иванец Татьяна Юрьевна, д.м.н., заведующая клинико-диагностической лабораторией, ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России.
Тел.: +7(495)438-25-66. E-mail:
t_ivanets@oparina4.ru. 117997, Россия, Москва, ул. Академика Опарина, д. 4.
Кречетова Любовь Валентиновна, д.м.н., заведующая лабораторией клинической иммунологии, ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России.
Тел.: +7(495)438-11-83.
E-mail: k_l_v_@mail.ru. 117997, Россия, Москва, ул. Академика Опарина, д. 4.
Красный Алексей Михайлович, к.б.н., заведующий лаборатории цитологии, ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России.
Тел.: +7(963)750-35-35. E-mail:
a_krasnyi@oparina4.ru. 117997, Россия, Москва, ул. Академика Опарина, д. 4.
Гамидов Сафар Исраилович, д.м.н., руководитель отделения андрологии и урологии, ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России.
Тел.: +7(963)750-30-28. E-mail:
safargamidov@yandex.ru. 117997, Россия, Москва, ул. Академика Опарина, д. 4.
Байрамова Гюльдана Рауфовна, д.м.н., заведующая по клинической работе научно-поликлинического отделения, ФГБУ «НМИЦ АГП им. В.И. Кулакова»
Минздрава России. Тел.: +7(909)994-77-00. E-mail:
g_bairamova@oparina4.ru. 117997, Россия, Москва, ул. Академика Опарина, д. 4.
Сухих Геннадий Тихонович, д.м.н., профессор, академик РАН, директор ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России.
Тел.: +7(495)438-18-00. E-mail:
secretariat@oparina4.ru. 117997, Россия, Москва, ул. Академика Опарина, д. 4.
Для цитирования: Драпкина Ю.С., Долгушина Н.В., Шатылко Т.В., Николаева М.А., Менжинская И.В., Иванец Т.Ю., Кречетова Л.В., Красный А.М., Гамидов С.И., Байрамова Г.Р., Сухих Г.Т. Вакцина Гам-КОВИД-Вак (Спутник V) не оказывает негативного влияния на сперматогенез у мужчин.
Акушерство и гинекология. 2021; 7: 88-94
https://dx.doi.org/10.18565/aig.2021.7.88-94


 Далее был проанализирован уровень АФА до и после вакцинации (рисунок). Наблюдалось незначимое снижение уровня а-β2-ГП-I IgG, аКЛ IgM и аФС IgG после вакцинации по сравнению с исходными значениями. При этом уровень АФА у всех пациентов не превысил референсные значения.
Далее был проанализирован уровень АФА до и после вакцинации (рисунок). Наблюдалось незначимое снижение уровня а-β2-ГП-I IgG, аКЛ IgM и аФС IgG после вакцинации по сравнению с исходными значениями. При этом уровень АФА у всех пациентов не превысил референсные значения.


