На протяжении нескольких десятилетий выявляются и изучаются различные штаммы коронавирусов, однако ни один из них до сих пор не приводил к столь значительным осложнениям и такой высокой летальности, как SARS-COV-2, а вызванное им заболевание не достигало масштабов пандемии. В настоящее время одним из наиболее эффективных способов первичной профилактики новой коронавирусной инфекции является вакцинация. Доля вакцинированного населения сильно различается в разных странах, например, в Объединенных Арабских Эмиратах (ОАЭ) она составляет 94,9%, а в Южном Судане – 2,7%. В России доля вакцинированного населения на 03.03.2022 составила 49,0% (https://yandex.ru/covid19/stat).
Вакцины от COVID-19, применяемые в настоящее время, классифицируются на комбинированные векторные вакцины, содержащие рекомбинантные аденовирусные частицы, содержащие ген белка S SARS-CoV-2, мРНК вакцины, однокомпонентные адъювантные пептидные вакцины и цельные инактивированные вакцины. Первой в мире зарегистрированной вакциной от COVID-19 стала вакцина Гам-КОВИД-Вак (Спутник V), одобренная 11.09.2020 Министерством здравоохранения Российской Федерации, на основании результатов I и II фазы клинических исследований. Безопасность Гам-КОВИД-Вак также была подтверждена промежуточными результатами III фазы исследований, а затем результатами мониторинга здоровья вакцинированного населения в России и в других странах (от нескольких тысяч до нескольких миллионов человек) [1].
Несмотря на широкое применение вакцинации от COVID-19 во всем мире в научной литературе имеется ограниченное количество исследований о влиянии различных видов вакцин на репродуктивное здоровье человека [2–8]. В опубликованных исследованиях не было выявлено негативного влияния вакцины от COVID-19 на репродуктивное здоровье, а также не было отмечено взаимосвязи между вакцинацией, снижением антимюллерова гормона (АМГ) или нарушением менструального цикла. Стоит отметить, что в литературе описаны данные исследований на животных моделях и единичные данные клинических исследований о возможном негативном влиянии адъювантных вакцин на репродуктивную функцию через аутоиммунный генез [9–14].
В рамках данного исследования были опубликованы предварительные результаты по влиянию вакцины Гам-КОВИД-Вак на репродуктивную функцию у женщин. В проспективное исследование были включены 51 женщины, которым была проведена вакцинация от COVID-19 вакциной Гам-КОВИД-Вак (Спутник V). Результаты исследования на данной выборке пациенток не показали негативного влияния вакцинации на показатели овариального резерва [8].
Учитывая, что изучение влияния вакцинации от COVID-19 на репродуктивное здоровье является важным вопросом, требующим понимания, обсуждения и выработки адекватных и полезных практических рекомендаций, на первом этапе было решено проанализировать влияние вакцины Гам-КОВИД-Вак на показатели гормонального профиля, отражающие состояние овариального резерва, и количество антральных фолликулов (КАФ).
Таким образом, цель данного исследования заключалась в оценке влияния комбинированной векторной вакцины для профилактики новой коронавирусной инфекции, вызываемой SARS-CoV-2, на показатели овариального резерва и менструальную функцию у женщин репродуктивного возраста.
Материалы и методы
В проспективное интервенционное исследование было включено 250 женщин, которым была проведена иммунизация Гам-КОВИД-Вак – комбинированной векторной вакциной для профилактики новой коронавирусной инфекции, вызываемой SARS-CoV-2. Из 250 женщин 30 не пришли на повторное обследование (точка 2). Таким образом, полное обследование было сделано у 220 (88%) женщин. Все пациентки, включенные в исследование, подписали информированное добровольное согласие на участие. Критериями включения в исследование были возраст от 18 до 49 лет, сохраненная менструальная функция, отрицательный результат исследования на РНК SARS-CoV-2 методом ПЦР и отрицательные результаты тестов на антитела IgМ и IgG к SARS-CoV-2 (перед вакцинацией), отсутствие в анамнезе заболевания COVID-19, отсутствие контакта с заболевшими COVID-19 в течение не менее 14 дней со слов пациентки до начала исследования. Критериями невключения были противопоказания к вакцинации согласно инструкции к препарату, беременность и период лактации, острые воспалительные и инфекционные заболевания, ревматические болезни, онкологические заболевания любой локализации, гормональная терапия, влияющая на менструальный цикл, иммуномодулирующая терапия, вакцинация в течение 3 месяцев до включения в исследование. В исследование не были включены женщины с выраженным снижением овариального резерва (ФСГ>12 мМЕ/мл и КАФ<6 в обоих яичниках), а также пациентки с морбидным ожирением (индекс массы тела (ИМТ)≥40,0 кг/м2). Критериями исключения были COVID-19 в период вакцинации, серьезное побочное проявление после иммунизации (ПППИ), требующее отмены ввода 2-го компонента вакцины, отказ пациентки от дальнейшей вакцинации.
Обследование пациенток проводилось дважды – перед вакцинацией и через 90–100 дней после введения 1-го компонента вакцины: проводился осмотр врачом акушером-гинекологом, взятие крови на 2–5-й день менструального цикла, ультразвуковое исследование (УЗИ) органов малого таза с оценкой КАФ. Всем пациенткам до начала исследования был проведен анализ крови на бета-субъединицу хорионического гонадотропина человека (β-ΧГ), положительный результат соответствовал уровню β-ХГ более 35 ΜЕ/л.
На 2–5-й день менструального цикла был проведен анализ уровня фолликулостимулирующего гормона (ФСГ), АМГ и эстрадиола (Е2) в сыворотке крови с помощью электрохемилюминесцентного метода. Состояние овариального резерва у женщин оценивалось на основании определения уровня АМГ, ФСГ и КАФ. Овариальный резерв считали нормальным при уровне АМГ≥1,2 нг/мл, уровне ФСГ<12 МЕ/л, КАФ≥5 фолликулов в обоих яичниках.
Идентификация SARS-CoV-2 в мазке из ротоглотки проводилась методом обратной транскрипции и полимеразной цепной реакции в режиме реального времени (ОТ-ПЦР).
До вакцинации определение антител классов IgМ и IgG к SARS-CoV-2 проводили с помощью иммунохроматографического метода. Через 90–100 дней после вакцинации у пациенток, включенных в исследование, была выполнена количественная оценка уровня антител класса IgG к SARS-CoV-2 с помощью иммуноферментного анализа.
Вакцинация проводилась в специально оборудованном прививочном кабинете. Перед каждым этапом вакцинации все участницы исследования были осмотрены врачом, им была выполнена термометрия, измерение сатурации, частоты сердечных сокращений (ЧСС), артериального давления (АД), проведена аускультация дыхательной и сердечно-сосудистой системы, а также осмотр зева. Подготовка вакцины к использованию осуществлялась в строгом соответствии с официальной инструкцией к препарату.
Исследование было одобрено комиссией по этике биомедицинских исследований ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России.
Статистический анализ
Статистическая обработка полученных данных осуществлялась с помощью таблиц Microsoft Excel и пакета статистической программы Statistica V10 (США). Для оценки качественных данных вычислялись доли (%). Для сравнения связанных бинарных данных в одной группе пациентов до и после вакцинации использовался критерий Мак-Немара. Для анализа количественных данных в группах сравнения определялся вид распределения данных (тест Колмогорова–Смирнова, графический анализ данных). Так как данные были распределены ненормально, то применялись методы непараметрической статистики: определялись медианы с интерквартильным размахом (Mе(Q25–Q75)), критерий знаков для сравнения связанных непараметрических данных в связанных совокупностях. Различия между статистическими величинами считались статистически значимыми при уровне значимости p<0,05.
Результаты
Средний возраст пациенток, включенных в исследование, составил 33 года, при этом 1/3 пациенток были позднего репродуктивного возраста (≥37 лет). Средний ИМТ составил 22,4 кг/м2. Все включенные в исследование пациентки соответствовали критериям включения, распространенность вредных привычек была невысокой, распространенность гинекологических заболеваний не превышала 10%, из соматических заболеваний наиболее часто встречались аллергические заболевания (табл. 1).

Вакцинация переносилась пациентками хорошо, не было отмечено ни одного серьезного ПППИ. Реакция на введение вакцины чаще отмечалась после введения 2-го компонента и была кратковременной (1–2 дня).
Специфические IgG антитела к SARS-CoV-2 были выявлены у 98,6% вакцинированных женщин.
Овариальный резерв пациенток был проанализирован дважды – до вакцинации и через 90–100 дней после введения 1-го компонента вакцины (табл. 2). Величина КАФ была преобразована в категориальную величину, где 3 – КАФ>15 в обоих яичниках (избыточный овариальный резерв), 2 – КАФ=5–15 в обоих яичниках (нормальный овариальный резерв), 1 – КАФ<5 в обоих яичниках (сниженный овариальный резерв). Также овариальный резерв был проанализирован отдельно у пациенток позднего (≥37 лет) (ПРВ) и раннего (<37 лет) (РРВ) репродуктивного возраста (табл. 3, 4).
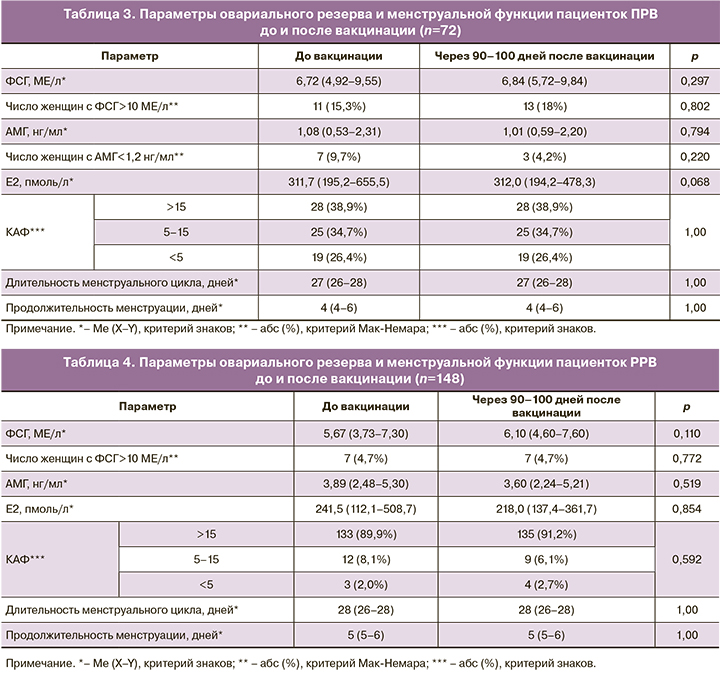
Не отмечалось значимых изменений гормональных параметров и КАФ у наблюдаемых пациенток. Средние значения с интерквартильным размахом всех исследуемых гормонов были в пределах референсных значений (РЗ), а число пациенток с повышением уровня ФСГ выше РЗ и снижением уровня АМГ ниже РЗ не отличалось до и после вакцинации как в общей группе, так и в подгруппах ПРВ и РРВ. Снижение уровня АМГ ниже РЗ отмечалось только у пациенток ПРВ в большей степени до, чем после вакцинации.
При более детальном анализе изменения параметров овариального резерва было выявлено, что после вакцинации уменьшение КАФ было отмечено только у 1 (0,4%) пациентки.
Увеличение уровня ФСГ более чем на 30% (негативный тренд) отмечался у 52/220 (23,6%) пациенток, из них у 21/52 (9,5%) женщин ПРВ и у 31/52 (14,1%) женщин РРВ. Снижение уровня ФСГ более чем на 30% (позитивный тренд) отмечалось у 38/220 (17,3%) пациенток, из них у 12/38 (5,4%) женщин ПРВ и у 26/38 (11,9%) женщин РРВ. Снижение уровня АМГ более чем на 30% (негативный тренд) отмечалось у 27/220 (12,3%) пациенток, из них у 15/27 (6,8%) женщин ПРВ и у 12/27 (5,5%) женщин РРВ. Повышение уровня АМГ более чем на 30% (позитивный тренд) отмечалось у 35/220 (15,9%) пациенток, из них у 20/35 (9,1%) женщин ПРВ и у 15/35 (6,8%) женщин РРВ.
У 30/220 (13,6%) пациенток отмечалось одновременное повышение уровня ФСГ и снижение уровня АМГ (негативный тренд), но только у 6/220 (2,7%) – одновременное повышение уровня ФСГ и снижение уровня АМГ больше чем на 30%. Все 6 пациенток находились в ПРВ. У 28/220 (12,7%) пациенток отмечалось одновременное снижение уровня ФСГ и повышение уровня АМГ (позитивный тренд), у 9/220 (4,1%) – одновременное снижение уровня ФСГ и повышение уровня АМГ больше чем на 30%. Из этих 9 пациенток 6 (2,7%) женщин находились в ПРВ.
Таким образом, вакцинация не оказывала негативный эффект на овариальный резерв пациенток. В группе вакцинированных отмечалась незначительная доля женщин как с ухудшением гормональных параметров, отражающих овариальный резерв, так и с их улучшением, примерно в равных долях. У 2,7% пациенток ПРВ (6 человек) отмечалось одновременное негативное изменение ФСГ и АМГ более чем на 30%, при этом у такой же доли женщин ПРВ отмечалось одновременное позитивное изменение ФСГ и АМГ более чем на 30%. Средний возраст этих женщин составил 44 года, что соответствует времени менопаузального перехода и вариабельности гормональной функции яичников и гипофиза. Также в исследовании не было зарегистрировано ни одного случая нарушения менструального цикла у женщин после вакцинации.
Обсуждение
Несмотря на то, что в 2021 г. в рамках данного исследования была опубликована статья, в которой было показано отсутствие влияния вакцины Гам-КОВИД-Вак на репродуктивную функцию женщин, для подтверждения полученных предварительных данных требовалось исследование на большой выборке пациентов [8]. На сегодняшний день данное исследование является первой научной работой, подтверждающей отсутствие негативного влияния отечественной комбинированной векторной вакцины Гам-КОВИД-Вак на овариальную функцию у женщин репродуктивного возраста.
При этом необходимо знать, что заболевание COVID-19 может оказывать негативное влияние на состояние репродуктивной системы у женщин. Так, в ряде работ выявлена широкая представленность рецепторов SARS-CoV-2 (ангиотензин превращающего фермента (ACE2), трансмембранной сериновой протеазы 2 (TMPRSS2), CD147 (басигина)) в репродуктивных органах и тканях человека. Основным клеточным рецептором для S-гликопротеина SARS-CoV-2 является ACE2, который экспрессируется преимущественно пневмоцитами типа II, а также клетками эндотелия, миокарда и слизистой оболочки кишечника [15]. Было также выявлено, что данный рецептор представлен в яичниках, матке, и плаценте [16, 17]. В исследовании Ding T. et al. у пациенток, перенесших COVID-19, наблюдалось снижение овариального резерва (снижение уровня АМГ), особенно в группе женщин ПРВ [18]. Наиболее вероятно, нарушения в женской репродуктивной системе после инфицирования COVID-19 происходят в результате поражения SARS-CoV-2 ткани яичников, ооцитов и клеток эндометрия. Вышеописанные изменения могут приводить к нарушению овуляторной функции, получению инфицированных или анеуплоидных ооцитов со сниженным потенциалом к фертилизации, а также к нарушению имплантации эмбрионов [19]. Учитывая потенциальное негативное влияние COVID-19 на показатели овариального резерва, вакцинация в период коронавирусной пандемии еще раз подтверждает свою целесообразность и необходимость.
Заключение
Настоящее исследование является первым, посвященным изучению влияния отечественной комбинированной векторной вакцины Гам-КОВИД-Вак на показатели овариального резерва и менструальную функцию у женщин. Полученные данные свидетельствуют о том, что вакцина не оказывает негативного влияния на овариальный резерв у женщин, в том числе у пациенток ПРВ. Отсутствие изменений гормонального профиля, КАФ и параметров менструального цикла после проведения вакцинации у пациенток, включенных в исследование, позволяет сделать вывод об отсутствии негативного влияния Гам-КОВИД-Вак – комбинированной векторной вакцины для профилактики новой коронавирусной инфекции, вызываемой SARS-CoV-2, на показатели овариального резерва и менструальной функции у женщин.



