Введение
Негативное влияние гипер- и гипотензии на клинические исходы пациентов на программном гемодиализе (ГД) кажется очевидным, однако данные литературы по этому вопросу противоречивы и остаются постоянным предметом дискуссии [7, 16, 24]. Во многом это обусловлено отсутствием консенсуса в определении понятий гипер- и гипотензии у пациентов на диализе с позиций доказательной медицины [12]. В отсутствие полноценных контролируемых исследований текущие рекомендации базируются главным образом на больших обсервационных когортных исследованиях, в которых четко и последовательно прослеживается значимое повышение риска смерти в группах с очень высоким (>180 мм рт.ст.) и низким постдиализным АД (<110 мм рт.ст.); это дало основание группе Zager и соавт. выдвинуть гипотезу, что кривая зависимости влияния АД на выживаемость диализных пациентов имеет «U»-образный характер [26]. Многие авторы отмечают, что САД≤140 мм рт.ст. связано с более высоким риском кардиоваскулярной смерти, хотя и уменьшает выраженность гипертрофии миокарда левого желудочка, в то время как САД выше 140 мм рт.ст. снижает риск смерти [14, 23]. Другим авторам удалось убедительно продемонстрировать повышение кардиоваскулярного риска и риска смерти при повышении АД>140/90, либо среднего АД>99 мм рт.ст. [18]. Согласно текущим рекомендациям, целевые значения АД у диализных пациентов отличаются от общей популяции [10], в частности, допустимая величина преддиализного АД (140/90 мм рт.ст.) установлена выше постдиализного (130/80), что обусловлено накоплением жидкости в междиализный период [21]. Артериальное давление (АД) обычно измеряется на протяжении сеанса гемодиализа, но это измерение АД всегда адекватно отражает реальные отклонения АД от установленной нормы. Действительно, измерения, сделанные непосредственно перед диализом, обычно завышают АД, а обратное верно для АД после диализа. Таким образом, мониторинг АД вне диализа остается предпочтительным методом диагностики артериальной гипертензии (АГ) у пациентов, находящихся на программном ГД [5,7]. Можно применять как домашнее измерение АД, так и суточное амбулаторный мониторирование АД (СМАД), однако последний метод редко используется в реальной клинической практике. Полагают, что диагностика на основе домашних измерений АД более достоверна, чем до и после диализа. Длительное (двухсуточное) СМАД после процедуры ГД в середине недели может дать ценную информацию относительно ночного профиля АД, который часто изменяется у диализных больных, однако, как правило, плохо переносится [3]. Другим подходом является измерение усредненной недельной величины АД во время процедуры диализа (медианы интрадиализного АД), если обычное домашнее измерение не представляется возможным [6]. Определение гипертензии зависит от метода измерения: так, критерием гипертензии при измерении АД в домашних условиях является значение >135/85 мм рт.ст., в то время как при измерении медианы интрадиализного давления >140/90 мм рт.ст. Другим осложнением помимо АГ, требующим повышенного внимания у пациентов в ХБП-5Д, является интрадиализная гипотензия (ИГ) [8, 12, 25]. ИГ не только вызывает симптомы плохой переносимости диализной процедуры, но и может вызывать эпизоды регионарной обратимой ишемии миокарда и его сократительной способности («оглушению» миокарда), что со временем ведет к структурным и функциональным нарушениям сердца и сосудов даже в отсутствие атеросклеротического поражения коронарных артерий, а также кардиоваскулярной смертности [9]. Несмотря на то что ИГ является наиболее частым осложнением во время процедуры диализа и наблюдается примерно в 25% от всех процедур, до сих пор не существует единого определения данного понятия. Обычно под ИГ понимают либо снижение САД во время процедуры ГД на 20–30 мм рт.ст. и более, либо % снижения от исходного, а также падение САД менее некого «критического» значения (<90 либо <100 мм рт.ст.) или уменьшение среднего артериального давления на 10 мм рт.ст. [12, 25] Нередко гипотензия ведет к прерыванию процедуры и уменьшению диализного времени, что служит причиной недостижения целевого индекса диализной дозы еKT/V, недостаточной ультрафильтрации и гипергидратации, а это приводит к еще большим колебаниям АД – преддиализной гипертензии, назначению комбинированной антигипертензивной терапии и падению давления в ходе процедуры [11, 13]. Причины возникновения ИГ могут быть различными, но наиболее часто ИГ связывают с высокими темпами ультрафильтрации вследствие большого набора жидкости в междиализный период [19, 20]. Скорость ультрафильтрации поддается количественной оценке и может быть скорректирована для каждого конкретного пациента для минимизации осложнений и улучшения переносимости процедур ГД [22]. Еще одной клинической проблемой, связанной с вариациями АД в ходе процедуры, является интрадиализная, или «парадоксальная», гипертензия, наблюдаемая в 10–15% диализных процедур, и также связанная с плохой переносимостью диализной процедуры и плохим прогнозом у больных на ГД [15]. Таким образом, следует констатировать, что данные литературы по проблеме весьма противоречивы, проблема актуальна, что и предопределило необходимость проведения данного исследования.
Материал и методы
Материалом работы послужили данные комплексного обследования пациентов цепочки диализных центров единого провайдера, объединенных общей медицинской информационной системой. В ретроспективный анализ включены всего 3724 больных, находившихся на ГД в центрах диализа группы Б. Браун Авитум Руссланд Клиникс в течение всего периода наблюдения с 2011 по 2016 г. «Новых» пациентов в обследованной когорте оказалось 52% пациентов, остальные начали диализ ранее 2011 г в других центрах. Средний возраст больных составил 54 года, средний срок пребывания на диализе – 5,3 года, (мин. – 0,8; макс. – 32,7 года), доля женщин – 45%, мужчин – 55%. Обеспеченная доза диализа составила 1,6±0,23 (spKt/V). Средняя скорость УФ составbла 7,6±2,9 мл/кг/ч. АД перед сеансом составляло 140±15,8 и 84±9,8 мм рт.ст. Уровень гемоглобина – 105±12 г/л. Уровень альбумина – 38,3±8,7 г/л. Цель исследования: оценка влияния пред- и постдиализной гипертензии, нормо- и гипотензии, а также интрадиализных изменений артериального давления (АД) на выживаемость пациентов, получающих лечение программным гемодиализом (ГД). В задачи исследования входило оценить выживаемость больных в зависимости от преддиализного и постдиализного САД и ДАД в моделях Каплана–Мейра и регрессионной модели Кокса; оценить влияние вариаций интрадиализного АД на выживаемость больных в модели Каплана–Мейра и в регрессионной модели Кокса; проанализировать возможную связь вариаций интрадиализного АД со скоростью ультрафильтрации.
Для решения поставленных задач был проведен статистический анализ связи вариаций АД с выживаемостью больных на гемодиализе (ГД) в пропорциональной регрессионной модели Кокса. В исследовании были использованы усредненные данные АД, измеренные до и после ГД за весь период наблюдения, после чего больные были разделены на квартили. Результаты выживаемости оценивали по кривым Каплана–Мейера. В диализном центре регистрировалось преддиализное АД, измеренное перед началом подключения пациента к аппарату, далее АД измерялось регулярно в ходе сеанса диализа (у гемодинамически стабильных пациентов с АД в целевом диапазоне один раз в час, у нестабильных пациентов с АД вне целевого диапазона один раз в полчаса или чаще), последнее измерение проводилось после отключения пациента от аппарата (постдиализное АД). В оценке выживаемости в качестве переменных использовались усредненные значения измерений за весь период наблюдений. Измерение проводилось с помощью встроенного блока автоматического измерения АД на аппарате искусственная почка Б. Браун Диалог Плюс.
Статистический анализ был проведен с помощью статистической программы SPSS 22.0 и STATISTICA 6.0. Использовались стандартные методы описательной и вариационной статистики: вычисление средних значений и стандартного отклонения при нормальном распределении величин или определение медианы и интерквартильного размаха. Для сравнения переменных с нормальным распределением использовали t-тест Стьюдента. При сравнении данных с распределением, отличным от нормального, использовали тест Вилкоксона или Манна–Уитни. Достоверность различий количественных параметров и их динамики определяли с помощью t-критерия Стьюдента с поправкой Бонферрони в случае множественных сравнений. Различия считали достоверными при р<0,05. Корреляционнорегрессионный анализ проведен с определением коэффициента корреляции Пирсона. Оценка выживаемости осуществлена по методу Каплан–Мейера и в регрессионной модели Кокса с включением факторов, предположительно оказывающих влияние на выживаемость (демография, коморбидность, доза диализа eKT/V, скорость ультрафильтрации (УФ), уровни гемоглобина, креатинина, альбумина, ПТГ, фосфатов, кальция). Актуриальная выживаемость пациентов рассчитывалась при помощи кривых Каплана–Мейера с момента включения пациента в исследование.
Результаты
В ходе данного исследования у 35 (0,94%) больных перед процедурой ГД наблюдалась картина выраженной гипотензии (САД менее 100 мм рт.ст.), 294 (7,89%) пациента демонстрировали картину умеренной гипотензии (САД – 100–120 мм рт.ст.). Нормальный и пограничный уровень АД (САД – 120–139 мм рт.ст.) был выявлен у большинства пациентов – 1552 (41,68%). Гипертензия I степени (мягкая гипертензия) была зафиксирована у 1484 (39,86%) пациентов (САД – 140–159 мм рт.ст.), а артериальную гипертензию II–III степеней (умеренная и высокая гипертензия – САД >160 мм рт.ст.) – у 358 (9,61%) больных. На протяжении всего времени исследования мы наблюдали следующую динамику АД: снижение САД в ходе процедуры в среднем составило 5 мм Hg. ДАД имело слабую тенденцию к снижению (в среднем около 1,5 мм рт.ст.) (рис. 1).
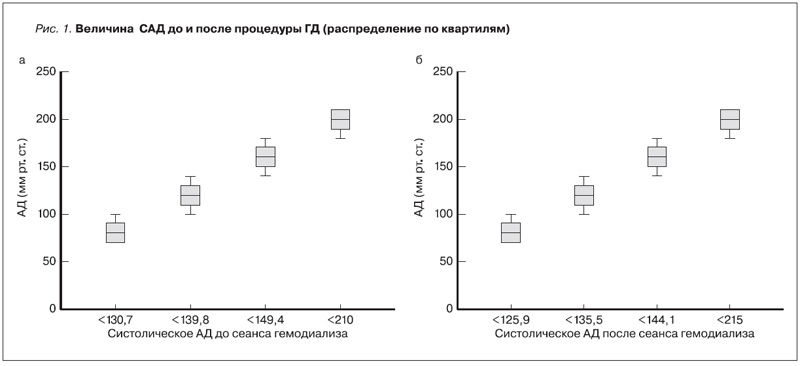
В соответствии с поставленной задачей на первом этапе нами была оценена выживаемость пациентов в зависимости от характеристики преддиализного АД и его изменений к концу процедуры. Было установлено, что трехлетняя выживаемость с момента включения в исследование составила 86%, а пятилетняя – 78%. Возраст на старте наблюдения составил 54,8±13,6 года, медиана срока заместительной почечной терапии – 29 месяцев (интерквартильный размах – 16÷42). Была проанализирована выживаемость между подгруппами пациентов, разделенных по квартилям САД и ДАД.
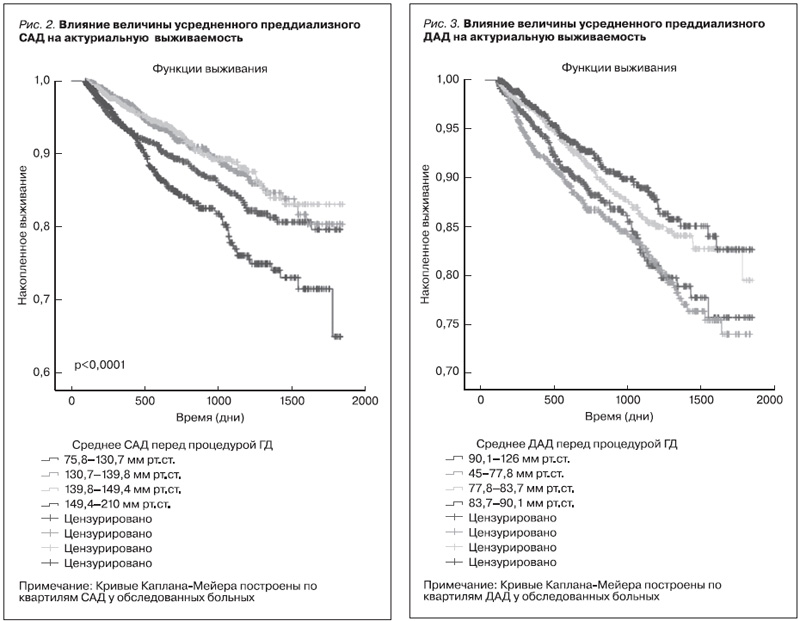
Из рис. 2 видно, что пациенты верхнего квартиля преддиализного САД (САД выше 149,4 мм рт.ст.) демонстрировали наихудшую выживаемость (p<0,0001), что также было установлено при дальнейшем анализе и постдализном САД, где наихудшая выживаемость выявлена также в верхнем квартиле (САД выше 144,1 мм рт.ст.; p<0,0001). При анализе выживаемости групп пациентов, разделенных на квартили по ДАД перед процедурой ГД, пациенты нижнего квартиля показали наихудшую выживаемость, а постдиализное ДАД не показало статистически достоверного влияния на выживаемость (рис. 3, 4). Влияние САД и ДАД за время наблюдения на выживаемость пациентов в регрессионных моделях Кокса (монофакторный анализ) представлены в табл. 1–4. Пациенты были разделены на группы по квартилям САД и ДАД. Нами было установлено достоверное увеличение риска смертности на 42% у пациентов, находящихся в пределах верхнего квартиля систолического АД свыше 149 мм рт.ст. (HR – 1,427, CI – 1,103–1,847; p=0,007).
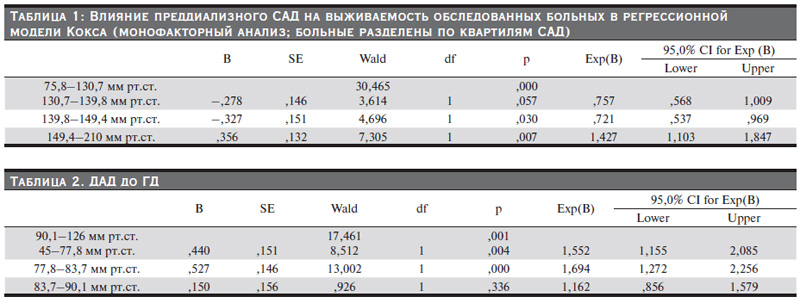
При этом группа пациентов, имевших САД 140–149 мм рт.ст., до процедуры ГД имели улучшение прогноза выживаемости на 28% (HR – 0,721, CI – 0,537–0,969, p=0,03) (табл. 1). Наибольшее влияние на выживаемость достоверно оказывали два нижних квартиля преддиализного ДАД (группы 45–77,8 и 77,8–83,7 мм рт.ст.) (табл. 2), в которых риск смертности при гипотензии был увеличен на 55 и 69% (HR – 1,552, CI – 1,15–2,08; p=0,004 и HR – 1.694, CI – 1,272–2,256; p<0,0001). Исследование постдиализного САД демонстрировало наихудшую выживаемость у пациентов второго квартиля: снижение САД ниже 125,9 мм рт.ст. демонстрировало повышение риска смертности на 59% (HR – 1,592, CI – 1,356–1,87; p<0,0001) (табл. 3). Исследование ДАД после процедуры (табл. 4) показало достоверное увеличение риска смертности на 35% у пациентов со снижением ДАД в квартиле со значениями АД=82–88,1 мм рт.ст. (HR –1,346, CI – 1,023–1,770; p=0,034).
Таким образом, достоверное влияние на выживаемость пациентов с ХБП-5Д имеют низкое преддиализное значение ДАД и повышенное САД, а также снижение САД после процедуры ГД ниже порога оптимальных значений (в нашем исследовании <125,9 мм рт.ст. ).
В ходе последующего наблюдения в рамках исследования оценена выживаемость пациентов в зависимости от вариативности интрадиализного АД непосредственно во время процедур ГД. Мы сформировали группы пациентов в зависимости от вариативности САД: в группу с интрадиализной гипотензией распределены пациенты, у которых фиксировалось снижение САД на 10 (легкая гипотензия), 20 (умеренная гипотензия) и >30 мм рт.ст. (тяжелая гипотензия). При повышении САД >10 мм рт.ст. пациенты определялись в группу интрадиализной гипертензии. Остальных пациентов считали нормотензивными. Методом Каплана–Мейера была проанализирована выживаемость пациентов за весь период наблюдения (рис. 5).
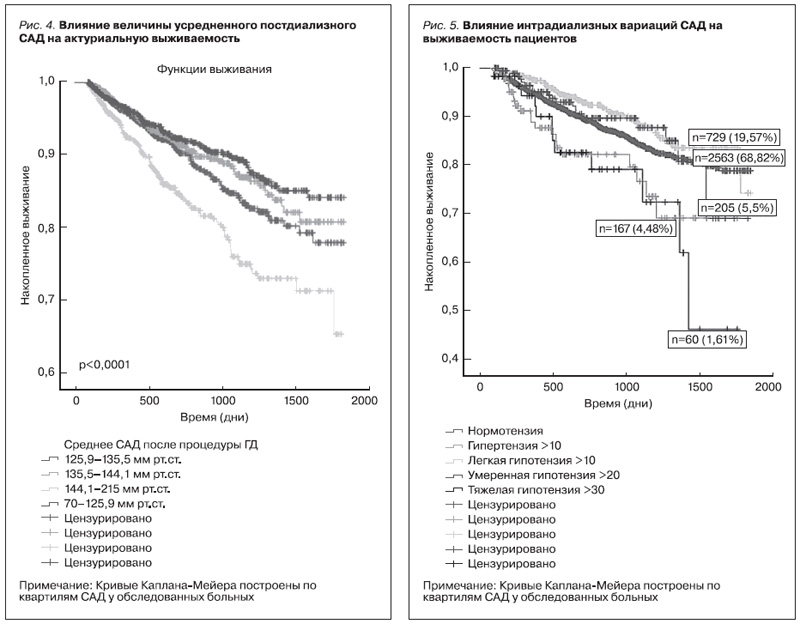
Были получены данные, согласно которым наихудшая выживаемость выявлена в группе с тяжелой ИГ (среднее падение АД за процедуру >30 мм рт.ст.; n=60; 12 смертей). В группе интрадиализной гипертензии (повышение САД >10 мм рт.ст.) была зафиксирована 21 смерть, n=167. В группах с легкой и умеренной интрадиализной гипотензией (>10 и >20 мм рт.ст.) зарегистрировано 19 летальных исходов. Выявление факторов, оказывающих влияние на выживаемость, выполнено с помощью построения регрессионной модели Кокса. В качестве независимых факторов, предположительно имеющих клиническую значимость, помимо демографии и коморбидности были выбраны изменение САД и ДАД во время гемодиализа, темпы ультрафильтрации (с градацией до 7 мл/кг/ч, 7–10, 10–13 и более 10 мл/кг/ч), уровень креатинина, уровень мочевины, градиент натрия, гемоглобин, средние значения САД и ДАД в дни забора анализов до и после гемодиализа. В регрессионной модели Кокса независимыми предикторами смертности больных на ГД оказались изменение САД во время процедуры гемодиализа: (p=0,074, ДИ 1,019–1,904, HR=1,416), изменение ДАД во время процедуры гемодиализа (p=0,046, ДИ – 1,098–1,659, HR=1,246), темпы ультрафильтрации (p=0,033, ДИ – 1,003–1,086, HR=1,127), градиент натрия (p=0,006, ДИ – 1,016– 1,094, HR=1,138). Пульсовое давление в нашей модели достоверно ухудшало прогноз только в группе пациентов с крайне высокими его значениями: > 75 мм рт.ст. (n=88; 18 летальных исходов) и <35 mm Hg. Следовательно, вариации АД в ходе сеанса диализа достоверно влияют на выживаемость пациентов на гемодиализе: интрадиализное повышение САД более чем на 10 мм рт.ст. и падение САД на 20 мм рт. ст. и ниже статистически значимо ухудшает прогноз пациентов на программном ГД. Указанные вариации АД также демонстрируют высокую клиническую значимость: риск смертности возрастает на 40% при интрадиализной гипертензии и на 28% у пациентов с выраженной интрадиализной гипотензией.
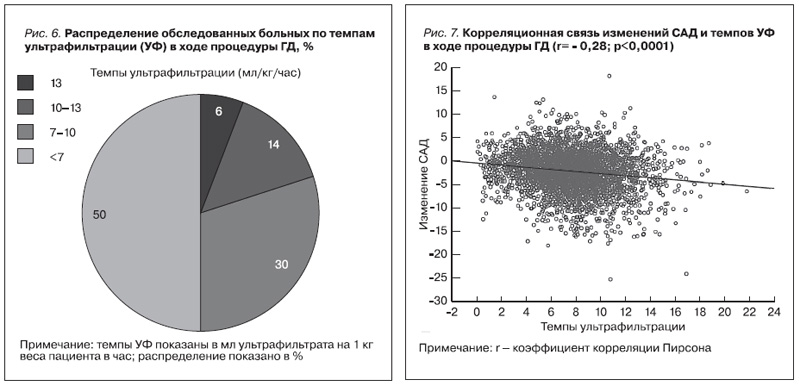
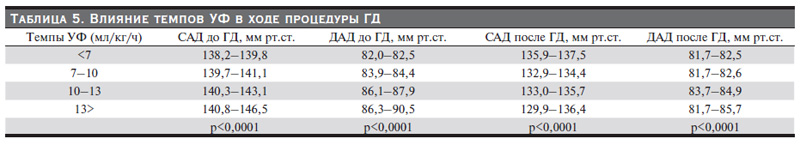
На рис. 6 проиллюстрировано распределение больных, включенных в настоящее исследование, по темпам УФ. Наиболее часто встречались пациенты со скоростью УФ менее 7 мл/кг/ч (50%). На втором месте были пациенты с темпами УФ 7–10 мл/кг/ч. Самая большая скорость УФ была у 14% (10–13 мл/ кг/ч и 6% (более 13 мл/кг/ч). Нами была проанализирована связь вариаций интрадиализного САД со скоростью УФ. На рис. 7 представлена зависимость снижения САД от скорости УФ во время процедур ГД. Выявлена слабая, но достоверная отрицательная корреляция между скоростью УФ и снижением САД (r= -0,28; p<0,00001), что косвенно подтверждает литературные данные, о взаимосвязи высоких темпов УФ с развитием ИГ. Еще более наглядно эта связь продемонстрирована в табл. 5., в которой каждой из групп пациентов, распределенных по темпам УФ, соответствуют актуальные границы АД до и после процедуры. Из таблицы отчетливо видно, что границы АД достоверно различаются в зависимости от скорости УФ (p<0,0001 во всех группах). В группах преддиализного САД с увеличением скорости УФ нижние границы увеличивались в среднем на 0,65 мм рт.ст., верхние границы росли в среднем на 1,65 мм рт.ст. Нижние границы преддиализного ДАД до ГД повышались в среднем на 1,1, верхние – на 2 мм рт. ст. Анализ постдиализного САД и ДАД продемонстрировал уменьшение нижних границ САД на 1,5 мм рт.ст. и незначительное уменьшение верхней границы постдиализного САД. Границы ДАД после ГД, напротив, показали увеличение верхних границ усредненного ДАД на 1 мм рт.ст. Наиболее контрастно границы АД до и после диализа различались в группе со скоростью УФ более 13 мл/ кг/ч, что позволяет говорить об этих пациентах как о группе с самым высоким потенциальном риском развития осложнений.
Обсуждение
Влияние разнонаправленных вариаций АД на выживаемость пациентов ГД на сегодняшний день остается актуальной клинической проблемой, и ей посвящено множество публикаций. В недавнем систематическом обзоре только с 1980 по 2015 г. проанализировано 2783 публикации по этой проблеме в рецензируемых журналах, из которых только 23 работы признаны соответствующими критериям отбора [18]. В свете литературных данных, казалось бы, не вызывает сомнений, что грубые изменения гемодинамики, особенно в ходе гемодиализной процедуры, оказывают негативное влияние на клинические исходы [2]. Гипертензия у больных на программном ГД вносит вклад в ускоренное развитие атеросклероза [4], развитие ГМЛЖ [4,14], высокую частоту кардио-васкулярных событий, включая смерть [1]. Гипотензия в ходе сеанса диализа ухудшает переносимость ГД, нередко требует неотложных мер для коррекции АД (отключения УФ, введения гиперосмолярного раствора глюкозы, инфузии физиологического раствора, преждевременного прекращения процедуры, невыполнения диализной программы), что часто отражается на качестве лечения в целом [8]. ИГ ассоциирована с повторными эпизодами ишемии и нарушения локальной сократимости миокарда, что ведет к фиброзу миокарда и развитию сердечной недостаточности [9]. Подобные ситуации усугубляют вариации АД как в большую, так и в меньшую сторону, а также ведут к расширению границ АД у пациентов с высокой скоростью УФ и еще большим осложнениям [13].
Именно с этим столкнулись многие исследователи, обнаружив, что агрессивное снижение АД у пациентов на ГД до нормальных значений для общей популяции не всегда оправданно и может даже увеличить смертность. Противоречивая гипотеза «обратной эпидемиологии» у пациентов на диализе, выдвинутая К. Калантар-Заде к концу нулевых годов, хотя и не доказала причинно-следственной связи повышенного АД и лучшей выживаемости больных, тем не менее оказала определенное влияние на рекомендованные целевые значения АД у диализных пациентов [17]. Данное исследование посвящено изучению влияния гипер- и гипотензии на клинические исходы. Мы провели анализ большого массива данных пациентов, имея индивидуальные данные АД пациентов, включенных в исследование за весь период наблюдения, из медицинской информационной системы. В нашей работе нам удалось продемонстрировать не только ухудшение выживаемости при преддиализной АГ, но и при низком преддиализном ДАД. Низкое постдиализное САД также продемонстрировало достоверное влияние на выживаемость. Результаты нашей работы в этой части многом совпадают с литературными данными. В работе J. Inrig [15] были обследованы 1,748 пациента. Измерялось преди постдиализное АД, а также их вариации во время процедур ГД, что в результате исследования показало увеличение риска смерти при увеличении интрадиализного САД на 10 мм рт.ст. Эти данные совпадают с результатами нашего исследования, но при этом исследование преддиализного АД демонстрировало снижение риска смерти больных с высоким уровнем САД, что частично расходится с нашими результатами. Возможно, это объясняется различным составом больных – в обоих цитируемых исследованиях пациенты были значительно старше, имели большую частоту сахарного диабета и сердечной недостаточности. В обсервационном исследовании Shoji et al. [24] было рассмотрено влияние интрадиализной гипотензии 1206 японских пациентов на протяжении 2 лет, которое показало ухудшение выживаемости диализных пациентов при падении интрадиализного САД⩾40 мм. рт.ст., а также повышенную смертность при низком постдиализном САД, что также в целом совпадает с нашими данными, хотя конкретные пороговые значения САД в этом исследовании (120–129 мм рт.ст.), влияющие на риск смерти, незначительно отличались полученных нами данных (70–125,9 мм рт.ст.). Результаты исследования [35] показали статистически достоверное повышение смерти у пациентов с преддиализным САД⩽129, а также САД=130–159 мм рт.ст. при минимальном интрадиализном САД<90 мм рт.ст.; и САД⩾160 при минимальном интрадиализном САД<100 мм рт.ст., что также согласуется с нашими результатами. При анализе влияния уровня АД на выживаемость по данным Регистра Российского диализного общества, у пациентов, впервые начавшие диализ, были получены данные, согласно которым только уровень САД, превышающий 180 мм рт.ст., и ДАД ниже 60 мм рт.ст. статистически достоверно связаны с повышением риска смерти [1], однако при этом следует учитывать, что в этом исследовании оценивалось влияние единственного значения АД, зафиксированного к началу диализной терапии.
В нашем наблюдении анализ выживаемости проведен не только в зависимости от исходных значений АД, но и от его вариаций в ходе процедуры. В заключение нами была проанализирована возможная взаимосвязь скорости УФ и вариаций АД в ходе процедуры. Кроме того, больные были разделены на группы в зависимости от темпов УФ и для каждой группы границы АД были сопоставлены с темпами УФ. Как известно из литературных данных, смертность начинает расти при превышении темпов УФ>10 мл/кг/ч и существенно возрастает при>13 мл/кг/ч [8, 19, 20]. Корреляционный анализ и сравнение между группами продемонстрировали взаимосвязь высоких темпов УФ со снижением САД к концу процедуры, что прогностически неблагоприятно и в целом согласуется с литературными источниками.
К возможным недостаткам нашей работы относится включение в анализ как первичных, «новых», пациентов, так и уже ранее получавших лечение гемодиализом. Сильной стороной работы считаем изучение проблемы в условиях реальной клинической практики, большое число наблюдений и отсутствие селекции пациентов при включении в исследование. Мы намеренно оставили за скобками вопросы профилактики и коррекции патологических колебаний АД у пациентов на программном ГД, т.к. этим аспектам будут посвящены дальнейшие исследования.
Заключение
Достоверное влияние на выживаемость пациентов с ХБП-5Д имеют низкое преддиализное значение ДАД и повышенное САД, а также снижение САД после процедуры ГД ниже оптимальных значений. Установлено влияние изменений АД в ходе сеанса диализа на выживаемость: интрадиализное повышение САД более чем на 10 мм рт.ст., падение САД на 20 мм рт.ст. и ниже статистически значимо ухудшают прогноз пациентов на программном ГД. Продемонстрирована зависимость высоких темпов ультрафильтрации и падения АД к концу процедуры ГД.



