Введение
Основное значение фармакогенетических исследований в области изучения артериальной гипертензии (АГ) связано с поиском новых путей для оптимизации лечения АГ. Исследования последних лет показывают, что вариабельность фармакологического ответа на прием различных антигипертензивных препаратов в значительной степени определяется генетическими особенностями [1].
Одними из основных препаратов лечения АГ являются антагонисты рецепторов ангиотензина II (АРАII, сартаны) [2]. Несмотря на появление новых препаратов в этой группе, лозартан по-прежнему остается самым часто назначаемым (45% среди первичных назначений АРА) [3]. Однако его применение далеко не для всех больных в одинаковой степени эффективно.
По фармакокинетическим свойствам лозартан является пролекарством, антигипертензивная эффективность которого обеспечивается его активным метаболитом Е-3174. E-3174 имеет более высокую аффинность в отношении АТ1-рецептора и больший период полувыведения, таким образом обеспечивая основное антигипертензивное действие [4]. Активный метаболит в основном образуется под действием фермента CYP2С9 [5]. По данным исследований, проведенных in vitro, E-3174 также образуется под действием CYP3A4, однако в исследованиях in vivo при применении лозартана в терапевтических дозах значимого вклада CYP3A4 в метаболизм лозартана не выявлено [6].
Ген CYP2С9 имеет ряд генетических полиморфизмов, влияющих на его активность. К наиболее изученным и распространенным в общей популяции полиморфизмам гена CYP2C9 относятся аллели CYP2C9*2 и *3. Они характеризуются сниженной активностью [7], что ведет к нарушению образования активного метаболита E-3174 [8].
При этом отмечаются существенные межпопуляционные отличия в частоте встречаемости полиморфных аллелей. Так, CYP2C9*2 чаще встречается у европейцев (11,7%) и американцев (6,6%), тогда как CYP2C9*3 – среди азиатов (3,4% в Восточной Азии и 11,3% в Южной) и африканцев (5,6%) [9].
В Российской Федерации из-за широкого этнического разнообразия частота данных генов также неоднородна. Так, CYP2C9*2 чаще встречается среди русских и армян и почти отсутствует среди представителей монголоидной расы: якутов, бурятов, тувинцев. CYP2C9*3 широко распространен среди народов Северного Кавказа: черкесов, лакцев, аварцев и даргинцев [10].
В литературе показано влияние полиморфизма гена CYP2C9 на фармакокинетику лозартана. У гомо- и гетерозиготных носителей аллельных вариантов CYP2C9*2 и CYP2C9*3 («медленные» метаболизаторы) выявлено значительное снижение скорости образования и концентрации метаболита E-3174 [11, 12]. U. Yasar et al. показали, что у гомо- и гетерозиготных носителей аллельных вариантов CYP2C9*2 и CYP2C9*3 после приема лозартана максимальная концентрация Е-3174 оказалась достоверно ниже, чем у лиц с «диким» типом CYP2C9*1/*1 [13]. Эти данные подтвердились и в дальнейших работах. Так, у лиц с генотипом CYP2C9*1/*3 через 6 часов после приема лозартана в дозе 25 мг/сут. отмечно достоверно более низкое отношение концентрации Е-3174 к концентрации лозартана в моче, чем у лиц, имевших генотип CYP2C9*1/*1, что свидетельствует о сниженной активности CYP2C9 [14].
В исследовании M.S. Joy et al. оценивалось влияние полиморфизма гена CYP2C9 на гипотензивный эффект лозартана у пациентов c хронической болезнью почек (ХБП) и АГ. У пациентов с аллелями *2 и *3 гена CYP2C9 отмечен ослабленный фармакологический ответ на терапию лозартаном [15].
В качестве оценки активности CYP2C9 используется метод лозартановой пробы, основанный на определении концентрации лозартана и его активного метаболита E-3174 в моче, образующегося в основном под влиянием CYP2C9 [16]. Лозартановый тест предложен для оценки активности CYP2C9 in vivo Российскими рекомендациями для фармацевтических компаний по изучению биотрансформации и транспортеру новых лекарственных средств [17].
Цель исследования: изучить влияние генетического полиморфизма CYP2C9 на гипотензивный эффект лозартана у пациентов с АГ I–II степеней.
Методы
Клиническая часть исследования проводилась на базе терапевтического отделения № 1 поликлиники ЛМС Москвы с 2018 по 2020 г.
Фармакогенетическое и фармакокинетическое исследования CYP2С9 проводились на базе Научно-исследовательского центра (НИЦ) ФГБОУ ДПО РМАНПО. Исследования одобрены Локальным этическим комитетом ФГБОУ ДПО РМАНПО Минздрава РФ и проведены в соответствии с Хельсинкской декларацией. От каждого пациента получено добровольное информированное согласие на участие в исследовании.
В исследование был включен 81 пациент (45 мужчин и 36 женщин) с АГ I–II степеней в возрасте от 24 до 74 лет, средний возраст составил 48,8 года. Все пациенты исходно либо не получали антигипертензивную терапию, либо получали ее нерегулярно. Лозартан назначали в дозе 25–50 мг/сут., средняя доза составила 44 мг/сут.
Критерии включения: АГ I–II степеней, возрасте старше 18 лет, подписанное информированное согласие на участие в исследовании. Не включались в исследование лица с АГ III степени и неконтролируемой АГ, перенесшие острый инфаркт миокарда, острое нарушение мозгового кровообращения менее, через за 6 месяцев до включения в исследование, пациенты с нестабильной стенокардией, хронической сердечной недостаточностью III–IV функциональных классов, а также с другими хроническими заболеваниями в стадии обострения или декомпенсации. Также исключение составили алкоголизм, наркотическая зависимость, беременность, одновременный прием препаратов, являющихся субстратами цитохрома Р-450 CYP2C9, и непереносимость лозартана.
Исследование проведено в два этапа. На первом до начала терапии проводилось суточное мониторирование АД (СМАД) с использованием портативных регистраторов (Tonoport V («GE Medical Systems Information Technologies GmbH», Germany). Генотипирование по аллельным вариантам CYP2C9 (CYP2C9*2 (+430С>Т, rs1799853) и CYP2C9*3 (+1075A>C, rs1057910) определялось методом полимеразной цепной реакции в реальном времени. После применения лозартана оценивалась метаболическая активность изофермента цитохрома Р-450 CYP2C9 по определению концентрации лозартана и его активного метаболита E-3174 в моче (лозартановый тест), собранной в течение 8 часов после приема известной дозы лозартана. Отбиралась порция объемом 5 мл в пробирки без консерванта и замораживалась при температуре -17 и -19°С. Концентрацию лозартана и его метаболита E-3174 определяли методом ультравысокоэффективной жидкостной хроматографии (Shimadzu UFLC) с тандемной масс-спектрометрией (Simadzu LCMS-8040 с программным обеспечением LabSolutio, с хромотографической колонкой Zorbax Eclipce XDB-C18, 5 мкм [150×4,6 мм]; Agilent [USA]). На втором этапе исследования через 3 месяца оценивались эффективность антигипертензивной терапии и различные параметры СМАД.
Статистическая обработка данных проводилась в программном пакете SPSS Statistics 22.0. Носители CYP2C9*1/*1 были использованы как группа сравнения. Следуя обоснованию M.S. Joy et al., полиморфные варианты CYP2C9 (*1/*2, *1/*3, *2/*2 и *2/*3) были объединены в одну группу как «не 1/1» [15]. Обработка результатов подразумевала сравнение различных параметров пациентов между двумя генетическими группами. Для анализа количественных переменных (доза лозартана, данные СМАД) применялся критерий Манна–Уитни. Анализ эффективности антигипертензивной терапии проводился при помощи метода таблиц сопряженности – двустороннего χ2-критерия. Для определения достоверности различий между параметрами использовалась величина p<0,05.
Результаты
В исследование были включены 46 (56,8%) мужчин и 35 (43,2%) женщин. Генотип CYP2C9*1/*1 был определен у 55 пациентов, генотип CYP2C9*1/*2 – у 13, CYP2C9*1/*3 – у 9. По 2 пациента были носителями CYP2C9*2/*2 и CYP2C9*2/*3 соответственно. Достоверных различий наблюдаемого распределения от ожидаемого, согласно закону Харди–Вайнберга, не выявлено (р>0,05). Доза лозартана между носителями генотипа CYP2C9 *1/*1 и полиморфных аллелей CYP2C9*2 и *3 значимо не различалась, средняя суточная доза составила 45±18 и 41,8±17 мг/сут. соответственно. Другие демографические и лабораторные показатели также не различались между генотипами (табл. 1).
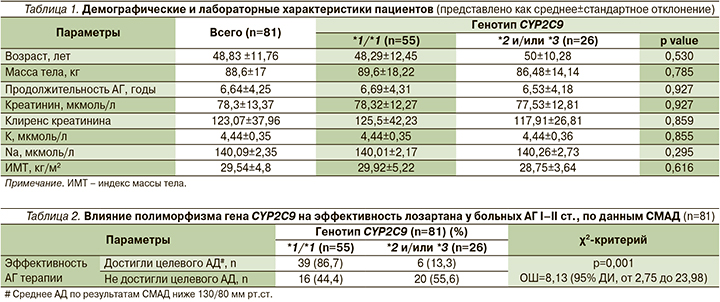
При сравнении эффективности проведенной терапии лозартаном показано, что носительство полиморфных аллелей CYP2С9 (*2, *3) было ассоциировано со снижением эффективности антигипертензивной терапии (отношение шансов [ОШ]=8,13; 95% доверительный интервал [ДИ] от 2,75 до 23,98; р=0,001, табл. 2).
При сравнении данных СМАД (табл. 3) максимальное систолическое артериальное давление (САД) было выше у носителей полиморфных аллелей 144 (141–148) против 135 (130–138) (р<0,001). Максимальное ДАД было также выше у носителей полиморфных аллелей 92 (91–95) против 85 (81–88) (р<0,001). Значения среднего САД и ДАД в конце исследования были также достоверно выше у носителей вариантных аллелей по сравнению с носителями CYP2C9*1/*1: 129 (125–132) против 123 (120–126) (р=0,001) для САД и 81 (75–83) против 75 (72–78) (р=0,001) для ДАД соответственно. Дельты максимального и среднего САД и ДАД в абсолютных и процентных значениях были значимо больше у носителей генотипа CYP2C9*1/*1 по сравнению с носителями вариантных аллелей CYP2C9*2 и CYP2C9*3.
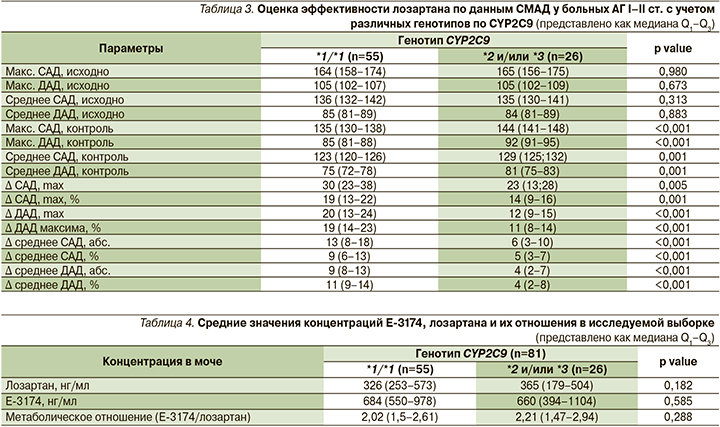
Также мы изучили влияние аллельных вариантов CYP2C9*2, CYP2C9*3 на метаболическую активность изофермента CYP2С9 методом лозартановой пробы, оцененной по соотношению в моче концентрации активного метаболита Е-3174 к концентрации лозартана (метаболическое отношение) (табл. 4).
По результатам сравнения между пациентами с генотипом CYP2C9*1/*1 и носителями полиморфных аллелей CYP2С9*2 и CYP2С9*3, концентрация лозартана, активного метаболита и метаболического отношения не достигли достоверных различий.
Обсуждение
Влияние полиморфизма гена CYP2C9 на гипотензивный эффект лозартана изначально выдвинуто в качестве гипотезы на основании фармакокинетических моделей [8]. Далее она была подтверждена на пациентах с ХБП и АГ [15]. В данном исследовании мы также подтвердили эту гипотезу на основании сравнения данных СМАД до и после терапии лозартаном пациентов с легкой и умеренной АГ без тяжелой коморбидности.
Преимуществом нашей работы было использование СМАД для оценки эффективности антигипертензивной терапии. СМАД имеет ряд преимуществ перед офисным измерением АД: позволяет идентифицировать маскированную гипертензию, гипертензию «белого халата», обладает более значимой прогностической ценностью в мониторировании АД, позволяет проводить измерение АД в ночное время, определять дополнительные прогностические фенотипы АД, а также приближен к условиям реальной жизни. Из недостатков СМАД можно отметить лишь ограниченную доступность и относительно высокую стоимость [2, 18]. Кроме того, данные СМАД являются лучшим предиктором поражения органов, обусловленного АГ, чем результаты офисных измерений АД [19]. Более того, доказано, что среднесуточное АД, зарегистрированное амбулаторно, более тесно коррелирует с заболеваемостью и смертностью [20–22].
Данные, полученные в ходе работы, подтверждают актуальность фармакогенетического тестирования по CYP2C9, способствующего прогнозированию фармакологического ответа, а также позволяющего определять индивидуальный подход к выбору лекарственных средств для лечения АГ.
Заключение
По результатам исследования пациентов с АГ I–II степеней, носительство аллельных вариантов CYP2С9*2 и *3 было ассоциировано с неэффективность антигипертензивной терапии лозартаном. При этом не было выявлено разницы в концентрации лозартана и его метаболита в моче между носителями CYP2C9*1/*1 и полиморфных аллелей.
Выявление генетических особенностей у больных АГ I–II степеней методом фармакогенетического тестирования по CYP2C9 может прогнозировать фармакологический ответ при применении лозартана, способствуя повышению эффективности фармакотерапии АГ.



