Введение
Внебольничная пневмония (ВП) до сих пор остается одним из самых распространенных в мире острых инфекционных заболеваний детского возраста. Именно она служит наиболее частой причиной госпитализации детей и сохраняет лидирующие позиции в структуре детской смертности [1–3]. По данным Всемирной организации здравоохранения (ВОЗ), у детей в возрасте до 5 лет на долю пневмоний приходится до 15% всех случаев детской смертности. Одной из причин сложившейся ситуации считается отсутствие адекватного лечения [4]. И если ВОЗ учитывает данные всех стран, в т.ч. тех регионов, где медицинская помощь оказывается на крайне низком уровне или вообще недоступна, то в Европе и США ситуация также серьезная. Зачастую причиной является позднее обращение за медицинской помощью и, соответственно, начало лечения, однако приходится сталкиваться и с неверным выбором стартового препарата или его дозы.
Российская Федерация также не является исключением, около трети всех пневмоний зарегистрировано у детей в возрасте младше 2 лет, а в структуре смертности среди детей до 1 года и вовсе больше половины приходится на ВП [5, 6].
В последнее время в развитых странах частота госпитализаций детей с тяжелыми формами ВП значительно снизилась благодаря проводимой вакцинации портив как Streptococcus pneumoniae, так и Haemophilus influenzae [7]. Однако процент привитых детей в России пока невысок.
На сегодняшний день также очень актуальна проблема антибиотикорезистентности ввиду необоснованного бесконтрольного использования антибактериальных препаратов в предыдущие десятилетия, не говоря о периоде пандемии. Рост резистентности микроорганизмов к назначаемым препаратам существенно влияет на тактику и эффективность терапии, а также на прогноз заболевания, что мешает намечающейся тенденции к снижению заболеваемости пневмонией [8]. Борьба с устойчивостью к антибиотикам стала одним из приоритетных направлений ВОЗ [9], в связи с чем необходимо постоянное совершенствование методов диагностики пневмонии, схем эффективного лечения антибактериальными препаратами, регулярного пересмотра их доз, мониторинга эпидемиологической обстановки, циркуляции антибиотикорезистентных штаммов и т.д.
Этиология, диагностика, подходы к терапии ВП
В России пневмония определяется как заболевание преимущественно бактериальной этиологии, характеризующееся синдромами интоксикации и дыхательных расстройств, диагностируемое на основании наличия инфильтративных изменений на рентгенограмме грудной клетки. Однако в США, как и в некоторых других странах, несмотря на адекватные подходы к лечению, пневмония диагностируется на основании физикальных изменений, что значительно завышает статистические данные о частоте пневмоний с учетом определенной доли вирусных заболеваний дыхательных путей, подходящих под определение. Это необходимо иметь в виду при изучении англоязычной литературы [10].
Однако статистика в отношении тяжелой пневмонии как в мире, так и в нашей стране неизменна и четко показывает, что возбудителем тяжелой пневмонии являются S. pneumoniae и H. influenzae. Именно с этими микроорганизмами связано до 50% неблагоприятных исходов, при том что около 90% всех пневмоний у детей в возрасте младше 5 лет именно пневмококковые и около 10% связаны с H. influenzae. Напротив, у детей школьного возраста и подростков при сохраняющейся лидирующей позиции S. pneumoniae до 40% пневмоний атипичные, т.е. вызываются Мycoplasma pneumoniae и Klebsiella pneumoniae, имеют более благоприятное течение и прогноз.
В последнее время обращает на себя внимание рост числа случаев атипичной пневмонии, и многие исследователи это связывают с влиянием вакцинации против пневмококка и гемофильной инфекции [11–13].
Особая категория – дети первого полугодия жизни. В силу анатомо-физиологических особенностей и иных состояний пневмония в этом возрасте чаще возникает на фоне аспирации пищи (дисфагия, гастроэзофагеальный рефлюкс, псевдобульбарный синдром) или в случае наличия каких-либо врожденных заболеваний дыхательных путей, а также иммунодефицита. Поэтому возбудителями ВП у них обычно являются грамотрицательные представители кишечной флоры и стафилококки. Типичные пневмококковые и гемофильные пневмонии в этом возрасте также возможны, главным образом при заражении от сибсов, посещающих детские учреждения. У детей этой категории вероятна пневмония, вызванная Chlamydia trachomatis, в таком случае заражение происходит интранатально в родовых путях [10].
При подозрении на ВП обычно назначается эмпирическая антибактериальная терапия, и выбор препарата основывается на предположении возбудителя. Клинические рекомендации и согласительные документы по пневмониям также предлагают основываться на клинической симптоматике и результатах лабораторно-инструментальных исследований при постановке этиологического диагноза и выборе лечения, нежели на выделении самого возбудителя [14–16]. Исследования многих авторов показывают, что наиболее часто ошибки допускаются именно на этапе диагностики, что в результате ведет к ошибкам в терапевтической тактике. На практике оказывается, что многие педиатры не понимают тонкостей этиологического поиска пневмонии, проводят различные нецелесообразные исследования, как-то: бактериологическое исследование мазка из носа или определение антител к хламидиям и микоплазме на ранних сроках заболевания. Затем анализы неверно интерпретируются, а данные клинической картины недооцениваются, и ребенок получает курс неэффективного антибиотика, зачастую даже не одного [17–19]. Иногда самым надежным помощником в дифференциальной этиологической диагностике является возраст ребенка. Если обобщить, то пневмококковая пневмония превалирует во всех возрастных группах, но большей частью у детей с 6 месяцев жизни до 5 лет, а у подростков почти в половине случаев пневмония обусловлена атипичной флорой [20].
Действительно, диагностика атипичной пневмонии может представлять определенные сложности. Однако современные российские и зарубежные согласительные документы уделяют этому немало внимания. Прописаны такие клинические критерии, как отсутствие выраженной интоксикации на фоне фебрильной лихорадки, наличие гиперемии конъюнктив, при аускультации обычно выслушиваются сухие, часто рассеянные хрипы или даже бронхообструкция, лабораторные показатели, как правило, без реакции маркеров бактериального воспаления, а на начальных этапах болезни отсутствуют специфические антитела. Также описаны значительные рентгенологические отличия типичной и атипичной пневмонии [21]. К слову сказать, практикующие врачи вообще чаще сталкиваются с описанием рентгеновских снимков, нежели с самим изображением, а потому им приходится просто ориентироваться на указание наличия инфильтративных изменений в легких.
Помимо дифференциально-диагностических критериев большинство национальных клинических рекомендаций уделяют особое внимание рационализации подходов к системной антибактериальной терапии.
В большинстве стран они едины, т.к. опираются на популяционные данные спектра значимых возбудителей пневмонии, циркуляцию резистентных штаммов в различных регионах, а также их чувствительность к противомикробным препаратам с учетом законов формирования антибиотикорезистентности [22].
Как в России, так и за рубежом у детей старше 6 месяцев препаратом выбора лечения типичной ВП является амоксициллин как антибиотик, обладающий наибольшей активностью, главным образом в отношении пневмококка. Амоксициллин назначается в дозе от 45 мг/кг/сут, при вероятности инфекции резистентными штаммами пневмококка доза увеличивается до 90 мг/кг/сут [9, 23, 24]. Однако на деле, в частности в амбулаторной практике лечения нетяжелых пневмоний, выбор падает либо на макролиды и оральные цефалоспорины III поколения, практически не действующие на пневмококк, либо на защищенные аминопенициллины, что нерационально ввиду неспособности пневмококка вырабатывать β-лактамазу [19]. У детей до 6 месяцев ввиду особенностей флоры, а также у детей более старшего возраста, не привитых от гемофильной инфекции, и при подозрении на нее в качестве стартового лечения назначается амоксициллин/клавуланат в дозе 45–90 мг/кг/сут по амоксициллину. Назначение защищенного амоксициллина оправданно также в случае тяжелой или осложненной пневмонии или при неэффективности стартового амоксициллина [10].
При доказанной аллергической реакции в анамнезе на препараты пенициллинового ряда в качестве стартового антибиотика назначают цефалоспорины II поколения или цефтриаксон парентерально. Лишь в случае аллергической реакции у ребенка на все β-лактамные антибиотики лечение целесообразно начинать с макролидов. Причем выбор падает на джозамицин, т.к. резистентность пневмококков к 16-членным макролидам развивается реже, чем к 14- и 15-членным [25].
Эффективность антибактериальной терапии при нетяжелой пневмонии обычно оценивается в течение 36 часов с момента приема амоксициллина или амоксициллин/клавуланата, хотя, как правило, температура падает уже после первой дозы антибиотика. Неэффективность β-лактамов в большинстве случаев нетяжелых пневмоний связана с недиагностированной атипичной инфекцией. Поэтому в таких ситуациях или при изначальной характерной клинической картине атипичной пневмонии назначается антибиотик группы макролидов, также лучше 16-членный.
Невозможность дифференцировать типичную и атипичную пневмонии, особенно когда не может быть обеспечено динамическое наблюдение за ребенком, делает целесообразным одномоментное назначение амоксициллина и макролида [25].
Дети с тяжелой пневмонией должны быть госпитализированы, им показана стартовая парентеральная терапия амоксициллин/клавуланатом или при аллергии к нему – цефалоспоринами II–III поколений [10].
Согласительными документами большинства европейских стран и ВОЗ рекомендуется продолжительность лечения нетяжелой типичной ВП в течение 5–7 дней, 10-дневный курс антибактериальной терапии оправдан при тяжелом или осложненном течении. Атипичные пневмонии должны лечиться 7–14 дней в зависимости от возраста пациента [9, 14, 17].
Методы
Проведен ретроспективный анализ 140 случаев ВП у детей в возрасте от 9 месяцев до 17 лет, госпитализированных в отделение диагностики и восстановительного лечения ФГАУ «НМИЦ здоровья детей» Минздрава РФ с января 2016 по январь 2020 г. Целью исследования являлось улучшение эффективности дифференциальной диагностики острых воспалений легких в педиатрической практике. Для этого проводилась оценка этиологической структуры, оценивались возрастные особенности пневмоний, применение антибактериальной терапии на догоспитальном этапе и в стационаре, а также ее эффективность. Всем детям проводили общеклинический осмотр, рентгенографию органов грудной клетки, общий анализ крови с лейкоцитарной формулой, анализ крови на уровень С-реактивного белка, прокальцитонина и на уровень антител к хламидиям и микоплазме при подозрении на атипичную пневмонию. Статистический анализ проводили с помощью пакета программ IBM SPSS Statistics 20 (IBM SPSS Statistics for Windows, Version 20.0. Armonk, NY: IBM Corp.). Размер выборки предварительно не рассчитывали. Полученные данные проверяли на соответствие нормальному распределению с помощью критерия Шапиро–Уилка. Для описания средних величин определяли медиану (Me), 25-й и 75-й перцентили. Для сравнения качественных данных был применен метод хи-квадрата Пирсона, точный критерий Фишера. Полученные результаты считались статистически значимыми при р<0,05.
Результаты исследования
В рамках исследования были проанализированы данные 140 детей: из них у 82 (58,6%) диагностирована атипичная пневмония, у 58 (41,6%) – типичная. Динамика заболеваемости по годам представлена на рисунке.
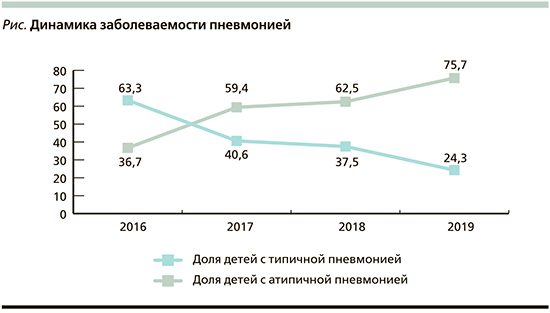
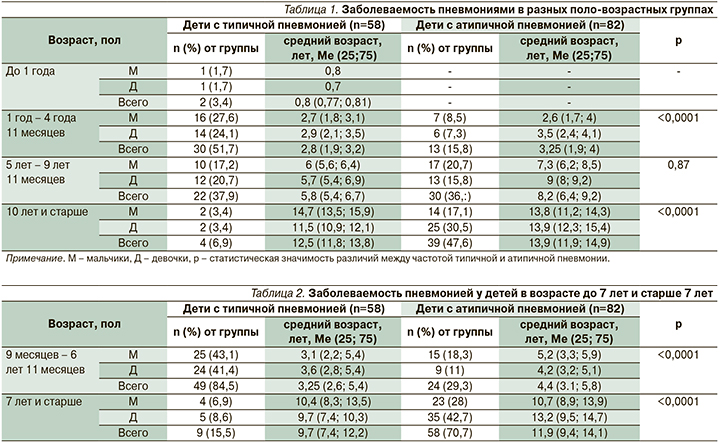
Максимальное число госпитализаций по поводу типичной пневмонии пришлось на возраст от года до 5 лет – 30 (51,7%) человек; с атипичной пневмонией, как правило, госпитализировались дети старше 10 лет – 39 (47,6%) детей . У детей от 5 до 10 лет частота типичной и атипичной пневмонии была примерно одинаковой и статистически значимой разницы выявлено не было. А при разделении детей на группы дошкольников (9 месяцев – 6 лет 11 месяцев) и школьников (7 лет и старше) картина оказалась достаточно показательной: у дошкольников преобладала типичная пневмония (84,5%), у школьников – атипичная пневмония (70,7%); p<0,0001. Различий заболеваемости по полу не наблюдалось.
Заболеваемость пневмониями в различных поло-возрастных группах представлена в табл. 1 и 2.
Из 140 госпитализированных детей 95 на догоспитальном этапе начали получать системный антибиотик: 39 (67,2%) из 58 детей с типичной пневмонией и 58 (70,7%) из 82 детей с атипичной пневмонией. В 32% случаев антибактериальная терапия была впервые назначена при поступлении в стационар.
Из детей, получавших антибиотик, в группе с типичной пневмонией 16 (41%) человек получали аминопенициллины, при этом 15 детей получали амоксициллин/клавуланат, из них в 5 случаях препарат был назначен в дозе ниже 45 мг/кг/сут, следовательно, не имел эффекта, и только один пациент получал амоксициллин, но в дозе в 2 раза ниже рекомендуемой (23 мг/кг/сут), в результате эффект также не был получен. При поступлении в стационар всем этим детям была скорректирована доза антибиотика и в 94% случаев был достигнут эффект в течение первых суток после коррекции.
Цефалоспорины на амбулаторном этапе получили 18 (46%) из 39 детей с типичной пневмонией, при этом почти в 48% случаев они оказались неэффективными. Двум детям был назначен цефуроксим/аксетил, однако в связи с низкой дозой препарат оказался неэффективным, шестеро получали оральные цефалоспорины III поколения (цефиксим) также безуспешно, и 10 человек получали парентеральные цефалоспорины III поколения (цефотаксим, цефтриаксон) в адекватной дозе с быстрым снижением температуры на фоне лечения. Дети, получавшие цефалоспорины без эффекта, а также те, которые получали парентеральные цефалоспорины, после снижения температуры во время госпитализации были переведены на пероральный прием амоксициллин/клавуланата в дозе 60–90 мг/кг/сут, 15 (83%) вскоре были выписаны домой с улучшением на амбулаторное долечивание.
Четыре (10,2%) ребенка из 39 до госпитализации получали макролиды (3 – азитромицин, 1 – мидекамицин), эффекта не было ни у кого, поэтому в стационаре все получили амоксициллин/клавуланат в дозе 50–90 мг/кг/сут с быстрым положительным эффектом в 100% случаев.
Один ребенок до госпитализации получил сразу три антибиотика последовательно: мидекамицин, цефипим и меропенем. На фоне меропенема у него упала температура уже в стационаре, но через сутки снова поднялась с развитием метаинфекционного плеврита вследствие поздно начатого эффективного лечения.
У 4 (10%) детей, получавших антибиотик, на момент госпитализации отмечалось тяжелое течение пневмонии. Из них один поступил на низкой дозе амоксициллин/клавуланата, увеличение дозы не дало эффекта, он был с успехом переведен на ванкомицин. Еще один ребенок поступил на цефиксиме, в отделении переведен на цефтриаксон также без эффекта и в итоге температура упала при применении ванкомицина. Один ребенок получал низкую дозу цефуроксим/аксетила, в отделении переведен на амоксициллин/клавуланат с меропенемом без положительной динамики, эффект наступил на ванкомицине. И четвертый ребенок поступил на цефтриаксоне, у него не купировалась лихорадка и в отделении лечение было усилено амикационом с положительным эффектом.
Из госпитализированных 82 детей с атипичной пневмонией 58 (70,7%) поступили на фоне антибактериальной терапии: 22 (37,9%) ребенка получали аминопенициллины, из них в дозе ниже 45 мг/кг/сут или неизвестной – 11 детей. Также 22 ребенка получали цефалоспорины (7 – цефиксим, 2 – цефуроксим аксетил, 13 – парентеральные цефалоспорины III поколения). Одному ребенку до госпитализации был назначен меропенем. Все эти дети продолжали лихорадить на момент поступления. В отделении лечение было изменено: применялись макролиды с быстрой положительной динамикой, 13 (22,4%) детей получали макролиды до госпитализации (3 – азитромицин, 6 – кларитромицин, 4 – джозамицин). Лишь у одного ребенка не было эффекта от применения азитромицина, который в стационаре был успешно заменен на джозамицин.
Таким образом, у детей с типичной пневмонией в 48,7% случаев на догоспитальном этапе сделаны неэффективные назначения антибиотиков (неверно назначенный стартовый антибиотик или низкая доза препарата), (табл. 3, 4). Эта тактика стала причиной тяжелого/осложненного течения пневмонии у 4 детей и госпитализации, которой можно было избежать, у остальных.
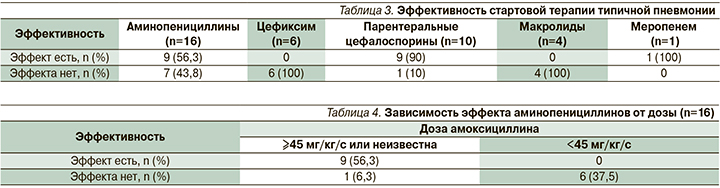
У детей с атипичной пневмонией в 75,9% случаев на амбулаторном этапе были сделаны априори неэффективные назначения β-лактамных антибиотиков (табл. 5).

Обсуждение
Обобщая полученные данные, можно сделать вывод о нарастании роли атипичных возбудителей в структуре ВП. Кроме того, за последние несколько лет все чаще стали встречаться пациенты с атипичной пневмонией в возрасте до 5 лет, что раньше было скорее исключением из правила. Одной из причин таких изменений может служить значительная активация иммунизации против пневмококковой инфекции, проводимой в России с начала 2015 г. [26].
Результаты нашего анализа показывают еще одну тенденцию. Участковые педиатры либо не имеют времени на проведение адекватной этиологической диагностики пневмонии, либо у них недостаточно знаний для ее осуществления. Ведь почти половина детей с типичной пневмонией и подавляющее большинство с атипичной получали неадекватную терапию. С одной стороны, есть определенные положительные моменты, в частности, при типичной инфекции реже стали назначать препараты группы макролидов, а также выбор стартовой антибактериальной терапии большинства госпитализированных детей с типичной этиологией пневмонии соответствовал клиническим рекомендациям (амоксициллин, амоксициллин/клавуланат). С другой стороны, недопустимо, что 66% пациентов, получавших антибактериальную терапию на амбулаторном этапе, лечились неэффективно. Сохранение лихорадки при пневмонии на фоне лечения аминопенициллинами в большинстве случаев говорит не об их неэффективности, а об атипичном возбудителе этой пневмонии. Поэтому отсутствие положительной динамики на фоне лечения адекватными дозами должно стать причиной не для парентерального применения цефалоспоринов, а для коррекции дозы или смены антибиотика на макролид.
Заключение
Пневмококк до сих пор остается ведущим фактором развития пневмонии вообще и тяжелой/осложненной в частности, аминопенициллины, согласно клиническим рекомендациям стран Европы и Америки, служат препаратом выбора для лечения типичной ВП как пневмококковой, так и гемофильной этиологии благодаря наибольшей активности в отношении этих возбудителей и безопасности применения. Оральные формы современных антибиотиков обладают высокой биодоступностью и стоят в приоритете для лечения бактериальных респираторных инфекций. Большинство детей с пневмококковой нетяжелой пневмонией должны получать амоксициллин в адекватной дозировке. Препарат существует как в таблетированной, так и в форме суспензии для приема внутрь. Детям первых 6 месяцев жизни, не привитым от гемофильной инфекции, а также с тяжелой пневмонией в качестве стартового антибиотика показан амоксициллин/клавуланат в дозе 45–90 мг/кг/сут. При достижении эффекта на парентеральном введении через 2–3 дня можно переходить на пероральную форму препарата.
Постоянное обновление информации, рост антибиотикорезистентности бактериальных возбудителей, смена циркулирующих штаммов в различных регионах заставляют педиатра постоянно быть в курсе темы, отслеживая публикации в литературе, лекции, а также постоянно совершенствовать подходы к диагностике и лечению различных нозологий, строго следуя клиническим рекомендациям. Именно тогда сократится как число госпитализаций, так и время, проведенное пациентом в стационаре.



