Введение
Остеоартрит (ОА) является одним из самых распространенных хронических неинфекционных заболеваний среди населения старшей возрастной группы и характеризуется прогрессирующей деградацией хрящевой ткани суставов, повреждением субхондральной части кости и синовиальной оболочки, что проявляется болью, ограничением движений, мышечной слабостью, нарушением функции и снижением способности к выполнению ежедневной двигательной нагрузки в повседневной жизни.
Эпидемиология
Широкомасштабные эпидемиологические исследования, проведенные несколько десятилетий назад на основании клинических и рентгенологических критериев ОА, свидетельствуют о росте заболеваемости по мере увеличения возраста: от 1 до 10% среди людей моложе 30 и 40 лет соответственно и более 50% у лиц старше 60 лет. Приблизительно 80% населения старше 65 лет имеют рентгенологические признаки ОА [1, 2]. Исследование аутопсийного материала продемонстрировало, что изменения хряща в области суставных поверхностей наблюдались практически у всех людей старше 65 лет [3]. ОА развивается с одинаковой частотой как у мужчин, так и у женщин в возрасте 45–55 лет с постепенным преобладанием у женщин после 55 лет. Возможно, это связано с увеличением их предстоящей продолжительности жизни.
Классификация
Выделяют две основные формы ОА – первичный (идиопатический) и вторичный, обусловленный предшествовавшими заболеваниями, травмами, деформациями. Первичный ОА классифицируют также на генерализованный и локализованный (при поражении менее 3 суставов). Всем хорошо известны факторы риска первичного ОА, включающие различные заболевания и состояния (например, сахарный диабет, ожирение, климактерический синдром и др.), травмы, дисплазии и физические перегрузки, семейная предрасположенность и т.д.
Однако в последние годы стало принято выделять фенотипические субтипы болезни, например метаболический, возрастной, генетический, травматический и др. Такой подход к разделению первичного ОА на субфенотипы в большей степени обусловлен необходимостью разработки персонифицированной терапии заболевания.
Патогенез и патоморфология
Долгое время в качестве основной причины OA рассматривались биомеханические нагрузки на опорные суставы (коленные или тазобедренные). Вместе с тем метаболические факторы также способны осуществлять запуск повреждения гиалинового хряща. Большое значение в инициации воспаления в суставах принадлежит жировой ткани, которая, по сути являясь эндокринным органом, выделяет различные биоактивные молекулы, такие как провоспалительные цитокины (фактор некроза опухоли α – ФНО-α) и адипокины (резистин, висфатин, лептин, сывороточный амилоид А). Имеются убедительные доказательства того, что их избыточный синтез приводит к ускорению деградации хряща у пациентов с ОА [4].
Суставной хрящ представляет собой соединительную ткань, формируемую только одним типом клеток – хондроцитами, которые заключены во внеклеточный матрикс (ВКМ). Эти специ-фические клетки, составляя лишь 1% всего объема хряща, несут ответственность за состав и целостность ВКМ, обеспечивая его механические свойства и лубрикацию. ВКМ состоит из воды, коллагена (преимущественно типа II), протеогликанов и гидрофильных макромолекул [5]. Морфологическими признаками ОА служат объединение хондроцитов в кластеры, уменьшение объема хряща, формирование неровной суставной поверхности и кальцификация ВКМ [6]. Количество протеогликанов заметно снижается, структура коллагеновой сети нарушается. Эти изменения в хряще сопровождаются активацией ряда ферментов, таких как аггреканазы и коллагеназы (матриксные металлопротеиназы-1, -3, -8, -13). Также непосредственное участие в деградации хряща принимают провоспалительные цитокина (ФНО-α, интерлейкин-1β – ИЛ-1β, ИЛ-6) вследствие активации нуклеарного фактора κB (NF-κB) и толл-подобных рецепторов, контролирующих синтез матриксных металлопротеиназ [7]. Вместе с тем имеются доказательства того, что ФНО-α и ИЛ-1β способны вызывать апоптоз хондроцитов.
По сути, человеческий хрящ является постмитотической тканью, в которой фактически клеточный обмен отсутствует: хондроциты практически не делятся, находясь в физиологических условиях. Более того, ВКМ не имеет нервных окончаний и не васкуляризирован, что исключает появление новых клеток для компенсирования их недостаточности. Как следствие – фенотипическая стабильность, активность анаболических/катаболических процессов и выживание самих хондроцитов сллужат ключевым фактором поддержания хрящевой ткани в физиологических условиях.
Лечение ОА
На этих принципах основана патогенетическая терапия ОА, целью которой является уменьшение боли и улучшение функционального статуса пациента. Существует множество опций, которые используются в клинической практике для достижения поставленных задач, а именно:
- пероральные анальгетики (парацетамол, нестероидные противовоспалительные средства [НПВС] и слабые опиоиды);
- пероральные хондропротекторы – медленнодействующие болезнь-модифицирующие препараты (хондроитин, глюкозамин, диацереин, неомыляемые соединения сои и авокадо, гиалуроновая кислота – ГК);
- внутрисуставные введения глюкокортикостероидов (ГКС), ГК;
- местная терапия, включая гели, мази НПВС и капсаицин;
- нефармакологические методы (лечебная физкультура, аэробная гимнастика, силовые упражнения, электростимуляция, ортезирование);
- эндопротезирование суставов.
Европейское общество по изучению клинических и экономических аспектов остеопороза и остеоартрита (ЕSCEO – European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis) в 2014 г. опубликовало алгоритм ведения пациентов с ОА коленных суставов, который определяет последовательность действий практикующего врача c точки зрения выбора приоритета при назначении лекарственной терапии [8]. На первом этапе лечения предполагается назначать медленнодействующие симптом-модифицирующие противоартрозные препараты (глюкозамин и/или хондроитина сульфат) в сочетании с анальгетиками (если есть показания), а также местные НПВС. Второй этап предусматривает подключение НПВС системно внутрь в зависимости от степени риска развития желудочно-кишечных и сердечно-сосудистых осложнений при наличии коморбидной патологии. В отсутствие положительной динамики терапия может быть дополнена применением ГК и/или ГКС внутрисуставно. На третьем этапе планируется усиление обезболивающей терапии с помощью слабых опиоидных средств (включая трамадол) или антидепрессантов. Как правило, третий этап терапии предшествует эндопротезированию коленных суставов.
Если консервативная лекарственная терапия ОА врачам, оказывающим первичную медицинскую помощь в амбулаторных условиях, достаточно хорошо знакома, поскольку применяется уже на протяжении нескольких десятилетий, то для осуществления внутрисуставных инъекций требуется соблюдение ряда условий (наличие процедурного кабинета или малой операционной, аптеки, стерилизационной, обученного среднего медицинского персонала и т.д.) и обладание определенными навыками, полученными в результате освоения программ дополнительного профессионального образования.
Введение различных лекарственных средств локально (внутрисуставно) – один из эффективных способов терапии ОА, прежде всего гонартроза.
В клинической практике широко применяются ГКС, гиалуронаты, богатая тромбоцитами плазма. В последнее время дополнительно стали использоваться классические «хондропротекторы» (хондроитин сульфат). Очевидно, что время наступления клинического эффекта, его сила и продолжительность этих методов будут существенно различаться. Более того, не все лекарственные средства, вводимые внутрисуставно, могут быть использованы при том или ином фенотипе ОА.
Если обратиться к клиническим рекомендациям профессиональных организаций по профилактике и лечению ОА, опубликованным за последние 10 лет, то мы не найдем строго описанного алгоритма применения препаратов для внутрисуставного введения при ОА, а получим лишь сведения о преимуществах и недостатках конкретного метода лечения с точки зрения доказательной медицины.
В ряде рекомендаций проведен сравнительный анализ описанных методов, указывающий на относительное преимущество одних перед другими. Более того, между самими рекомендациями не существует согласованной позиции, что затрудняет получение обобщенных результатов в реальной клинической практике.
ГКС, пожалуй, наиболее часто используются в случаях, когда объективно имеют место выраженные синовиты коленных суставов, с которыми консервативными методами не удается справиться, а комплексная терапия НПВС системно и локально (мази, гели), физиотерапевтические процедуры и лечебная физкультура (гимнастика) не приносят ожидаемого эффекта. Вместе с тем продолжаются дебаты о целесообразности использования ГКС, поскольку уровень доказательности у них слабый, а число возможных побочных эффектов остается высоким. Также врачи хорошо осведомлены о недопустимости увлечения этим способом купирования воспаления в пораженных суставах. К основным рискам внутрисуставного введения ГКС относят инфекции и ускорение деградации гиалинового хряща при их частом применении.
P. Jüni et al. опубликовали Кокрейновский систематический обзор (2015), обобщивший результаты 27 клинических исследований – КИ (13 из которых были опубликованы после предыдущего обзора от 2005 г.) [9]. В наблюдении приняли участие 1767 человек с ОА коленных суставов. Для анализа были отобраны только рандомизированные или квазирандомизированные КИ с контрольной группой. Пациенты контрольной группы либо не получали никакой терапии (группа плацебо), либо пациентам вводили солевой раствор. Чаще внутрисуставно использовали триамцинолон (15 КИ), метилпреднизолон (7 КИ), эффекты других препаратов ГКС (преднизолон, декса- и бетаметазон, кортивазол) были описаны в единичных работах.
В четырех КИ дополнительно производился лаваж синовиальной жидкости, еще в четырех работах терапия ГКС сочеталась с введением ГК.
Оказалось, что ГКС более эффективно, чем в контрольной группе, уменьшали боль. Когда результаты лечения стратифицировали по продолжительности эффекта, наилучший ответ сохранялся в течение первых 2 недель, а затем снижался до уровня слабого к 13-й неделе после последнего введения ГКС. При этом различий между группами вмешательства и контроля к 26-й неделе не было отмечено. Иными словами, в отношении пациентов, которым ГКС применяли внутрисуставно, произошло снижение боли на 3 пункта по визуальной аналоговой шкале (ВАШ) через 1 месяц и на 2 пункта улучшилось физическое функционирование.
Таким образом, итогом двух мета-анализов (2006 и 2015 гг.) послужило утверждение авторов о том, что через 6 месяцев после применения ГКС внутрисуставно какого-либо положительного влияния на течение гонартроза не наблюдается.
Не менее обсуждаемым методом лечения ОА является вискосуплементация (термин, используемый в англоязычной литературе начиная с середины 1990-х гг.). В данном контексте речь идет о внутрисуставном введении ГК и ее дериватов (гиалуронатов). Обоснованием для их широкого применения стали исследования, которые показали возможность улучшения физико-химических свойств синовиальной жидкости при ОА крупных суставов. ГК (полисахарид) является одновременно главным компонентом хряща и синовиальной жидкости, обладает выраженными лубрикантными свойствами [10].
К настоящему времени проведено более 10 мета-анализов различных КИ, в которых изучались ближайшие и отдаленные эффекты ГК с различным молекулярным весом. N. Bellamy et al. (2006) опубликовали Кокрейновский систематический обзор, посвященный применению ГК и ее дериватов для лечения ОА коленных суставов [11]. В обзор были включены 76 КИ, длительность последующего наблюдения составила до 18 месяцев. В 40 КИ в качестве контрольной группы использовалась группа плацебо (солевые растворы или артроцентез), в 10 – внутрисуставное введение ГКС, в 6 – НПВС, в других – немедикаментозные методы лечения (физиотерапия, физические упражнения, артроскопия), 15 КИ были сравнительными, в которых изучалась эффективность различных коммерческих продуктов ГК.
В целом следует констатировать, что гиалуронаны можно считать эффективным средством при гонартрозе, применение которых приводило к существенному снижению интенсивности боли и улучшению функции. Длительность эффекта у гиалуронанов оказалась больше, чем у ГКС, хотя сам эффект был несколько отсрочен по времени. В рандомизированном исследовании AMELIA (2011) пациенты с гонартрозом наблюдались до 40 месяцев, а препараты ГК применялись в циклическом режиме [12]. Авторы сделали вывод, согласно которому клинический эффект ГК развивается быстрее у пациентов более молодого возраста с умеренными изменениями в хряще, соответствующие рентгенологической стадии-II по Келлгрену–Лоуренсу.
Экспериментальные и клинические исследования показали, что лучше снижают боль в суставе препараты с молекулярным весом от 500 тыс. до 4 млн дальтон (например такие, как Ферматрон 1% – 1 млн дальтон или Ферматрон Плюс 1,5% – 2 млн дальтон). В отношении побочных эффектов имеются сведения о том, что применение ГК может вызывать обострение артрита (вплоть до псевдосептических реакций), но чаще подобные осложнения развиваются при использовании препаратов с высоким молекулярным весом. В других исследованиях различий в частоте побочных эффектов между группами вмешательств и контроля продемонстрировано не было.
За последние 2 года в литературе появилось несколько публикаций о положительном влиянии на основные проявления ОА (боль и функцию) комбинированных препаратов или комплексного применения монопрепаратов для внутрисуставного введения, содержащих натриевую соль ГК и хондроитина сульфат. Так F. Rivera et al. (2016) представили результаты пилотного клинического исследования, в которое были включены 112 пациентов с гонартрозом II–III стадий по Келлгрену–Лоуренсу, средний возраст составил 65,4 года (от 44 до 88 лет) [13]. Пациенты получили 3 внутрисуставных инъекции комбинированного препарата, состоявшего из 40 мг ГК и 40 мг хондроитина сульфата в 2 мл с промежутком в 1 неделю. Интенсивность боли по шкале WOMAC (Western Ontario and McMaster University Arthritis Index) и потребность в анальгетиках оценивались в течение 6 месяцев наблюдения после последнего введения препарата. Боль статистически значимо уменьшилась уже через месяц, достигнув к 6-му месяцу максимального значения (от 52,1 мм на этапе включения в исследование до 20,5 мм по ВАШ через 6 месяцев). В 74% случаев терапия анальгетиками была отменена.
Еще одно пилотное исследование, проведенное E. Maheu et al. в 2010 г., продемонстрировало эффективность сочетанного применения ГК (12 мг/мл) и хондроитина сульфата (30 мг/мл) в краткосрочном периоде (3 месяца). Препарат также вводился трижды каждую неделю. В результате боль по ВАШ уменьшилась вдвое – с 61 до 29 пунктов [14].
Несмотря на то что механизмы действия хондроитина сульфата на хрящ остаются не до конца изученными, экспериментальные исследования показали, что молекула способна стимулировать продукцию протеогликанов хондроцитами и ингибировать экспрессию ИЛ-1, индуцированную металлопротеиназами и простагландином Е2. Вместе с тем хондроитина сульфат связывается с мономерами протеогликанов на суставной поверхности хряща, тем самым проявляя вязкоупругие и гидратационные свойства [15].
Необходимо отметить, что препараты хондроитина сульфата, выпускаемые в лекарственных формах для перорального применения, существенно уступают по эффективности парентеральным формам в виду более низкой биодоступности. Формы выпуска для перорального применения обладают значительно более низкой биодоступностью (8–10%) в сравнении с препаратами для парентерального введения (13–61%) (рисунок) [16].
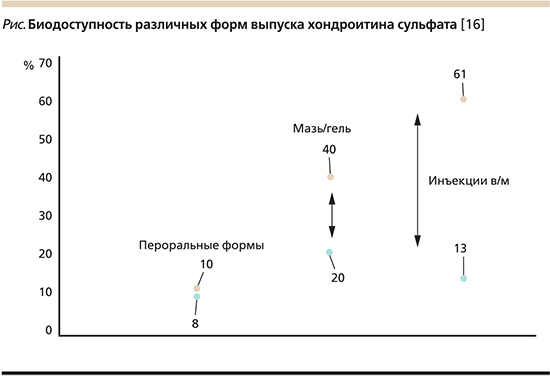
По мнению ряда исследователей, одной из причин низкой биодоступности хондроитина сульфата при пероральном применении может быть высокая биодеградация в кишечнике под влиянием кишечной микробиоты.
Было отмечено, что у здоровых добровольцев около 50% хондроитина сульфата при пероральном применении разрушалось кишечной микрофлорой [17].
Для таблетированного хондроитина сульфата стандартное время достижения максимальной концентрации в плазме крови составляет 3–4 часа, в синовиальной жидкости – 4–5 часов. Растворы хондроитина сульфата, предназначенные для внутримышечного введения (например, препарат Инъектран), позволяют действующему веществу достичь максимальной концентрации в системном кровотоке через 1 час, а в синовиальной жидкости препарат определяется уже через 15 минут [18]. Благодаря этой особенности, эффективность препарата наступает через 15–18 инъекций в отличие от пероральных форм, требующих более длительной курсовой терапии в течение 6 месяцев. Помимо биодоступности повысить эффективность позволяет увеличение приверженности больного к лечению в результате дополнительного контроля врача, выполняющего инъекции [19].
В последние десять лет обозначился повышенный интерес к использованию ростовых факторов из аутологичных тромбоцитов при их внутрисуставном введении для лечения ОА коленных суставов. Известно, что обогащенная тромбоцитами плазма обладает регенеративными свойствами и противовоспалительным потенциалом на процессы заживления тканей, включая ОА.
L. Shen et al. провели систематический обзор и мета-анализ 14 рандомизированных КИ (2017) для оценки действия обогащенной тромбоцитами плазмы на боль и функцию при ОА коленных суставов. В мета-анализ вошли данные о 1423 пациентах. Исследование показало преимущество обогащенной тромбоцитами плазмы перед внутрисуставным введением ГК, ГКС, солевых растворов, озона через 3–12 месяцев после последней процедуры [20].
Заключение
Таким образом, при прогрессирующем характере ОА коленных суставов, когда консервативными методами лечения не удается достигнуть желаемого результата, возникает целесообразность обратиться к инвазивным внутрисуставным, внутримышечным или периартикулярным введениям активных препаратов, таких как ГКС, ГК (Ферматрон), хондроитина сульфат (Инъектран), обогащенная тромбоцитами плазма. В отношении каждого из перечисленных средств имеются клинические доказательства их эффективности и безопасности.



