Введение
Периоперационная антибиотикопрофилактика рекомендована к применению при родоразрешении путем кесарева сечения (КС), поскольку рутинное профилактическое использование антибиотиков снижает риск возникновения послеоперационных инфекционных осложнений более чем на 50% [1]. Интенсивно проводятся исследования, направленные на оптимизацию протоколов антибиотикопрофилактики. В то же время использование схем антибактериальной профилактики у женщин, которым выполняется родоразрешение путем КС, в 10 % случаев отмечаются осложнения в виде раневой инфекции в области хирургического вмешательства (ИОХВ), а более чем у 15% женщин эти осложнения проявляются развитием лихорадки [2].
Возникают закономерные вопросы: почему так происходит, что мы упускаем из виду?
Общепризнанно, что промежуточной целью периоперационной антибиотикопрофилактики является достижение терапевтического уровня антибактериального препарата в тканях до начала хирургического вмешательства и бактериального заражения. В хирургической практике антибиотики с профилактической целью практически всегда вводятся перед разрезом кожи. Однако в акушерстве антимикробные препараты, как правило, вводятся после пережатия пуповины вследствие теоретически возможного риска негативного влияния антибиотика на плод, что сопровождается сложностью выявления неонатальной инфекции [3]. Результаты ряда исследований последних лет свидетельствуют о том, что беспокойство по поводу риска применения антибактериального препарата для плода необоснованно и антибиотики могут вводиться при КС перед выполнением разреза без негативных последствий [4, 5]. В то же время до настоящего времени не выработано единого мнения относительно срока введения антибиотика с профилактической целью при плановом КС.
Цель исследования: сравнить инфекционные осложнения после абдоминального родоразрешения и здоровье новорожденных у женщин, получивших цефазолин 2,0 г с профилактической целью до разреза кожи и интраоперационно после пережатия пуповины.
Материал и методы
В исследование были включены 410 женщин, которым выполнялось родоразрешение в плановом порядке путем операции КС.
Критерии включения в исследование: возраст беременной >18 лет и наличие показаний к выполнению родоразрешения в плановом порядке путем операции КС. Критерии невключения: наличие заболеваний почек и печени, сахарный диабет, анемия, ожирение (индекс массы тла ≥25 кг/м2), излитие околоплодных вод, прием лекарственных препаратов влияющих на фармакодинамические и фармакокинетические показатели цефазолина, наличие гиперчувствительности к цефазлолину.
Все беременные дали информированное согласие на участие в исследовании.
Пациентки в период проведения исследования были рандомизированы в 2 группы – по 205 пациенток в каждой:
- беременным группы 1 перед началом выполнения КС внутривенно вводили однократную дозу цефазолина 2,0 г за 30 минут до осуществления разреза кожи;
- беременным группы 2 вводили цефазолин 2,0 г внутривенно интраоперационно после извлечения плода и пережатия пуповины.
Последующее наблюдение проведено до выписки родильницы из акушерского стационара.

Средний возраст пациенток, включенных в исследование, составил 27,2±5,8 года (от 22 до 35 лет), 92,9% беременных были родоразрешены путем операции КС при сроке гестации 39 полных недель. Среднее время операции варьировалось от 30 до 35 минут. Извлечение ребенка происходило в среднем на 3-й минуте.
В нашем исследовании наличие рубца на матке было одним из самых распространенных показаний к КС (у 58,5% женщин). Другими показаниями послужили перенашивание беременности и отсутствие биологической готовности организма к родам, тазовое предлежание относительно крупного плода, заключение офтальмолога и др.
Исследуемые параметры: паритет, характеристики периода гестации, частота интра- и послеоперационных осложнений КС (эндометрит, лихорадка, раневая инфекция, инфекции мочевой системы), частота развития инфекционных заболеваний у новорожденных. Оценена продолжительность нахождения пациентки и новорожденного в родильном доме.
Влияние антибиотика на состояние новорожденного оценивали по ряду признаков, в т.ч. по наличию перио-дической диареи, сыпи, признакам неонатального сепсиса в сочетании с положительной гемокультурой.
Статистическая обработка выполнена с использованием пакетов программ Statistica 10.0. Оценку достоверности различий между качественными показателями сравниваемых групп проводили с помощью χ2-критерия. Оценку различий количественных показателей в группах больных (после проверки распределения признаков на соответствие закону нормального распределения по критерию Колмогорова–Смирнова) осуществляли с помощью непараметрического U-критерия Манна–Уитни. Критический уровень достоверности нулевой статистической гипотезы принимали равным 0,05. Для показателей частоты осложнений был рассчитан уровень относительного риска (ОР) с 95% доверительным интервалом (ДИ).
Результаты исследования
При сравнении показателей пациенток разных групп не было выявлено значимых различий социально-демографических характеристик. Группы женщин были сопоставимыми по возрасту, массо-ростовым показателям, паритету, сроку беременности, уровню гемоглобина, объему кровопотери и периоперационной инфузии. Во всех без исключения случаях методом обезболивания была регионарная анестезия, лапаротомия проводилась по Пфанненштилю, КС выполнялось путем поперечного разреза в нижнем маточном сегменте.
Оценка частоты послеоперационных инфекционных осложнений показала, что раневая ИОХВ наблюдалась у 9 (4,4%) женщин в группе 1, в группе 2 – в 10 (4,9%) случаях (табл. 1). ОР развития этого осложнения составил 0,5 (95% ДИ –0,13–1,99), т.е. был незначительным.
Послеродовая лихорадка наблюдалась у 11 (5,4%) женщин в группе 1, в группе 2 – у 13 (6,3%) пациенток, хотя значимых различий при этом выявлено не было (p=0,177). Послеоперационный эндометрит был зафиксирован у 6 (2,9 %) пациенток группы 1, тогда как в группе 2 – в 9 (4,4 %) случаях. Значимых различий при этом выявлено не было (p=0,623). ОР развития этого осложнения составил 1,80 (95 % ДИ – 0,61–5,33).
Общая частота осложнений в группе 1 составила 12,7%, тогда как в группе 2 была несколько выше – 15,6%, хотя значимых межгрупповых различий при этом выявлено не было (p=0,723).
У 5 родильниц (у 2 пациенток в группе 1 и у 3 женщин в группе 2) наблюдалось расхождение швов, что продлило их пребывание в родильном доме. Всем родильницам с послеоперационными инфекционными осложнениями (26 пациенток в группе 1 и 32 в группе 2) была назначена антибактериальная терапия.
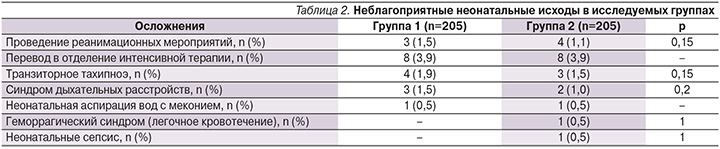
В группе 410 новорожденных, родившихся у 410 матерей, включенных в исследование, реанимация потребовалась 7 новорожденным: 3 (1,5 %) в группе 1 и 4 (1,1 %) детям в группе 2 (табл. 2).
После абдоминального родоразрешения 16 новорожденных – по 8 (3,9%) в каждой группе, были переведены в отделение интенсивной терапии. Ни у одного из новорожденных не наблюдалось признаков непосредственного негативного действия антибиотика, таких как сыпь или периодическая диарея. У 1 (0,5%) новорожденного в группе 2 был выявлен неонатальный сепсис, при этом высевалась положительная гемокультура (0,5%).
Средняя продолжительность пребывания в клинике составила 5,3 суток в обеих группах, минимальный срок – 5 дней, максимальный – 15. Причиной более длительной госпитализации стало либо полное расхождение швов, либо длительное нахождение новорожденных в отделении интенсивной терапии.

Обсуждение
Периоперационная антибиотикопрофилактика давно доказала свою эффективность в отношении снижения частоты инфекционных осложнений у пациентов высокого и низкого операционных рисков. В наше исследование были включены исключительно женщины с низкой вероятностью развития инфекции, которым выполнялось плановое абдоминальное родоразрешение, проведенное перед началом схваток, и с неповрежденным плодным пузырем.
Основанием к применению использованного в работе антибиотика служат приказ Минздрава РФ № 5 72н от 01.11.2012 и клинические рекомендации «Кесарево сечение, показания, методы обезболивания, хирургическая техника, антибиотикопрофилактика, ведение послеоперационного периода» (2014). Однако до настоящего времени не выработано единого мнения по поводу срока профилактического введения антибиотика при КС.
В акушерской практике нередко вводят антимикробный химиопрепарат интраоперационно после пережатия пуповины, чтобы не допустить влияния антибиотика на плод. Однако результаты исследований последних лет показали, что введение антибиотика за 30 минут до выполнения разреза кожи способствует снижению риска инфекционных осложнений без негативных последствий для плода [1].
При мета-анализе даных трех современных рандомизированных контролируемых клинических исследований, в которых приняли участие около 1000 беременных, было выявлено снижение общего уровня инфекций на 50% при использовании с профилактической целью цефалоспоринов до начала операции, уменьшение частоты развития эндометрита на 53% и статистически незначимое снижение частоты раневых инфекций по сравнению с соответствующими показателями в группах пациенток, которым антибиотик вводился после пережатия пуповины [3]. В настоящем исследовании не было выявлено выраженного снижения риска возникновения ИОХВ при введении цефазолина до разреза кожи по сравнению с пациентками группы 2 с интраоперационным введением цефазолина после пережатия пуповины.
В двойном слепом рандомизированном контролируемом клиническом исследовании B.D. Thigpen (2005) при участии 302 беременных была выявлена более высокая частота случаев эндометрита (14,7%) в группе интраоперационного введения антибиотика цефалоспоринового ряда, чем у пациенток, которым проводилось дооперационное введение антибактериальных препаратов (7,8%) [8]. Частота раневой инфекции в исследуемых группах составила 5,4 и 3,9% соответственно, значимых межгрупповых различий по частоте послеоперационных инфекционных осложнений выявлено не было.
В исследование S.M. Owens (2009) были включены 9010 беременных, при этом 4781 пациентке группы 1 дооперационно введен цефалоспорин, 4229 пациенткам группы 2 проведено интраоперационное введение препарата. Установлено, что профилактическое введение антибиотика в группе 1 по сравнению с группой 2 приводило к снижению частоты развития послеродового эндометрита (3,9 и 2,2%), а также уменьшению уровня раневых инфекций (3,6 и 2,5%) [7].
В рандомизированном контролируемом клиническом исследовании S.A. Sullivan (2007) с включением 357 беременных (175 пациенткам в группе 1 дооперационно вводили цефалоспорин, 182 пациенткам группы 2 выполнялось интраоперационное введение антибиотика) послеоперационный эндометрит был выявлен у 5% родильниц в группе 2 и у 3% родильниц группы 1 [6]. В данном исследовании было выявлено значимое снижение уровня послеоперационных инфекционных осложнений после абдоминального родоразрешения в группе с дооперационным введением антибиотика по сравнению с соответствующим уровнем данного показателя в группе с введением антибиотика после пережатия пуповины.
В рандомизированном контролируемом клиническом исследовании A. Witt (2011) 1112 беременных были разделены на три группы (группа 1 – 370 пациенток, получивших дооперационно цефалоспорин, группа 2 – 371 женщина, которой препарат вводился после пережатия пуповины, группа 3 – пациентки, получавшие физиологический раствор перед выполнением КС). В группах 1 и 2 частота раневых инфекций составила 2,4%, послеоперационного эндометрита – 0,3% [9].
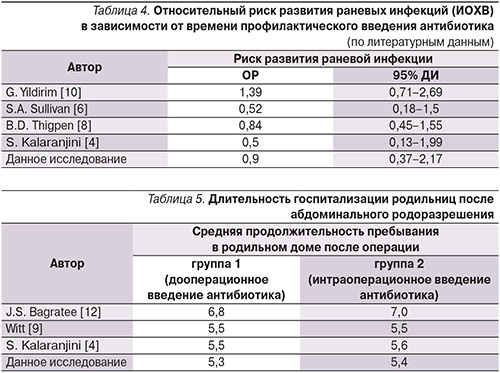
Следует отметить, что значимых различий показателей в группах родильниц не наблюдалось, за исключением исследований S.A. Sullivan [6] и S.M. Owens [7], в которых уровень риска развития раневых ИОХВ, когда антибиотик был введен до разреза кожи, снижен по сравнению с соответствующим значением у пациенток, которым антибиотик вводился после пережатия пуповины (табл. 3, 4). В то же время следует отметить, что вышеупомянутые исследования включали случаи как планового, так и экстренного выполнения КС.
В настоящем исследовании риск раневых ИОХВ был несколько снижен в группе 1, получившей цефазолин до кожного разреза, по сравнению с соответствующим уровнем в группе 2, получившей антибиотик во время операции после извлечения плода и пережатия пуповины. При этом значимых межгрупповых различий выявлено не было.
Частота развития раневых ИОХВ, выявленная в данном исследовании, была ниже соответствующих уровней, полученных в вышеприведенных рандомизированных клинических исследованиях. Возможно, это было обусловлено включением в наше исследование женщин с низким операционным риском, а также тем, что плановая операция проходила со строгим соблюдением правил асептики и антисептики. Другой причиной мог послужить тот факт, что большинство родильниц были выписаны на 5-й день и инфекции, возникшие позже, при нахождении пациенток вне родильного дома, не были включены в исследование.
В исследовании L.O. Alekwe (2008) было выполнено сравнение эффективности однократной и многократных доз цефтриаксона в отношении профилактики послеоперационных инфекционных осложнений. При этом частота развития лихорадки составила 7% в группе 1 и 6% у пациенток группы 2 [11].
В исследовании J.S. Bagratee (2001) была оценена эффективность профилактического введения антибиотиков при выполнении планового КС; риск послеоперационных инфекционных осложнений, лихорадка наблюдались у 8,3% пациенток [12].
По результатам нашего исследования инфекции мочевой системы у обследованных родильниц зафиксированы не были, что обусловлено, вероятно, тем, что все женщины были обследованы на наличие бессимптомной бактериурии до родов. При этом операция и профилактическая катетеризация мочевого пузыря не могли спровоцировать развитие инфекции. По результатам нашего исследования 3,9% новорожденных потребовался перевод в отделение интенсивной терапии, что было сопоставимо с данными, представленными другими авторами [4, 6, 8].
У одного новорожденного группы 2 был выявлен неонатальный сепсис с положительной гемокультурой.
В целом полученные результаты свидетельствовали о том, что профилактическое применение антибиотика, введенного до разреза кожи, не оказывало неблагоприятного влияния на развитие неонатальной инфекции и не вызывало необходимости проведения новорожденному мероприятий интенсивной терапии.
Продолжительность нахождения в родильном доме после КС при проведении данного исследования также была сопоставимой с данными A. Witt [9], S. Kalaranjini [4], при этом значимых отличий показателей в представленных исследованиях отмечено не было (табл. 5).
Заключение
Данные, полученные в результате выполнения нашего исследования, показали, что срок профилактического введения цефазолина (30 минут) до выполнения кожного разреза или после пережатия пуповины при плановом абдоминальном родоразрешении существенно не влияет на риск развития послеоперационных инфекционных осложнений. Наши результаты согласуются с мнением большинства исследователей о том, что цефазолин, несмотря на длительное использование в акушерской практике, остается препаратом выбора для профилактики ИОХВ при КС. В то же время эффективность и безопасность предлагаемой схемы применения препарата – доза 2,0 г за 30 минут до разреза кожи с целью профилактики послеоперационного эндометрита – требуют дальнейшего изучения.
Результаты проведенного исследования свидетельствуют об отсутствии повышенного уровня риска развития неонатального сепсиса у пациенток обеих групп. При этом в связи с отсутствием негативного влияния на плод и новорожденного в группе пациенток, которым антибиотик вводился до операции, теоретическая возможность перехода в торпидное течение неонатального инфекционного заболевания, на наш взгляд, отсутствует. Дальнейшие исследования в данной сфере могут проводиться без опасений наличия отрицательного влияния антибиотиков на плод до рождения.



