Недостаточность антител представляет гетерогенную группу заболеваний, преимущественно первичные иммунодефицитные состояния (ПИДС). За последние 20 лет описано 18 генетических дефектов, ведущих к развитию первичных дефицитов гуморального звена иммунитета, однако не идентифицированы генетические дефекты, обусловливающие гипогаммаглобулинемию и селективные дефициты антител [1, 2].
Основой патогенетической терапии во многих случаях служит пожизненная заместительная терапия препаратами иммуноглобулинов (Ig), не имеющая альтернативы при данной патологии [3, 4].
Введение нативной плазмы (15–20 мл/кг каждые 2–4 недели) – наименее предпочтительный ее вариант, поскольку сопряжен с высоким риском вирусной трансмиссии, нежелательных лекарственных реакций, а также с трудностями в подборе постоянного донора. Относительно новым направлением заместительной терапии при первичных дефицитах антител является применение препаратов иммуноглобулинов для подкожного введения, однако они на сегодняшний день достаточно труднодоступны. Таким образом, основным методом лечения данной патологии на текущий момент остается использование иммуноглобулинов для внутривенного введения (ВВИГ).
Наиболее распространенные формы патологии, требующие назначения ВВИГ: [4]:
1. Дефициты антител:
- Х-сцепленная агаммаглобулинемия;
- общая вариабельная иммунная недостаточность;
- гипер-IgM-синдром;
- транзиторная младенческая гипогаммаглобулинемия (отдельные случаи);
- дефициты отдельных классов (селективный дефицит IgA) и подклассов (IgG 1–4) антител;
- нарушение синтеза антител нормальными В-лимфоцитами.
2. Комбинированные иммунодефи-циты:
- все типы тяжелой комбинированной иммунной недостаточности.
3. Другие хорошо известные синдромы с иммунодефицитом:
- синдром Вискотта–Олдрича;
- синдром Луи–Бар;
- синдром Ниймеген;
- синдром Ди Джорджи;
- первичный дефицит CD4.
4. Болезни иммунной дизрегуляции:
- Х-сцепленный лимфопролиферативный синдром.
Показания к назначению препаратов ВВИГ больным ПИДС:
1. Лабораторное подтверждение дефицита антител:
- агаммаглобулинемия (уровень IgG < 200 мг/дл);
- персистирующая гипогаммаглобулинемия (уровень IgG < 400 мг/дл или по крайней мере уровень ниже нормального на два стандартных отклонения не менее чем при двукратном определении);
- отсутствие В-лимфоцитов.
2. Документированная неспособность к адекватному иммунному ответу на антигены:
- отсутствие 4-кратного и более нарастания титра антител в ответ на полисахаридные антигены (например, пневмококковая вакцина) на 50 % и более тестируемых серотипов;
- отсутствие 4-кратного и более нарастания титра антител в ответ на протеиновые антигены (например, дифтерийно-столбнячная вакцина) через 3–4 недели после введения.
3. Персистирующие и тяжелые инфекции, несмотря на профилактическое применение антибиотиков.
С учетом пожизненной потребности в ВВИГ особую значимость приобретает проблема безопасности препаратов. Требования к современному препарату ВВИГ заключаются в следующем [5]:
- оптимальный спектр антител в соответствии с инфицированностью населения (более 1000 доноров);
- доказательства эффективности с помощью контролируемых клинических исследований;
- распределение IgG аналогично крови;
- декларирование содержания антител для каждой партии;
- малое содержание макроагрегатов (менее 1 % от общего содержания иммуноглобулина G);
- антикомплементарная активность < 1,0 СН50 1 мг белка;
- отсутствие гемолизинов, титр АВ-антител менее 1 : 8;
- отсутствие активаторов калликреина, консервантов, активированных энзимов, токсических веществ;
- максимально низкое содержание IgА, если предусмотрено применение пациентами с врожденным дефицитом IgA;
- высокая противовирусная очистка.
Требования Всемирной организации здравоохранения к ВВИГ [5]:
- минимум 1000 порций крови;
- минимум 90 % IgG;
- чистый IgG;
- нативный IgG;
- нормальное деление IgG на подклассы;
- физиологический период полураспада;
- вирусная безопасность.
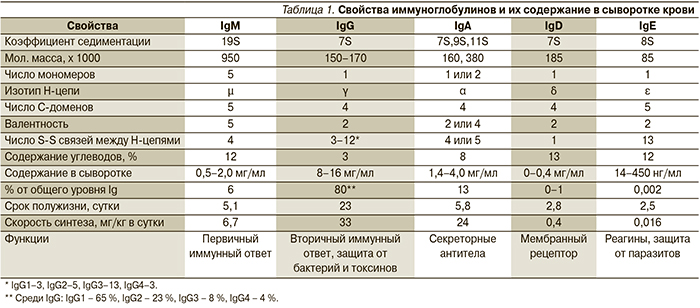
Свойства иммуноглобулинов и их содержание в сыворотке представлены в табл. 1.
Заместительную терапию с помощью ВВИГ рекомендуется проводить каждые 2–4 недели, вводя препарат в дозе 0,3–0,6 г/кг. Первая доза вводится медленно (0,5–1,0 мг/кг/мин) в виде раствора с концентрацией не более 5 %. При хорошей переносимости препарата через 15–30 минут скорость введения может быть повышена до 1,5–2,5 мг/кг (максимально – 4 мг/кг) в минуту. Продолжительность инфузии – 2–4 часа. Для последующих введений может быть использован 10-%-ный раствор, вводимый с максимальной скоростью [5].
Рекомендуемым сывороточным уровнем IgG, который должен быть достигнут в результате лечения, является концентрация 3,5–5,0 г/л [6, 7].
Принимая во внимание наличие на фармацевтическом рынке ряда ВВИГ, выбор конкретного препарата может быть затруднен.
Факторы, влияющие на выбор:
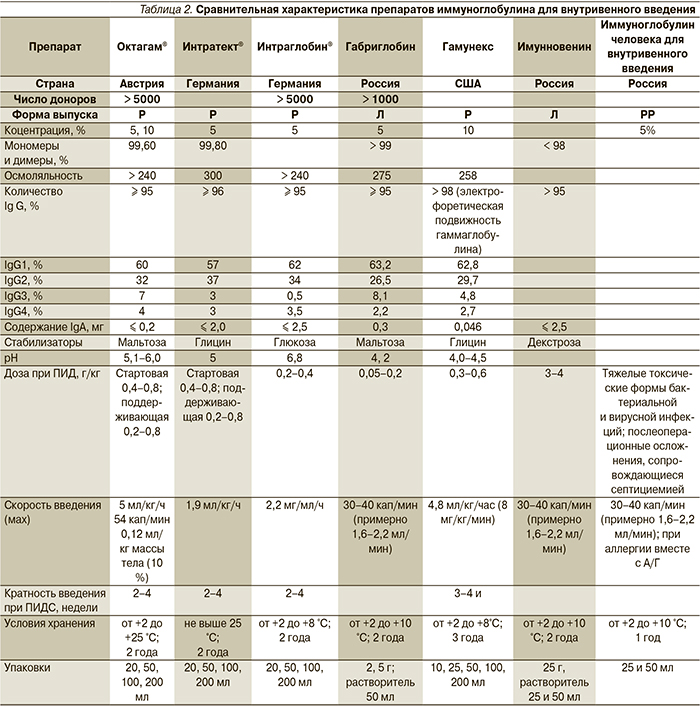
Наличие полной информации о препарате (раствор или лиофилизированный порошок, количество натрия, наличие IgA и IgG, сахаросодержащий стабилизатор, методы вирусной инактивации, концентрация, осмолярность). Сравнительная характеристика препаратов иммуноглобулинов для внутривенного введения представлена в табл. 2.
Безопасность и хорошая переносимость.
Цена.
Нежелательные лекарственные реакции при анализе 1000 случаев заместительной терапии синдрома агаммаглобулинемии отмечаются почти у половины больных [8].
Использование препаратов донорской крови представляет потенциальный риск с точки зрения трансмиссии вирусных инфекций, однако промышленные инактивационные методики в процессе производства препаратов минимизируют его.
Плохая переносимость препарата наиболее часто связана с нарушением режима введения (увеличение скорости введения или концентрации препарата). В большинстве случаев реакция развивается в течение часа после начала введения и протекает в легкой форме с проявлениями в виде тошноты, рвоты, лихорадки, гемодинамических нарушений. Данные 10-летнего проспективного наблюдения пациентов, получавших Иммуноглобулин человека нормальный, позволяют предположить полигенность побочных эффектов, развитие которых зависит не только от вводимого препарата, но и от показаний к его назначению [9].
Анафилактические и анафилактоидные реакции могут наблюдаться при использовании препаратов, содержащих IgA, пациентами с его врожденным дефицитом и обусловлены возможным наличием аутоантител к IgA. От IgA-содержащих препаратов следует также отказаться при лечении пациентов с общей вариабельной иммунной недостаточностью (ОВИН), поскольку показана возможность трансформации селективного дефицита IgA в ОВИН [10].
С точки зрения спектра иммуноглобулинов все препараты могут быть разделены на 2 группы:
- препараты, содержащие только IgG (остальные классы отсутствуют или не превышают 2 %, содержание IgA < 2,9 мкг/мл; предпочтительны для заместительной терапии при ПИДС с синдромом агаммаглобулинемии): Октагам, Интраглобин, Иммуновенин, Гамунекс, Интратект, иммуноглобулин человеческий нормальный для внутривенного введения, Габриглобин. При хорошей переносимости эти препараты взаимозаменяемы;
- препараты, которые могут содержать IgG, IgM и IgA: нативная плазма, Цитотект (иммуноглобулин человека антицитомегаловирусный), Пентаглобин, неогепатект (иммуноглобулин человека против гепатита B) [5]. При наличии у пациента антител к IgA это может быть причиной иммунного конфликта между ними и содержащимся IgA в препарате.
ВВИГ с высокой осмолярностью могут индуцировать тромботические явления, а также увеличивать риск сердечной недостаточности у больных с нарушениями сердечной деятельности, а калликреин-содержащие препараты могут приводить к повышению артериального давления. Относительно редкой, но возможной реакцией служит почечная недостаточность в ответ на содержащуюся в качестве стабилизатора сахарозу, в связи с чем подобные препараты не рекомендованы урологическим больным.
Заместительная терапия при синдроме агаммаглобулинемии связана с использованием высоких доз ВВИГ, что ассоциируется с риском обратимой почечной недостаточности, гемолиза, ДВС-(диссеминированное внутрисосудистое свертывание)-синдрома, гемолитической анемии, в редких случаях – асептического менингита. Патогенез гемолиза связывают с конфликтом по системе АВ0, гемолитическую анемия – с наличием анти-D-изоантигенов.
В числе отсроченных реакций отмечаются:
- асептический менингит (наблюдается редко и может быть связан с быстрой инфузией высоких доз ВВИГ больным с мигренозными головными болями в анамнезе);
- гемолитическая анемия, лейкопения, нейтропения, моноцитопения, ДВС-синдром и изменение реологических свойств крови;
- падение артериального давления (наиболее часто);
- острая почечная недостаточность при использовании сахарозы в качестве консерванта (по данным FDA – Food and Drug Administration – 88 случаев в течение 3,5 года);
- тяжелый кожный васкулит, дерматиты, выпадение волос;
- жизнеугрожающая парвовирусная инфекция В19, гиперпротеинемия, повышение вязкости крови, псевдогипонатриемия во время инфузии, сывороточная болезнь.
Таким образом, ВВИГ – одна из основных групп препаратов заместительной терапии при первичных дефицитах гуморального звена иммунитета. Несомненными достоинствами ВВИГ служат безболезненность введения, отсутствие протеолитического расщепления препарата, быстрое начало действия, простота дозирования, отсутствие риска асептических абсцессов. К недостаткам относятся высокая стоимость, инвазивность, продолжительность инфузии, риск нежелательных лекарственных реакций, в т.ч. анафилаксии.
Клинический случай
Больная Л. 29 лет обратилась с жалобами на субфебрильную температуру, поддающуюся терапии высокими дозами антибиотиков; частые респираторные инфекции; повышенную утомляемость, слабость, сонливость.
Описанные жалобы появились в возрасте 25 лет после острой респираторной вирусной инфекции (ОРВИ).
В дошкольном возрасте перенесла ветряную оспу и эпидемический паротит, осложненный пневмонией, в 6 лет – тонзиллэктомию по поводу хронического тонзиллита, в 10 лет – острый отит, в 12 лет – аппендэктомию. В возрасте 25–28 лет перенесла 3 средних отита; ОРВИ – более 6 эпизодов в год, потребовавших назначения антибактериальных препаратов, в т.ч. осложненные бронхитом – 1–2 раза в год. На фоне самостоятельного приема Бронхо-мунала, Ликопида, Имудона, Полиоксидония частота ОРВИ и потребность в антибактериальных средствах не уменьшились, но субъективно отмечено снижение тяжести симптомов ОРВИ. В 29 лет после гриппа развилась 2-сторонняя пневмония, осложнившаяся плевритом и ДВС-синдромом, потребовавшая госпитализации (парентерально цефотаксим, метронидазол; преднизолон, апротинин, пентоксифиллин). После выписки из стационара описанные жалобы сохранялись. Аллергических заболеваний нет. Консультирована фтизиатром, туберкулез исключен. Направлена на консультацию к врачу-иммунологу.
Семейный анамнез: аутоиммунная тромбоцитопения у сестры.
При обследовании: кожа чистая, бледная; температура тела – 37,6 ºС.
Рентгенография грудной клетки: усиление легочного рисунка в нижних отделах.
Бактериологический посев из зева: патогенная флора не выявлена.
Общий анализ крови: эритроциты – 4,1 х 109/мкл, гемоглобин – 122 г/л, лейкоциты – 8300 кл/мкл, моноциты – 8 %, эозинофилы – 2 %, палочкоядерные лейкоциты – 0 %, сегментоядерные лейкоциты – 69 %, базофилы – 1 %, лимфоциты – 20 %(1660 кл/мкл).
Иммунный статус: лейкоциты – 8300 кл/мкл, лимфоциты – 20 %(1660 кл/мкл), Т-лимфоциты – 78 % (1295 кл/мкл), CD4+-клетки – 47 % (780 кл/мкл), CD8+-клетки – 33 % (548 кл/мкл), CD19+ – 9 % (149 кл/мкл), IgA – 0 г/л, IgM – 0,16 г/л, IgG – 0,77 г/л (при повторном определении через неделю: IgA – 0,05 г/л, IgM – 0,05 г/л, IgG – 0,67 г/л), IgE – 0 МЕ/мл, фагоцитарный показатель – 88 %, фагоцитарное число – 2,02, НСТ (нитросиний тетразолий) спонтанный – 39, НСТ индуцированный – 40, индекс стимуляции – 1,03; ЦИК (циркулирующие иммунные комплексы) – 11 у.е.; СОЭ – 5 мм/ч.
Диагноз: общая вариабельная иммунная недостаточность.
Рекомендована заместительная терапия препаратами иммуноглобулинов для внутривенного введения. При введении 10 %-ного раствора ВВИГ с максимальной скоростью введения 0,12 мл/кг/ч зарегистрированы жалобы на боли в пояснице, умеренную тошноту, головную боль, которые устранялись при снижении скорости введения препарата и уменьшении расчетной дозы на одно введение. В среднем доза на одно введение составила 2,5 г ВВИГ. Уровень IgG после инфузии находился в пределах физиологических значений и снижался до уровня < 2,0 г/л к концу 4-й недели, что коррелировало с клиническим состоянием пациентки. К настоящему моменту пациентка получает препарат ВВИГ в течение 11 месяцев. За это время инфекционных осложнений, связанных с основным заболеванием, не было, потребность в антибактериальной терапии отсутствовала.



