Введение
Иммуноглобулин А-нефропатия (ИГАН) является наиболее распространенной формой первичного гломерулонефрита в мире, течение которой не всегда носит благоприятный характер в отношении сохранности почечной функции [1]. По нашим данным, около 20% пациентов достигают терминальной стадии почечной недостаточности, требующей почечно-заместительной терапии через 5 лет от момента установления диагноза [2].
Иммунопатогенез ИГАН характеризуется активацией как клеточного, так и гуморального звена иммунной системы. При этом, если роль классических αβТ и В-лимфоцитов в образовании агалактозилированного иммуноглоублина А (IgA) при ИГАН хорошо изучена, механизмы вовлечения минорных клеточных популяций как на начальных стадиях нарушения гуморального иммунитета, так и на поздних стадиях, характеризующихся цитотоксическим повреждением почечной ткани, до сих пор остаются объектом изучения [3]. Принимая во внимание многофакторный и до конца не изученный патогенез ИГАН, в настоящее временя отсутствует доступная специфическая терапия данного заболевания. В соответствии с клиническими рекомендациями по лечению гломерулонефритов инициативы по улучшению глобальных исходов лечения пациентов с хронической болезнью почек (KDIGO) необходимо начинать с назначения лекарственных средств, воздействующих на ренин-ангиотензиновую систему (РАС) пациентов с протеинурией (ПУ) выше 0,5 г/сут. независимо от наличия артериальной гипертензии (АГ) [4]. Однако не всем пациентам при таком подходе удается добиться клинико-лабораторной ремиссии, вследствие чего на следующем этапе лечения предполагается назначение глюкокортикостероидов (ГКС), которые в ряде клинических исследований показали значительный нефропротективный эффект, заключающийся в снижении уровня ПУ и риска прогрессирования хронической болезни почек (ХБП) [5–7]. За последнее десятилетие проведен ряд рандомизированных контролируемых исследований, показавших умеренный эффект ГКС на торможение снижения скорости клубочковой фильтрации (СКФ), но при этом высокий процент таких осложнений, как генерализованные инфекции, увеличение массы тела свыше 5 кг в течение курса терапии, нарушение толерантности к углеводам, сахарный диабет, о которых в предыдущих исследованиях не указывалось [8, 9]. В связи с этим в последнее время изучается ряд новых вариантов лечения, включая препараты, которые могут служить дополнением к поддерживающей терапии, например ингибиторы натрийглюкозного ко-транспортера-2, спарсентан, атрасентан, гидроксихлорохин (ГХХ).
ГХХ – противомалярийное лекарственное средство, производное 4-аминохинолина, обладает умеренным иммуносупрессивным действием. Это противовоспалительное свойство препарата используется при лечении ряда аутоиммунных заболеваний. В настоящее время ГХХ хорошо зарекомендовал себя в терапии системной красной волчанки, в частности люпус-нефрита [10]. Согласно результатам двух клинических исследований, проведенных в Китае, эффективность ГХХ по снижению уровня ПУ показана у пациентов c ИГАН [11, 12]. Целью нашей работы стала оценка клинической эффективности использования ГХХ по сравнению с ГКС для пациентов с ИГАН и влияния проводимого лечения на показатели клеточного и гуморального иммунитета.
Материал и методы
Проведено открытое проспективное контролируемое многоцентровое исследование, в которое были включены пациенты с гистопатологически верифицированным диагнозом ИГАН, наблюдавшиеся в нефрологических отделениях ГУ «Минский научно-практический центр хирургии, трансплантологии и гематологии» и УЗ «1-я городская клиническая больница» Минска в период с апреля 2019 по март 2022 г. Критерии включения: возраст старше 18 лет, наличие ПУ>1 г/сут. с/без микрогематурии, СКФ>50 мл/мин, отсутствие аллергической реакции на прием ГХХ или ГКС. Критерии исключения: быстропрогрессирующее течение ИГАН, определенное как снижение СКФ более чем на 30% за 3 месяца наблюдения, нефротический синдром, участие пациента в другом клиническом исследовании, проведенный ранее курс иммуносупрессивной терапии за 6 месяцев до включения в исследование, наличие в анамнезе трансплантации почки, вторичные формы ИГАН, беременность и лактация, а также наличие тубулярной атрофии/интерстициального фиброза, занимающих более 50% кортикальной зоны, и/или обнаружение клеточных или фиброзно-клеточных полулуний в 25% и более клубочков по результатам гистопатологического исследования почечной ткани.
После проведенного скрининга в исследование вошли 52 пациента с ИГАН (из них 34 мужчины, 18 женщин, средний возраст – 32 (27–36) года. Исходный уровень суточной ПУ составил 1800 (1000–1900) мг/сут., СКФ – 78 (61–103) мл/мин. Допустимым нормальным количеством белка считалось 0,15 г/ сут. Величину почечной функции оценивали по расчету СКФ на основании уровня сывороточного креатинина с использованием формулы CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration) [13]. Гематурию оценивали с помощью метода подсчета эритроцитов в поле зрения под большим увеличением при световой микроскопии с использованием окуляра 10× и объектива 40×, при этом микрогематурией считалась средняя величина более 5 эритроцитов в поле зрения.
Эффективность проводимого лечения оценивалась по частоте наступления клинико-лабораторной ремиссии, за которую принималось снижение уровня ПУ<0,5 г/сут. и стабильное состояние СКФ, тогда как отсутствие эффекта проводимого лечения характеризовалось сохраняющейся ПУ>1 г/сут. и/ или прогрессирующим снижением СКФ более чем на 30% от исходного уровня за 3 месяца.
На первом этапе исследования все пациенты получали лекарственные средства группы ингибиторов ангиотензинпревращающего фермента (иАПФ) или блокаторов рецепторов к ангиотензину II (БРА) в максимально переносимой дозировке и достижение цифр артериального давления 120/80 мм рт.ст. Через 3 месяца лечения с учетом уровня ПУ пациентов разделили на 3 группы. Первая группа (n=20), ПУ>1 г/сут., получала ГХХ, вторая группа (n=20), ПУ>1 г/сут., начала терапию ГКС и третья группа (n=12), ПУ<1 г/сут., продолжила лечение иАПФ/ БРА. Схема дизайна исследования представлена на рис. 1.
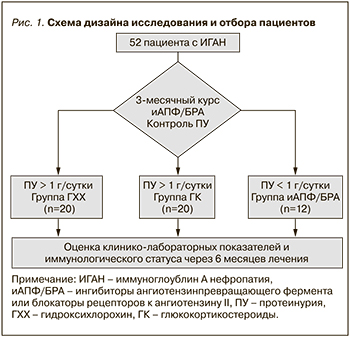
Протокол назначения ГКС включал пульс-терапию метилпреднизолона внутривенно по 1 г 3 дня подряд в начале 1-го, 3-го и 5-го месяцев лечения, которая комбинировалась с 6-месячным приемом метилпреднизолона внутрь из расчета 0,4 мг на кг массы тела по альтернирующему режиму. Пациентам группы ГХХ назначали в дозе 400 мг (200 мг 2 раза в сутки). В группе иАПФ/БРА использовали рамиприл или лозартан в максимально переносимых дозировках.
Морфологический диагноз включал оценку показателей мезангиальной гиперклеточности (М), эндотелиальной пролиферации (Е), сегментарного склероза (S), тубулярной атрофии с интерстициальным фиброзом (T) и числа клубочков с клеточными и фиброзно-клеточными полулуниями (C), согласно дополненной Оксфордской классификации MEST-C [14]. Гистопатологические критерии в исследуемых группах распределились в следующем диапазоне: М1 – 30, Е1 – 12, S1 – 25, T1 – 5 и C1 – 10 пациентов.
Для определения основных и минорных субпопуляций иммунокомпетентных клеток в цельной периферической крови использовали следующие панели моноклональных антител: CD45-FITC/CD4-RD1/CD8-ECD/CD3-PC5, CD45-FITC/ CD56-RD1/CD19-ECD/CD3-PC5/CD56-PC7, CD3-FITC/ CD56-PE/CD8-PC5/γδTCR-PC7/CD314-APC («Beckman Coulter», США). Концентрацию общих иммуноглобулинов классов M, G, A, E, а также В-клеточного активирующего фактора (BAFF – B-cell activating factor) и лиганда, индуцирующего пролиферацию В-клеток (APRIL – A proliferationinducing ligand), определяли в сыворотке крови исследуемых групп пациентов и здоровых доноров методом твердофазного иммуноферментного анализа, согласно инструкциям производителей с использованием следующих коммерческих наборов: «Иммуноскрин-G,M,A-ИФА-БЕСТ» (А-8674, Вектор-Бест, РФ), «IgE общий-ИФА-БЕСТ» (А-8660, Вектор-Бест, РФ), «Human BAFF/CD257 ELISA Kit» (E-EL-H0009, Elabscience, США), «Human TNFSF13 ELISA Kit» (E-EL-H2481, Elabscience, США). Результаты регистрировали на микропланшетном фотометре Sunrise («Tecan», Австрия) в двуволновом режиме: основной фильтр – длина волны λ=450 нм, референс-фильтр – длина волны λ=620 нм.
Статистическую обработку данных проводили с использованием пакета программ Statistica 8.0. Для описательной статистики исследуемых групп использовали показатели медианы (Ме), нижнего и верхнего процентилей (25–75-й процентили). Сравнение групп и определение достоверности различий осуществляли непараметрическим U-критерием Манна–Уитни для независимых переменных. Корреляционный анализ выполняли по Спирмену с определением рангового коэффициента корреляции (R).
Протокол исследования одобрен локальными независимыми этическими комитетами учреждений здравоохранения. Пациенты подписывали информированное согласие на участие в данном клиническом исследовании.
Результаты
Для оценки динамики клинико-лабораторных показателей пациентов с ИГАН с учетом проводимого лечения (ГХХ и ГКС) и группы сравнения (иАПФ/БРА) исследованы следующие показатели: уровень суточной ПУ, креатинин, СКФ и гематурия до и через 6 месяцев после терапии. Результаты исследования представлены в табл. 1.

В группе ГХХ у 70% пациентов установлено снижение уровня ПУ<1 г/сут. в конце наблюдения (р=0,03), что коррелировало с улучшением клинической эффективности (R=-0,75; p=0,01). Однако наиболее выраженное снижение ПУ с 2500 (610–4500) до 158 (0,2–2000) г/сут. отмечалось после курса ГКС (р=0,02), что также сопровождалось улучшением клинического эффекта в исследуемой группе пациентов (R=-0,86, p=0,01). Терапия иАПФ/БРА поддерживала нефропротективный эффект, достигнутый на первом этапе исследования, при этом уровень ПУ у всех пациентов группы не превышал 1 г/сут. Кроме этого в первых двух группах получен статистически значимый результат по нормализации уровня гематурии. В группе ГКС число эритроцитов достигало нормальных значений с 40 (20–60) до 2 (0–5) (р=0,02), тогда как лечение ГХХ оказывало благоприятный эффект на динамику снижения гематурии с 33 (10–50) до 8 (4–12) в п/зр (р=0,01). Общее число полных ремиссий в группах ГХХ и ГКС статистически не различалось: 60 и 70% соответственно. У 30% человек после лечения ГХХ и у 50% после ГКС нормализовались как суточная потеря белка с мочой, так и число эритроцитов в поле зрения. Тем не менее у 30% пациентов группы ГХХ отсутствовал эффект на проводимое лечение и концу 6-го месяца данные пациенты рассматривались для переключения на терапию ГКС (табл. 1). За период наблюдения не выявлено побочных эффектов лечения в группах, ни один из включенных пациентов не выбыл из исследования.
Оценка динамики показателей клеточного звена иммунитета в периферической крови пациентов исследуемых групп включала характеристику основных и минорных субпопуляций лимфоидных клеток, вовлекаемых в патогенез ИГАН, результаты которой представлены в табл. 2.
У пациентов с ИГАН, находившихся на терапии иАПФ/БРА, не выявлено статистически значимых различий в количестве основных лимфоидных популяций и установлено увеличение процента TNK-клеток (р=0,02), а также показана тенденция к повышению числа В1-лимфоцитов (р=0,06) в течение периода наблюдения. В группе пациентов с ИГАН, принимавших ГХХ, на фоне отсутствия изменений в основных лимфоидных популяциях установлено снижение относительного числа минорных лимфоидных популяций TNK-клеток (р=0,05) и γδТ-лимфоцитов (р=0,01), что коррелировало с улучшением клинической эффективности (R=-0,67; p=0,03). В то же время терапия ГКС пациентов с ИГАН приводила к повышению процента цитотоксических CD3+CD8+Т-лимфоцитов (р=0,05) при тенденции к снижению CD3+CD4+Т-хелперов (р=0,07) и отсутствии статистически значимых различий в минорных лимфоидных популяциях. При этом с увеличением абсолютного числа цитотоксических Т-лимфоцитов клиническая эффективность терапии ГКС снижалась (R=-0,72; p=0,05). Аналогичные изменения регистрировались в абсолютных количественных показателях субпопуляционного состава.
В связи с многочисленными доказательствами вовлечения γδТ-лимфоцитов в поддержание аутоиммунного воспаления важным остается не только изучение количественных характеристик данной субпопуляции, но и оценка цитотоксического профиля γδТ-лимфоцитов, что может быть впоследствии использовано в качестве биомаркеров в диагностике аутоиммунной патологии почек. На рис. 2 представлена динамика экспрессии маркеров цитотоксичности (ко-рецепторной молекулы СD8, молекулы клеточной адгезии CD56 и киллерного рецептора CD314) на γδТ-лимфоцитах пациентов с ИГАН до и после терапии иАПФ/БРА, ГХХ или ГКС.

Установлено, что после терапии ГХХ отмечалось статистически значимое снижение экспрессии всех маркеров цитотоксичности на γδТ-лимфоцитах, в то время как в группах пациентов, получавших иАПФ/БРА или ГКС, показана тенденция к уменьшению процентного содержания CD314+ γδТ-лимфоцитов (р=0,07 и р=0,06 соответственно) и отсутствовали статистически значимые изменения в экспрессии молекул цитотоксичности СD8 и CD56. При этом с уменьшением числа CD56+ γδТ-лимфоцитов в группе пациентов с ГХХ статистически значимо улучшался клинический эффект терапии (R=-0,49; р=0,02).
Наряду с мониторингом клеточных показателей иммунного ответа исследована динамика гуморального звена иммунитета во всех группах пациентов с ИГАН. Установлено снижение продукции IgM (р=0,005) и IgG (р=0,02) при терапии ГХХ, уменьшение синтеза сывороточного IgA при терапии ГКС (р=0,01), в то время как у пациентов, получавших лечение иАПФ/БРА, наблюдалось статистически значимое увеличение продукции IgE на фоне отсутствия изменений в концентрации других иммуноглобулинов (р=0,05) (табл. 3).
На фоне терапии ГХХ в сыворотке пациентов статистически значимо уменьшалась концентрация фактора APRIL (р=0,05), исходный уровень которого коррелировал со степенью тубулярной атрофии с интерстициальным фиброзом (R=0,40; p=0,05) и сывороточным содержанием IgG (R=0,35; p=0,05). После терапии ГХХ у пациентов с ИГАН со снижение уровня APRIL отмечалась тенденция к повышению СКФ (R=-0,46; p=0,06), а снижение концентрации IgG коррелировало с клиническим эффектом терапии (R=-0,45, p=0,04). При этом статистические изменения в уровне фактора BAFF у пациентов с ГХХ отсутствовали, в то время как на фоне терапии ГКС концентрация BAFF повышалась в сыворотке пациентов с ИГАН (табл. 3).
Обсуждение
В рамках настоящего исследования 20 пациентам ИГАН с ПУ более 1 г/сут. с сохранной почечной функцией на фоне 3-месячного курса иАПФ/БРА проведена оценка терапевтической эффективности ГХХ в дозе 400 мг (200 мг 2 раза в сутки) по сравнению 6-месячным курсом ГКС, согласно адаптированному протоколу, предложенному C. Pozzi [7]. В ходе наблюдения отмечено статистически значимое снижение уровня ПУ и гематурии у пациентов, получавших лечение ГХХ и ГКС. Тем не менее процент снижения был более выраженным в группе ГКС, чем в группе ГХХ: 93,5 против 78,2% (р=0,001) для ПУ и 95,0 против 75,0% для гематурии соответственно. Уровень СКФ оставался стабильным у всех пациентов за период наблюдения.
Результаты нашего исследования согласуются с данными систематического обзора, включившего 5 исследований с общим числом пациентов 504, в котором сравнительный анализ показал статистически значимое снижение ПУ к 6 месяцам лечения в группе ГХХ по сравнению с поддерживающей терапией на основе РАС-блокады в отсутствие значимых различий в эффективности относительно иммуносупрессивного лечения [15]. В то же время в сравнительном исследование Y.-z. Yang et al. показали более выраженный процент снижения ПУ в группе, получавшей ГКС, чем в группе ГХХ: 48,5 (62,6–31,4) против 62,9 (81,1–34,9) % (p=0,006 соответственно), но при более высоком числе побочных эффектов [16]. В систематическом обзоре данных 162 пациентов выявлено, что чаще побочные эффекты регистрировались со стороны кожно-слизистых оболочек (n=8), затем следовали различные диспепсические реакции (n=5), в 5 случаях отмечены анафилактические реакции, а наименьшее число осложнений выявлено со стороны сердечно-сосудистой системы, в основном в виде сердцебиения (n=2) [15].
При ИГАН отмечается нарушение наследственного иммунного ответа слизистых оболочек на инфекцию, проявившееся избыточной продукцией галактоза-дефицитного IgA1. В последующем к этому аберрантному белку образуются аутоантитела классов IgG и IgA, что приводит к развитию хронического иммунокомплексного гломерулонефрита. В соответствии с этой теорией толл-подобные рецепторы (TПР), в первую очередь 9-го типа (ТПР-9), играют центральную роль в патогенезе этого варианта гломерулонефрита, индуцируя секрецию фактора BAFF дендритными клетками, что ведет к поликлональной пролиферации В-лимфоцитов и образованию циркулирующих иммунных комплексов, состоящих из аберрантного IgA1 [17]. Более того, активация ТПР-9 стимулирует образование лиганда APRIL, индуцирующего пролиферацию, и интерлейкина-6 (ИЛ-6), которые в последующем конкурентно стимулируют продукцию галактоза-дефицитного IgA1 (рис. 3).
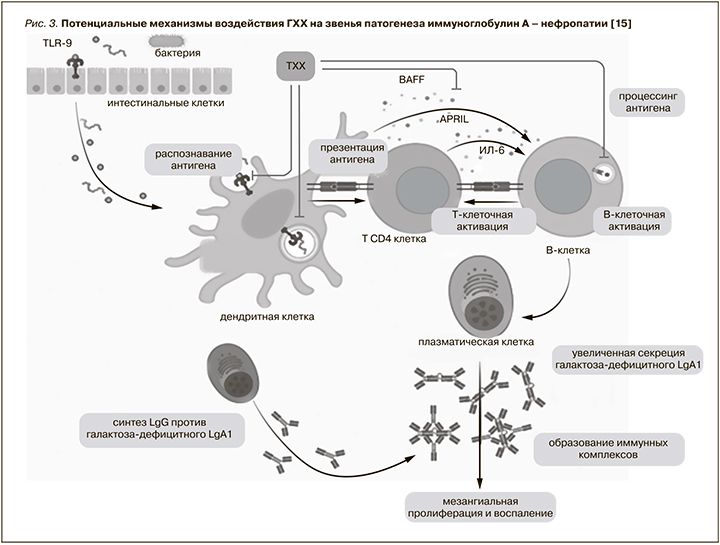
Иммуномодулирующее свойство ГХХ определяется прямыми молекулярными эффектами на активность клеточных лизосом, сигнальные пути активации иммунной системы и продукцию цитокинов. За счет свойств слабого основания ГХХ проявляет повышенный тропизм к лизосомам, накапливается в них и в дальнейшем приводит к дестабилизации лизосомальных мембран [18]. Воздействие на лизосомальную активность способствует торможению пролиферации лимфоцитов, а также нарушает этап презентации антигена на уровне передачи информации от дендритных клеток CD4+Т-лимфоцитам, что определяет основной противовоспалительный эффект ГХХ (рис. 3).
Результаты нашего исследования показали, что помимо известных иммуномодулирующих механизмов действия на клетки иммунной системы пациентов с ИГАН, принимавших ГХХ, наблюдается снижение количества γδТ-лимфоцитов, CD3+CD56+TNK-клеток в периферической крови, а также уровня сывороточных IgM и IgG.
Согласно молекулярно-клеточным механизмам иммунопатогенеза, популяции TNK-клеток и γδТ-лимфоцитов могут как играть триггерную роль в активации и дифференцировке наивных Т-лимфоцитов, так и вовлекаться в повреждение ткани на более поздних этапах развития иммунопатологического процесса. В отличие от αβТ-лимфоцитов γδТ-клетки не требуют антиген-специфического праймирования или клональной экспансии, в связи с чем являются одним из основных источников интерферона-γ и ИЛ-17 на ранних стадиях иммунного ответа, в т.ч. в условиях формирования аутоиммунного воспаления [19, 20]. С одной стороны, γδТклетки посредством интерферона-γ способствуют активной дифференцировке наивных Т-хелперов в Th1-клетки и усиливают эффекторные реакции клеточного иммунитета, с другой – γδТ-клетки приводят к ИЛ-17-медиированному снижению мРНК C1GALT1 и C1GALT1C1, способствуя увеличению продукции галактоза-дефицитного IgA. Еще одним возможным патогенетическим механизмом γδТлимфоцитов при ИГАН является их способность синтезировать трансформирующий фактор роста-β (TGFβ) и тем самым усиливать продукцию мукозального абберантного IgA В-лимфоцитами [21]. В экспериментальных исследованиях A. Rosenkranz et al. продемонстрировали, что эффекторные γδТ-клетки способны мигрировать в почечную ткань, где секретируют провоспалительные цитокины, инициирующие привлечение макрофагов в очаг воспаления, синтез ими биологически активных медиаторов (оксиданты, протеазы и др.), связывание компонентов комплемента и последующее образование фибриновых депозитов, что приводит к повреждению гломерулярной базальной мембраны и развитию протеинурии [22].
Заключение
Результаты нашего исследования показали, что ГХХ обладает полинаправленным действием на различные звенья патогенеза ИГАН: иммуномодуляция клеточного звена иммунитета осуществляется посредством влияния на минорные лимфоидные популяции (γδТ-лимфоциты и TNK-клетки), в то время как гуморальный иммунный ответ снижается за счет подавления секреции APRIL, который контролирует синтез иммуноглобулинов В-клетками. Терапевтическая эффективность ГХХ у пациентов с ИГАН проявляется в снижении уровня ПУ и уменьшения частоты микрогематурии при минимальной частоте развития побочных эффектов. Таким образом, ГХХ может быть использован как эффективная альтернативная терапия пациентов с недостаточным ответом на РАС-блокаду и имеющих потенциальный риск развития побочных эффектов от применения ГКС.



