Иммуноглобулин А-нефропатия (ИГАН) является наиболее распространенной формой иммуннокомплексного гломерулонефрита в мире, который патогенетически представляет собой повреждение почечной ткани в результате нарушенного синтеза иммуноглобулин А (IgA) слизистыми оболочками [12]. По литературным данным, эпизоды макроскопической гематурии после перенесенных инфекций верхних дыхательных путей и бессимптомная микроскопическая гематурия с протеинурией (ПУ) представляют собой самые распространенные проявления ИГАН [14]. Нефротический синдром (НС) и острое почечное повреждение (ОПП) встречаются реже, а гистологическая вовлеченность варьируется от минимальной мезангиальной пролиферации до выраженного гломерулярного и тубулоинтерстициального повреждения [10]. Долгое время считалось, что клиническое течение ИГАН обычно доброкачественное, лишь у небольшого числа лиц развивается терминальная почечная недостаточность [5]. По данным ряда исследований, неблагоприятный клинический исход связан с наличием артериальной гипертензии (АГ), нарушением функции почек, стойкой ПУ выше 1 г/сут., тяжелым гистологическим поражением [2, 6]. Предложенные в 2009 г. и обновленные в 2016 г. критерии Оксфордской классификации (MEST-С), отражающие тяжесть мезангиальной пролиферации (М), эндокапиллярной гиперклеточности (Е), сегментарного гломерулосклероза (S), канальцевой атрофии/интерстициального фиброза (Т) и наличие клеточных/фиброзно-клеточных полулуний (С), являются независимыми факторами, прогнозирующими исход заболевания [3, 13].
Цель данного исследования заключалась в определении клинических и морфологических проявлений заболевания в когорте белорусских пациентов с ИГАН, а также в выявлении факторов, ассоциированных с неблагоприятным исходом и оценкой 5и 10-летней бессобытийной выживаемости.
Материал и методы
Исследование основано на результатах анализа историй болезней, данных биопсийных заключений и амбулаторных карт 1236 пациентов, которым была выполнена чрескожная пункционная нефробиопсия (НБ) за период с 2010 по 2020 г. в нефрологических отделениях Минска (УЗ «1-я ГКБ», «4-я ГКБ» и ГУ «Минский НПЦ ХТиГ»). Биопсия почек выполнялась всем пациентам после получения письменного информированного согласия.
Диагноз ИГАН выставляли на основании гистологического исследования при выполнении стандартных и гистохимических окрасок, а также иммунофлуоресцентного исследования для выявления иммуноглобулинов классов G (IgG), A (IgA), M (IgM), фибриногена, компонентов комплемента С3 и С1q, каппа и лямбда легких цепей. Результат НБ считался неинформативным при наличии менее 8 клубочков в почечном биоптате. Основным критерием постановки диагноза было наличие изолированного преимущественного гранулярного отложения в мезангии гломерул депозитов IgA с возможным менее интенсивным кодоминирующим свечением IgG и/или IgM, C3-компонентом комплемента. Гистологические изменения отдельных структур в пределах площади биоптата почки оценивали в соответствии с Оксфордской классификацией: мезангиальная пролиферация (М0 – не более чем в 50% клубочков, М1 – 50% и более, более трех клеток в мезангиальной области), эндокапиллярная пролиферация (Е0 – отсутствует, Е1 – есть), сегментарный склероз или адгезия петель капилляров к капсуле клубочка (S0 – нет, S1 указывает на наличие), тубулярная атрофия/интерстициальный фиброз (Т0 – менее чем 25% кортикальной зоны, Т1 – 26–50% кортикальной зоны, Т2 – более 50% кортикальной зоны), клеточные или фиброзно-клеточные полулуния (С0 – нет, С1 <25% клубочков, С2 ≥ 25% клубочков) [3, 13].
Критерием включения в исследование был гистопатологически верифицированный диагноз ИГАН в период с 2010 по 2020 г. Критериями исключения из дальнейшего анализа были возраст пациента младше 18 лет, неинформативный результат НБ, сопутствующий сахарный диабет, вторичные формы ИГАН в рамках системной красной волчанки, пурпуры Шенлейна– Геноха, хронических болезней печени, синдрома Альпорта, других аутоиммунных заболеваний. На рис. 1 представлена схема дизайна исследования.

У пациентов, которым был выставлен диагноз первичной ИГАН, изучались демографические характеристики и клинические показатели на момент выполнения НБ, включившие цифры систолического (САД) и диастолического (ДАД) артериального давления, наличие артериальной гипертензии (АГ) которой считалось повышение цифр выше 140/90 мм рт.ст. или требующей назначения антигипертензивной терапии. Проводился анализ лабораторных тестов: ПУ, гематурия, измеренная как число эритроцитов более 5 в поле зрения (п/зр.) при большом увеличении микроскопа, учитывали макрогематурию (МАКРО) как рецидивирующие эпизоды окрашивания мочи в цвет «кока-колы», сопровождаемые увеличением числа эритроцитов выше нормы при микроскопии осадка. Состояние почечной функции оценивалось по расчету скорости клубочковой фильтрации (СКФ), измеренной с помощью расчетной формулы CKD-EPI (CKD Epidemiology Collaboration) [8].
С учетом клинического течения гломерулонефрита выделяли следующие синдромы: НС – ПУ выше 3,5 г/сут., снижение уровня белка крови ниже 60 г/л, сопровождаемое дислипидемией и отеками; нефритический (НЕФР) – АГ, сочетающаяся с гематурией, умеренной ПУ, отеками и снижением почечной функции; изолированный мочевой синдром (ИМС) – бессимптомная протеинурия (содержания белка в суточной моче от 0,3 до 3,5 г) с/без гематурии; ОПП – внезапное повышение уровня сывороточного креатинина более чем в 1,5 раза по сравнению с исходным уровнем или снижение объема мочи до уровня олигоанурии в течение 48 часов и хроническая болезнь почек (ХБП) – снижение СКФ ниже 60 мл/мин более чем на протяжении 3 месяцев наблюдения.
Регистрировали наличие клинически значимой хронической инфекции слизистых оболочек различной локализации: верхних и нижних дыхательных путей, а также наличие хронического тонзиллита.
Учитывали варианты назначенного лечения после выполненной НБ: ингибиторами ангиотензин-превращающего фермента или/и блокаторами рецептора ангиотензиногена-II, иммуносупрессивными лекарственными средствами (глюкокортикостероидами – ГКС, микофеноловой кислотой, циклофосфамидом, азатиприном) и дезагрегантами.
В группу динамического наблюдения были включены пациенты с первичной ИГАН, о которых имелась информация о клинико-лабораторных показателях в максимально удаленной временнóй точке от даты выполнения НБ. В этой группе оценивали наступление первичной композитной конечной точки исследования, за которую принимали развитие 5-й стадии ХБП, требующей почечно-заместительной терапии (ПЗТ), включая додиализную трансплантацию почек и снижение СКФ≥50% от исходной. Время наблюдения оценивали с момента проведения биопсии и установления диагноза до наступления первичной конечной точки или последнего визита без наступления события (цензурирование наблюдения).
Количественные показатели исследования представлены медианой и квартилями в виде Me [Q25; Q75], в случае нормального распределения – средним и стандартным отклонением в виде m±SD. Качественные показатели представлены частотами и процентами в группе.
Для определения 5-летней бессобытийной выживаемости почечной функции использовалась оценка Каплан–Майера.
Для исследования влияния потенциальных предикторов на выживаемость использован лог-ранк-критерий и однофакторное регрессирование пропорциональных рисков Кокса. Показатели, проявившие статистическую значимость в однофакторном анализе на уровне p<0,2 , включались в многофакторный анализ.
Отношение рисков (ОР) рассчитывалось как экспоненциальное преобразование соответствующих коэффициентов регрессии. Доверительные интервалы для ОР рассчитывались также как экспоненциальное преобразование соответствующих доверительных интервалов коэффициентов регрессирования.
Результаты анализа считались статистически значимыми при р<0,05.
Все расчеты проводились в статистическом пакете R, версия 4.1 [11].
Результаты
Из 1236 пациентов, которым была выполнена биопсия почки за изучаемый период времени, у 344 диагностирован гистопатологический диагноз ИГАН. С учетом клинических данных и критериев исключения для дальнейшего анализа был включен 291 пациент с диагнозом первичной ИГАН, клинические и лабораторные характеристики на момент верификации диагноза представлены в табл. 1.
Средний возраст на момент выполнения НБ составил 31±11 лет. В исследуемой когорте преобладали лица мужского пола 65,6%. АГ диагностирована у 47,6% пациентов. Отмечалась сохранная почечная функция – медиана СКФ составила 85 [65; 102] мл/мин. В большинстве случаев ИГАН дебютировала бессимптомными лабораторными изменениями, медиана эритроцитурии составила 20 [7; 70] клеток в п/зр., лишь у 36,6% пациентов выявлено повышение ПУ более 1 г/сут., у 7,9% – более 3,0 г/сут. в анализе мочи. Хронический тонзиллит выявлен у 30 (15,4%) пациентов, при этом тонзилэктомия выполнена 10 (6,9%) пациентам.
С учетом полученных клинико-лабораторных данных пациенты с ИГАН были сгруппированы согласно нефрологическим синдромам, частота встречаемости которых в исследуемой группе на момент выполнения НБ представлена в табл. 2.
Наиболее часто встречаемым нефрологическим синдромом в нашей когорте пациентов был ИМС – 67,2% случаев, при этом основная доля приходилась на сочетание ПУ и гематурии (66,2%), изолированная гематурия, характерная для этой формы гломерулонефрита, наблюдалась у 36 (18,5%) человек. Следующим по частоте встречаемости был НЕФР – 27,6% случаев. Редко встречающимися синдромами, при которых выполнялась НБ, были НС (2,8%), ХБП (1,4%) и ОПП (1%). Макрогематурия наблюдалась у 26 (8,9%) пациентов с различными вариантами течения ИГАН.
Морфологические изменения структур биоптата почки пациентов с ИГАН представлена в табл. 3. Анализ данных светооптического исследования 291 НБ в соответствии с Оксфордской гистопатологической классификацией MEST-C показал высокую распространенность сегментарного склероза/адгезии (S1) (71,5%) как одного из признаков дистрофических изменений клубочков. Тогда выраженная тубулярная атрофия и фиброз интерстиция (Т2) наблюдались лишь в 6,5% случаев. Из пролиферативных изменений клубочков почек наиболее часто выявляли диффузную мезангиальную (М1) пролиферацию (65,5%), затем по частоте встречаемости следовали фиброзно-клеточные полулуния (С1 и С2) (5%), и эндокапиллярная пролиферация (Е1) была в 27,1% случаев (табл. 3).
Основным вариантом патогенетического лечения после верификации клинико-гистопатологического диагноза было использование лекарственных средств, влияющих на ренинангиотезиновую систему; на его долю пришлось 90% случаев, ГКС назначали 54 (18,6%) пациентам, при этом шестерым дополнительно проводился курс лечения циклофосфамидом, у 3 ГКС сочетались с азатиоприном. Микофенолат мофетил использовался как вторая линия иммуносупрессивного лечения, его принимали 12 человек. Лекарственные средства группы дезагрегантов назначали 28 (9,6%) пациентам.
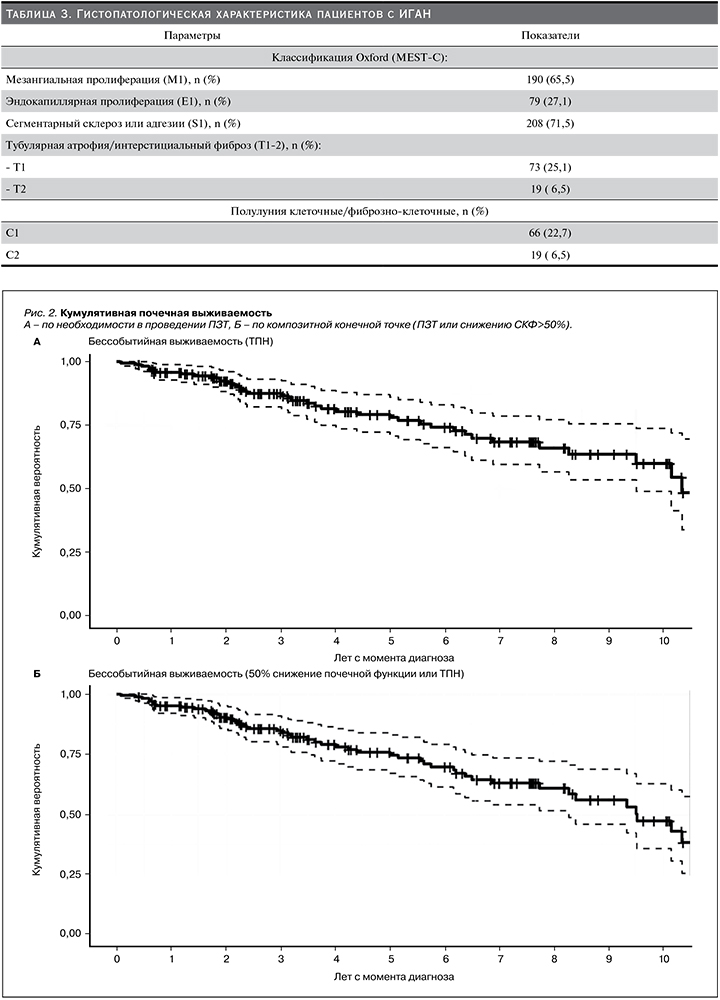
С целью анализа выживаемости почечной функции у пациентов с ИГАН для дальнейшего анализа была отобрана когорта из 167 пациентов, за которыми проводили динамическое наблюдение после выполненной НБ с медианой 5 лет. За период с 2010 по 2019 г. 50 пациентов достигли первичной композитной конечной точки исследования, из них 39 начали лечение различными вариантами ПЗТ, у 11 отмечено снижение СКФ на 50% от исходного уровня. Бессобытийная кумулятивная выживаемость без ПЗТ за 5 лет составила 79,2±3,8%, за 10 – 60,0±6,3%, при этом композитная 5-летняя выживаемость с учетом начала ПЗТ и снижения СКФ на 50% – 75,7±4,0%,10-летняя – 47,2±6,8% (рис. 2).
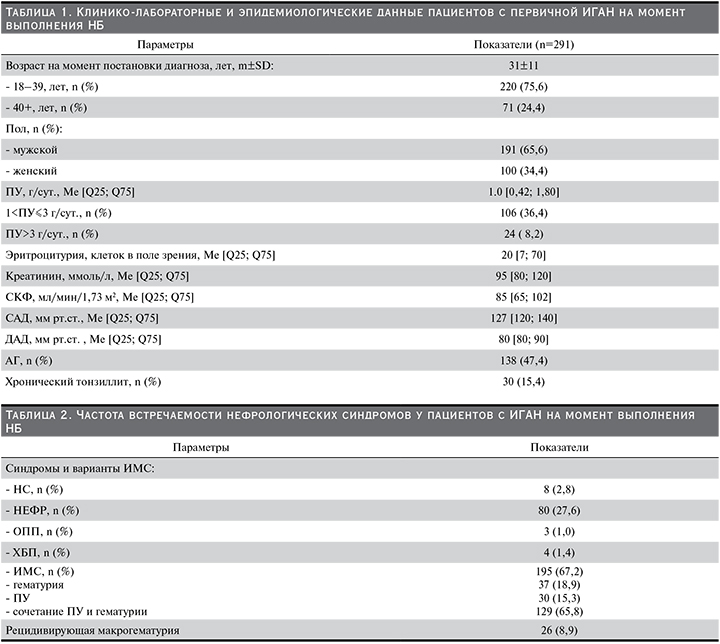
Сравнительный анализ исходных данных на момент выполнения НБ показал значимые различия между пациентами, достигшими композитной конечной точки клинического наблюдения, по сравнению с пациентами, ее не достигших по многим из анализируемых клинических и морфологических показателей (табл. 4).
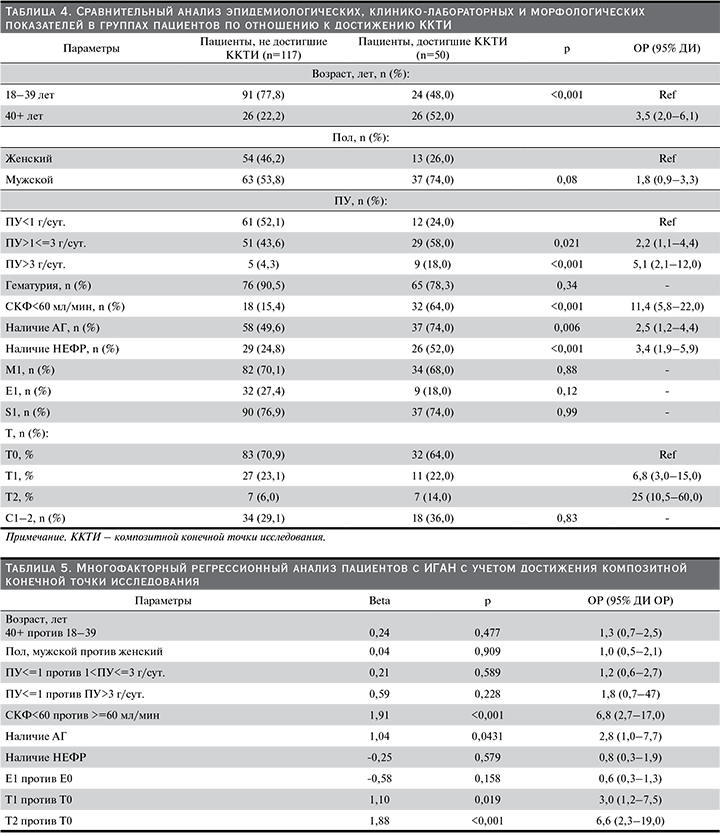
Для анализа факторов, ассоциированных с неблагоприятными исходами, проведен многофакторный регрессионный анализ (табл. 5).
Результаты однофакторного анализа показали, что мужской пол, СКФ, ПУ, наличие НЕФР и АГ были значимыми факторами наступления ККТИ, и мы использовали эти факторы в многофакторном анализе, который показал, что показатели СКФ менее 60 мл/мин, наличие АГ, выявляемые на момент постановки ИГАН, были независимыми предикторами, связанными с достижением ККТИ или неблагоприятным почечным исходом. Так, у пациентов с СКФ<60 мл/мин риск неблагоприятного исхода значимо возрастал по сравнению с пациентами, у которых СКФ была ≥60 мл/мин (ОР=6,8; р=0,0001). Наличие АГ увеличивало риск наступления терминальной стадии ХБП (ОР=2,8; р=0,04). Не было никакого значимого влияния возраста, пола или величины ПУ на наступление первичной конечной точки исследования. Из морфологических изменений почечной ткани только относительная величина тубулярной атрофии/интерстициального фиброза обладала статистической значимостью более высокого риск наступления ПЗТ или/и снижения СКФ на 50% и более ОР для Т1 составил 3,0 (р=0,019), а ОР для Т2 – 6.6 (р=0,001) по сравнению Т0.
Обсуждение
Это первое когортное исследование, которое позволило получить детальные сведения о клинико-морфологических и прогностических аспектах ИГАН в белорусской популяции.
В данном исследовании представлен анализ данных 291 пациента с первичной ИГАН (средний возраст – 31±11 лет, 65,6% мужчин). Наши данные показывают, что на момент выполнения НБ с целью верификации клинического диагноза у 67,2% исследуемых наблюдался ИМС, который в 65,8% случаев проявлялся сочетанием ПУ 1,0 [0,42; 1,80] г/сут. и гематурией 20 [7; 70] клеток в п/зр. У 47,4% пациентов отмечалась АГ, медиана СКФ была на уровне 85 [65; 192] мл/мин, что свидетельствует о сохранной почечной функции у большинства пациентов при постановке диагноза.
Для определения наличия особенностей проявления ИГАН в белорусской популяции проведен сравнительный анализ клинико-морфологических данных с когортами из регионов мира с высокой распространенностью этой формы гломерулонефрита – Европа и Азия [1, 7, 9].
В табл. 6 представлен сравнительный анализ эпидемиологических данных и клинико-морфологических проявлений ИГАН в исследуемой когорте и других странах мира.
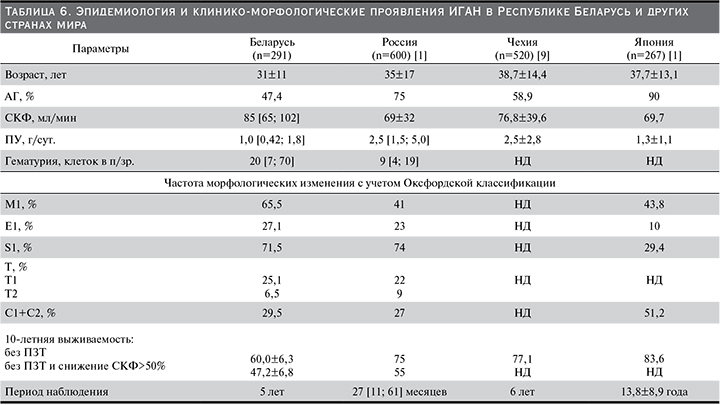
Особенностью белорусской когорты при постановке диагноза был более молодой возраст пациентов (31±11 лет), что объясняет характерные клинические проявления болезни, такие как меньшая частота встречаемости АГ 47,4%, более низкий уровень ПУ 1,0 [0,42; 1,8] г/сут. и более значимая величина гематурии 20 [7; 70] клеток в п/зр. по сравнению с другими странами Европы и Японии. Гистопатологические изменения в нашей группе существенно не отличались от таковых в российской, за исключением высокой доли мезангиальной пролиферации (М1), которая достигала 65,5% случаев. В свою очередь обращают на себя внимание характерные клинические черты азиатской когорты, для которой характерны высокая распространенность АГ до 90%, наличие высокой частоты встречаемости полулуний (С1+С2) до 51,2% и низкой частоты сегментарного склероза (S1) 29,4% случаев по данным результатов НБ [7].
Показатели 10-летней почечной выживаемости в 4 странах варьировались от 60,0 до 77,4%. Низкую 10-летнюю выживаемость в исследуемой когорте пациентов по сравнению с российской можно объяснить разным сроком наблюдения за пациентами, достигшими первичных конечных точек, 5 лет (60 месяцев) против 27 месяцев соответственно. Таким образом, наиболее оправданно для оценки выживаемости было бы использовать 5-летнюю выживаемость, которая достоверно не отличалась в белорусском и российском исследованиях: 79,2 против 81,0% соответственно [1].
Наибольший период наблюдения достигли японские исследователи в результате дополнительного анкетирования пациентов, самовольно отказавшихся от амбулаторного наблюдения нефролога, что привело к увеличению среднего срока наблюдения с 9,3 до 13,8 года. Это свою очередь способствовало увеличению как 5-, так и 10-летней выживаемости с 89,8 до 93,4% и с 77,4 до 83,6% соответственно [7]. В то же время в белорусской и российской когортах отмечалась высокая частота выбывания пациентов из анализа по причине отсутствия динамического наблюдения: 42,6 и 57,8% соответственно [1]. В чешском исследовании авторы заявляют о 100%-ном проведении как минимум 2 контрольных исследований – в начале и конце наблюдения [9].
Нельзя не отметить более высокую частоту назначения различных групп иммуносупрессантов в российской группе по сравнению с белорусской: 46 против 18,6% соответственно, что сопоставимо с частотой использования ГКС в чешском исследовании (41% случаев) и в японской когорте (48,5%) [1, 7, 9]. Независимыми факторами риска развития терминальной стадии ХБП, по данным одного из первых крупных европейских проспективных исследований, были ПУ больше 1 г/сут., наличие АГ и тяжелых гистопатологических изменений почечной ткани (полулуния, гломерулосклероз, фокальный или сегментарный гиалиноз и тубуло-интерстициальный фиброз) на момент постановки диагноза [2]. По данным многофакторного анализа, в исследуемой когорте независимыми прогностическими факторами, связанными с неблагоприятными почечными исходами ИГАН, были снижение СКФ менее 60 мл/мин, наличие АГ, а также гистопатологические критерии Оксфордской классификации Т1 и Т2, выявленные на момент постановки диагноза ИГАН. Так, величина ОР для неблагоприятного исхода составила 6,8 [2,7–1,7] при СКФ <60 мл/мин (p=0,001). Наличие АГ увеличивало риск наступления терминальной стадии ХБП, при этом ОР составил 2,8 [1,0–7,7], р=0,04. Статистически значимо было влияние канальцевой атрофии/интерстициального фиброза на достижение первичной конечной точки исследования, при этом ОР достиг 3,0 [1,2 – 7,5], p=0,015, для Т1 и ОР=6,6 [2,3–19], p=0,001, для Т2. В то же время не было отмечено значимого влияния эпидемиологических параметров, таких как возраст и пол, на наступление первичной конечной точки исследования. В нашем исследовании гистопатологические изменения клубочков, включившие мезангиальную гиперклеточность (М1), сегментарный склероз (S1), эндотелиальную пролиферация (Е1) и клеточные или фиброзно-клеточные полулуния (С1, С2), не были независимым прогностическим фактором наступления терминальной стадии ХБП как при однофакторном, так и при многофакторном регрессионном анализе Кокса. В то время как исследовательская группа ранее проведенного валидационного многоцентрового ретроспективного исследования Оксфордской классификации VALIGA пришла к выводу, согласно которому эта классификация полезна для прогнозирования почечного исхода [4]. Однако в этом исследовании они исключили пациентов с низкой СКФ (менее 30 мл/мин), с минимальным содержанием белка в моче (менее 0,5 г/сут.), а их первичной конечной точкой исследования было снижение СКФ на 50% от начального уровня. В нашем исследовании число пациентов с ПУ менее 0,5 г/сут. составило 91 (31,2%), СКФ менее 30 мл/мин – 14 (4,8%), что отличается от Оксфордского исследования. В результате мы посчитали, что эти различия привели к результатам, отличным от данных, полученных в исследовании VALIGA. К аналогичным выводам пришли японские и российские исследователи, что оставляет вопрос о надежности использования MEST-C и соответствующих расчетов для прогнозирования течения ИГАН [1, 7].
Заключение
Таким образом, для белорусской когорты пациентов с ИГАН в дебюте болезни характерны наличие ИМС, сохранная почечная функция. АГ, СКФ менее 60 мл/мин и относительная величина тубулярной атрофии/интерстициального фиброза более 25% на момент постановки диагноза были независимым фактором риска, влияющим на неблагоприятный почечный исход, что требует определения рациональных подходов к их диагностике и лечению. Бессобытийная кумулятивная выживаемость без ПЗТ 5 лет достигала 79,2±3,8%, 10 лет – 60,0±6,3%, при этом композитная 5-, 10-летняя выживаемость с учетом начала ПЗТ и снижения СКФ на 50% составила 75,7±4,0% и 47,2±6,8% соответственно. Это позволяет сделать вывод о достаточно неблагоприятном течении этой формы гломерулонефрита в республике по сравнению с другими странами, что требует дальнейшего изучения.



