Введение
Термин «экзентерация» (эвисцерация) происходит от лат. exenterare и греч. еvisceration, что в переводе означает извлекать внутренности, потрошить. Экзентерация (эвисцерация) малого таза (ЭМТ) показана больным местнораспространенными опухолями органов малого таза и подразу-мевает удаление органов малого таза с окружающей клетчаткой, тканями промежности (при раке наружных половых органов или распространении опухоли на ткани промежности), регио-
нарными лимфатическими узлами [4]. Впервые модель ЭМТ разработана американским хирургом Е. Bricker в 1940 г. [5–7]. В зависимости от объема удаляемых тканей различают тотальную, переднюю и заднюю ЭМТ. Показания к тотальной ЭМТ при местнораспространенном раке шейки матки (РШМ): распространение опухолевого процесса на тело матки, верхнюю треть влагалища, мочевой пузырь, прямую кишку и промежность; рак вульвы с прорастанием анального кольца, рак влагалища (до нижней трети) с инфильтрацией мочевого пузыря и прямой кишки [8, 9]. Передняя экзентерация выполняется при распространении РШМ на тело матки, мочевой пузырь и влагалище, задняя – при прорастании стенок прямой кишки. Также в зависимости от радикализма ЭМТ может быть радикальной (R0), когда опухоль отсутствует в крае отсечения органов и тканей, или паллиативной (R1, R2) в случае положительных краев резекции. Несмотря на совершенствование методов диагностики злокачественных опухолей органов малого таза, приблизительно у 40% больных болезнь выявляется в запущенных стадиях [10]. Опухолевой процесс преимущественно имеет местнораспространенный характер, при котором присутствует низкая частота метастазирования, причем у 30% неизлечившихся пациенток до конца жизни он не выходит за пределы малого таза [11]. Следовательно, лечение больных местнораспространенными опухолями малого таза, в т.ч. и РШМ, включая рецидивный, остается во многом нерешенной проблемой [12]. В работе изучены литературные данные авторов ближнего и дальнего зарубежья по данной теме, исторические данные, показания и противопоказания к операции, осложнения и выживаемость больных РШМ после ЭМТ.
Таким образом, ЭМТ отличается технической сложностью и трудоемкостью, а по своему воздействию на организм пациента представляется очень травматичной операцией, в связи с чем заслуженно относится к категории «сверхагрессивных» хирургических вмешательств. Ее выполнение сопряжено с высоким риском развития осложнений и летальности и является серьезным испытанием как для организма пациента, так и для профессионализма хирурга [13].
Методы
С сентября 2021 по декабрь 2022 г. в клинике Nano Medical Clinic выполнено 20 ЭМТ, из которых 10 тотальных и 10 передних. Средний возраст пациенток составил 47,3±8,0 лет, диапазон возраста от 37 до 67 лет. У всех пациенток процесс был признан местнораспространенным, осложненным, рецидивным РШМ (см. таблицу).
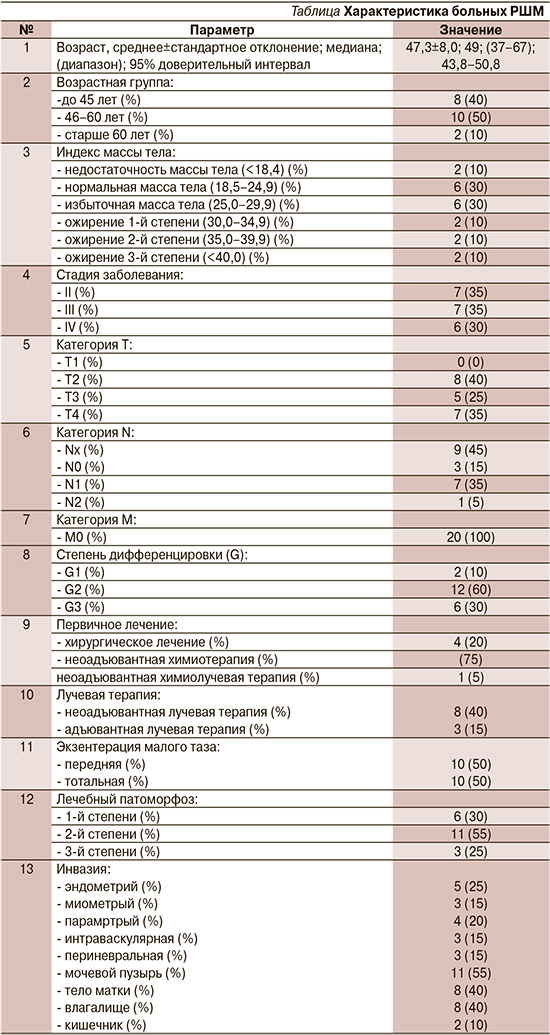
Все больные проходили тщательное обследование, основными задачами которого было определение распространенности опухолевого процесса, функциональных резервов организма, «анатомической» и «физиологической» резектабельности опухоли. Помимо лабораторно-инструментальных методов, входящих в стандарт обследования перед плановой операцией, диагностическая программа также включала УЗИ и МРТ брюшной полости, МРТ малого таза, контрастную урографию. Прорастание опухоли в кости малого таза или подвздошные сосуды рассматривали как ограничивающий фактор, что не являлось абсолютным противопоказанием. Наличие регионарных метастазов не служило причиной отказа от операции, поскольку всем пациенткам после удаления комплекса тазовых органов выполняли двустороннюю аорто-подвздошную и тазовообтураторную лимфодиссекцию. Средняя продолжительность операции составила 285±57,2 минуты (от 150 до 360 минут). Средний объем кровопотери – 1300 мл (от 1110 до 2000 мл).
R0 резекции удалось выполнить в 17 (85%) случаях, наличие микроскопических очагов опухолевого роста по латеральному краю резекции было выявлено у 3 (15%) пациенток (R1). Всем пациенткам накануне операции устанавливали двустороннюю перкутантную нефростому под контролем рентген-телевидения. При тотальной ЭМТ (n=10) всем пациенткам была сформирована колостома в левой подвздошной области.
Среднее время наблюдения за больными составило 16,4±6,2 месяца (от 0,7 до 23,6 месяца, медиана – 18,5 месяцев). За этот период умерли 50% (10/20) больных, в т. ч 15% (6/10) в группе передней ЭМТ (1 группа) и 10% (4/10) – в группе тотальной ЭМТ (2 группа) (р=0,007). Общая 1-летняя выживаемость пациентов 1-й группы составила 92,0±5,4%; 2-й группы – 70,0±10,2%. Выполнение ЭМТ при запущенных рецидивных опухолях РШМ позволяет рассчитывать на радикальное удаление опухоли и как следствие – на длительное излечение этой крайне тяжелой группы больных.
Результаты и обсуждение
В последние годы ЭМТ является развивающимся направлением и прочно вошла в арсенал многих онкологических учреждений во всем мире. Но до сих пор сохраняется мнение об ЭМТ как о калечащей операции с потенциально низкой выживаемостью [14].
В трех случаях во время тотальной ЭМТ при местнораспространенных, осложненных и рецидивных формах РШМ, когда перифокальная опухолевая инфильтрация была интимно спаяна с тазовой брюшиной в проекции крестца во время мобилизации и удаления органокомплекса, отмечено профузное кровотечение из венозного сплетения таза. Объем кровопотери составил до 2500 мл. Кровотечение остановлено путем ушивания кровотачащих участков сплетения атравматическими сосудистыми швами. При невозможности остановки кровотечения путем ушивания окончательная остановка кровотечения достигнута клипированием с помощью танталовых кровеостанавливающих кнопок. С целью профилактики гнойно-септических осложнений у всех пациентов был взят бактериальный посев из отделяемого свищевых ходов для рациональной антибактериальной терапии в послеоперационном периоде. Всем больным с целью профилактики арозивного кровотечения из оголенных подвздошных сосудов после диссекции выполнено их укрытие мобилизованным большим сальником на всем протяжении. С целью профилактики кишечной непроходимости петли тонкой кишки к концу операции укладывали согласно анатомической локализации и окутывали мобилизованным большим сальником с сохранением сосудов. Края большого сальника фиксировали атравматическими швами на уровне пограничной линии таза, а по бокам большой сальник фиксировали к париетальной брюшине боковых каналов брюшной полости. Необходимо отметить, что существенно уменьшить объем интраоперационной кровопотери удавалось благодаря двусторонней перевязке внутренних подвздошных артерий у места развилки подвздошных сосудов, производимой перед удалением комплекса тазовых органов. При невозможности этого технического приема из-за массивного опухолевого процесса на абдоминальный сегмент брюшной аорты накладывали большой аортальный сосудистый зажим. Послеоперационный период у пяти пациенток после тотальной ЭМТ осложнился развитием апостематозного пиелонефрита. Среднее время пребывания больных в стационаре составило 21 день (от 17 до 30 дней). Статистика выживаемости больных после ЭМТ, безусловно, является одним из важнейших критериев эффективности данного вида лечения, однако ее показатели, приводимые в различных обзорах, достаточно вариабельны. В 1965 г. А. Brunschwig [15] опубликовал результаты ЭМТ у 430 больных. Это до сих пор остается самым большим опытом одного специалиста. Общая 5-летняя выживаемость составила 21%. Данные показатели, на наш взгляд, могут быть названы вполне удовлетворительными, особенно с учетом того факта, что большинство больных были оперированы по поводу рецидива опухолевого процесса, что изначально является неблагоприятным прогностическим фактором.
Показания
Показания к проведению ЭМТ до сих пор являются дискутабельной проблемой в практической онкологии. Основным показанием к ЭМТ является местнораспространенный процесс в малом тазу, как первичный, так и рецидивирующий. Эти поражения затрагивают прилегающие органы таза или соседние анатомические структуры, включая боковую стенку таза, сосудисто-нервные структуры или костные компоненты таза: крестец или лобок. Цель ЭМТ состоит в том, чтобы достичь полной резектабельности (R0), на что указывает отсутствие атипических клеток в краях резекции и предполагает до 63% излечения [16]. Таким образом, можно перечислить следующие показания к проведению ЭМТ, которые наиболее приемлемо и обоснованно изложил Х.А. Хирш [17]:
- персистирующий рак шейки матки, влагалища и запущенные стадии рака вульвы;
- рецидивы других злокачественных новообразований в малом тазу;
- свищи и/или обширный постлучевой фиброз в малом тазу после лучевой терапии с признаками рецидива или продолженного роста опухоли.
Противопокозания
Основным противопоказанием к ЭМТ является невозможность достижения чистых хирургических краев (R0). Паллиативный подход не продемонстрировал улучшения качества жизни, но несколько увеличил общую выживаемость [18]. Исторически сложилось так, что триада одностороннего гидронефроза, лимфедемы нижних конечностей и боли в ноге вследствие седалищной невралгии раньше указывала на нерезектабельное заболевание боковых стенок таза. Экстраанатомические резекции в настоящее время выполняются с расширенным предоперационным планированием с использованием МРТ таза и/или КТ-ангиограмм или венограмм с частотой R0 66,5% [19].
Таким образом, абсолютным противопоказаниями по Х.А. Хиршу [17] являются внетазовые метастазы.
Помимо этого ЭМТ не следует предлагать пациентам, которые не являются кандидатами на адъювантную химиотерапию в обычные сроки после операции из-за ожидаемого длительного периода восстановления [19].
Клиническое значение
С середины 1900-х гг., когда смертность от ЭМТ составляла около 23%, в специализированных центрах результаты улучшились до 1–2% [19]. Наиболее важным фактором для определения долгосрочной выживаемости после ЭМТ является R0-резекция [18]. Для пациентов с запущенными первичными или рецидивирующими злокачественными новообразованиями малого таза хирургическое лечение является единственным вмешательством с возможностью на излечение. У правильно отобранных пациенток резекция R0 может быть достигнута примерно в 70% случаев [20]. В 30-летнем обзоре от 2019 г. ЭМТ чаще выполнялись при рецидиве заболевания, чем при первичной резекции опухоли [21]. В заключение хотелось бы отметить, что, несмотря на определенные успехи в лучевой терапии и химиотерапевтическом лечении онкологических больных, ЭМТ остается единственным эффективным методом лечения пациентов с местнораспространеенными опухолями органов малого таза, включая местнораспространенный, осложненный и рецидивирующий РШМ. Несмотря на имеющиеся достижения при выполнении ЭМТ в мировой онкологической практике, она до сих пор остается объектом значительной критики и споров практикующих онкологов. Однако у больных рецидивным местнораспространенным РШМ, когда все остальные методы лечения исчерпаны, ЭМТ является единственным способом лечения и в ряде случаев оправданна.
Следует отметить, что для улучшения качества жизни столь сложной категории больных необходимо совершенствовать существующие и отработать новые пластические методы отведения мочи и кала, разработать новые методики пластических реконструкций тазового дна после ЭМТ [14].
Заключение
Таким образом, у пациентов с местнораспространенным рецидивирующим РШМ, когда возможности химио и лучевой терапии исчерпаны, несмотря на высокую летальность и низкое качество жизни больных, ЭМТ оправданна.



