Сахарный диабет 2 типа (СД2) остается актуальной проблемой нашего времени, причиняющей значительный медико-социальный и экономический урон. По данным Госрегистра (2015), в России численность больных СД2 составила 3,7 млн, хотя с учетом скрытого течения заболевания его истинная распространенность в 3–4 раза выше [1]. При недостаточно эффективном лечении СД2 может значительно ограничивать жизнь пациентов из-за развития опасных осложнений, приводить к ранней инвалидизации и преждевременной смерти. Кроме того, СД2 является многофакторным заболеванием, ассоциированным с различными сопутствующими метаболическими нарушениями и представляет собой фактор высокого риска ухудшения сердечно-сосудистого прогноза, что приводит к фатальным последствиям 60–75% пациентов [2, 3].
Терапия СД2 должна быть направлена не только на нормализацию гликемии, но и на коррекцию других факторов сердечно-сосудистого риска [4, 5]. Воздействие лишь на один из факторов риска не может полностью предупредить поражение сосудистого русла при СД2. Артериальная гипертензия как частое сопутствующее нарушение занимает доминирующую позицию в структуре факторов риска сердечно-сосудистых заболеваний (ССЗ) у пациентов с СД2 [6–8]. Другим значимым, но вместе с тем модифицированным фактором риска ССЗ является избыточная масса тела/ожирение, который увеличивает вероятность развития сосудистых осложнений СД2 особенно при висцеральном типе отложения жира [8–1]. Поэтому контроль массы тела является вторым по важности параметром после гликированного гемоглобина (HbA1с). С годами масса тела пациентов чаще увеличивается, особенно при применении тиазолидиндионов, препаратов сульфонилмочевины (ПСМ) и инсулина, что ухудшает чувствительность тканей к инсулину и выступает в качестве препятствия для эффективного лечения гипергликемии.
Не секрет, что сахароснижающие препараты многих групп способны эффективно снижать гликемию, но существенно отличаются друг от друга в аспектах безопасности. Гипогликемии, как пусковой фактор к активации системы контринсулярной защиты и гемодинамических нарушений способствуют высокому риску развития ССЗ [11, 12].
Более того, гипогликемические состояния ухудшают течение СД2 в связи со сложностью достижения компенсации, ухудшением приверженности лечению, вызывают повышение риска не только сердечно-сосудистых событий, но и когнитивных нарушений и деменции. Согласно результатам исследования VADT (Veterans Affairs Diabetes Trial), гипогликемия наряду с уровнями HbA1с, липопротеидов высокой плотности, возрастом больных и предшествующими кардиоваскулярными событиями в наибольшей степени ассоциируется с высоким риском смерти больных СД2, увеличивая его в 3–4 раза [13]. Тяжелые гипогликемии являются основными предикторами инфаркта миокарда (ИМ), инсульта и смерти от всех причин при СД2. Поэтому выбор сахароснижающего препарата должен гарантировать низкий риск гипогликемий [14].
Лечение любого заболевания может быть успешным лишь при четком понимании его патогенетических механизмов. Известный на сегодняшний день патогенез СД2 включает не только фундаментальные механизмы (инсулинорезистентность, дисфункция β-клеток), но и как минимум 5 существенных метаболических дефектов: гиперглюкагонемия; дефицит продукции и/или резистентность к инкретинам; ускоренный липолиз в жировой ткани; повышение реабсорбции глюкозы в почках и резистентность к инсулину в мозге. Все это обосновывает необходимость применения новых терапевтических подходов к лечению больных СД2 [15].
Ингибирование SGLT2: новый подход к управлению уровнем глюкозы в крови
Область диабетологии непрерывно развивается, и сегодня улучшение гликемического контроля стало возможным вследствие разработки препаратов, способных изменять процессы реабсорбции глюкозы в почках и получивших название ингибиторов натрий-глюкозных котранспортеров глюкозы 2-го типа (SGLT2 – Sodium-glucose co-transporter 2). Создание и внедрение в практику ингибиторов, подавляющих почечную реабсорбцию глюкозы, явились поворотным моментом в лечении СД2, что во многом обусловлено благоприятным профилем действия лекарственных средств этого инновационного класса [17, 18].
Ингибиторы SGLT2 быстро заняли видное место в фармакотерапии СД2. Об их быстром признании свидетельствует тот факт, что в 2015 г. ингибиторы SGLT2 включены в Алгоритмы AACE (The American Association of Clinical Endocrinologists) как предпочтительный класс для монотерапии, двойной и тройной терапии СД2 [19]. Класс ингибиторов SGLT2 в феврале 2015 г. вошел в Российские алгоритмы [1].

История создания ингибиторов SGLT2 весьма интересна. Если быть точными, то первый ингибитор SGLT2 был открыт и испытан при СД еще до создания инсулина. В 1886 г. ученый П. Меринг, изучая свойства флоризина (это вещество впервые было выделено французскими химиками из коры яблони), обнаружил его способность вызывать глюкозурию [20]. В последующем исследования продемонстрировали снижение уровня гликемии под действием флоризина у животных без рисков гипогликемии. Позднее было установлено, что флоризин осуществляет глюкозурический эффект благодаря ингибированию SGLT 1-го и 2-го типов, ответственных за процесс реабсорбции глюкозы в почках. Однако флоризин не нашел себе применения в качестве сахароснижающего препарата (потенциальная токсичность, низкая биодоступность) [20]. Работа по разработке нового класса сахароснижающих препаратов со временем была продолжена и в результате были синтезированы современные ингибиторы SGLT2 с уникальным механизмом действия, позволяющим уменьшить уровень гликемии независимо от инсулина [18, 21].
Прежде чем перейти к обсуждению механизмов действия этого инновационного класса сахароснижающих средств, рассмотрим роль почек в обмене углеводов. Почки играют значительную роль в гомеостазе глюкозы посредством ее реабсорбции.
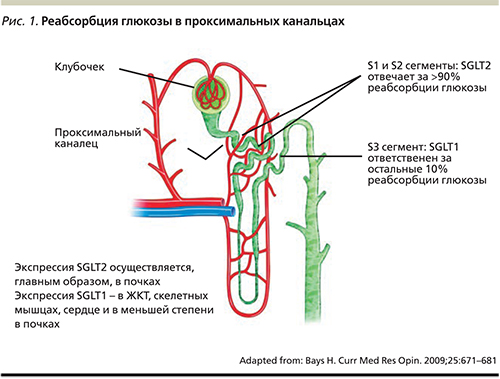
У здоровых людей суточная фильтрация глюкозы в почечных клубочках составляет порядка 180 г. Моча, поступающая в петлю Генле, свободна от глюкозы, поскольку практически вся отфильтрованная глюкоза подвергается повторной реабсорбции: 90% – в начальной части (S1-сегмент) проксимального канальца, а остальные 10% – в конечной его части (S2- и S3-сегментах) (рис. 1). Причем глюкоза не способна свободно проникать через клеточную мембрану канальцев: ведущее значение в процессах ее реабсорбции в почках имеют мембранные белки из семейства натрий-глюкозных котранспортеров [21, 22]. Это семейство трансмембранных переносчиков глюкозы, которые обеспечивают активный транспорт глюкозы или других низкомолекулярных веществ против градиента концентрации посредством использования градиента концентрации ионов натрия, созданного АТФ-зависимым натрий-калиевым насосом [20, 23].
Основным натрий-глюкозным котранспортером, ответственным за 90% реабсорбции глюкозы в почечных канальцах, является SGLT2-белок, состоящий из 672 аминокислот [24]. Это транспортер с низкой аффинностью, но с высокой способностью транспортировать глюкозу. SGLT2 почти исключительно экспрессирован в S1-сегменте начального отдела проксимального канальца нефрона. В противоположность этому SLGT1 – транспортер с высокой аффинностью при малой способности транспортировать глюкозу через клеточную мембрану, локализуется преимущественно в клетках тонкой кишки, где осуществляет активный транспорт глюкозы и галактозы через щеточную каемку кишечника, и в меньшей степени присутствует в почках и сердце. С помощью SLGT1 в более дистальном прямом сегменте проксимальных канальцев осуществляется реабсорбция приблизительно 10% глюкозы, не подвергшейся обратному всасыванию в S1-сегменте [23].
Усвоение глюкозы эпителиальными клетками почечных канальцев требует ковалентного усвоения натрия (рис. 2). Переносчики SGLT транспортируют глюкозу и натрий (Na) (для SGLT1 и SGLT2 соотношение связывания Na+:глюкоза=2:1 и 1:1 соответственно) из просвета в цитоплазму клеток почечных канальцев посредством вторичного активного транспорта. Поглощение Na осуществляется с помощью аденозинтрифосфатазного насоса через базолатеральную мембрану клетки. Ненагруженный, отрицательно заряженный носитель переносчиков SGLT до связывания с Na обладает низкой аффинностью к внешним сахарам. После связывания внешнего Na и глюкозы третичная структура Na/глюкоза/носитель подвергается конформационному изменению, приводящему к тому, что участки связывания Na и глюкозы оказываются обращенными в цитоплазму, где происходит их высвобождение, причем вначале высвобождается либо Na, либо глюкоза. После этого разгруженный носитель подвергается дальнейшим конформационным изменениям, в результате которых участки связывания оказываются доступными для контакта с внешней поверхностью клеточной мембраны. Выделение глюкозы в кровь из клеток почечных канальцев осуществляется с помощью глюкозотранспортеров семейства GLUT [25].
Примечательно, что мутации в определенных участках гена SGLT2, нарушающие экспрессию и функцию этого транспортера глюкозы, приводят к наследственной почечной глюкозурии, при этом уровень экскреции глюкозы с мочой различен. В частности, описана 21 мутация. Пациенты с подобным нарушением представляют собой идеальную модель для изучения влияния глюкозурии (в отсутствие гипергликемии) на функцию мочевыделительной системы [26]. Хотя глюкозурия в некоторых случаях может превышать 120 г/сут, протекает она обычно бессимптомно, без изменения объема плазмы и концентрации электролитов крови. При этом уровень глюкозы в крови остается в норме. Следует уточнить, что хроническая глюкозурия сама по себе (без гипергликемии) оказывает незначимое влияние на работу почек. В известных случаях почечные функции не нарушались, не наблюдалось и повышения инфекции мочевыводящих путей и частоты СД [26].

Наряду с другими ключевыми механизмами росту гликемии при СД2 способствует повышенная реабсорбция глюкозы в почках. Причины указанного нарушения полностью не выяснены; обсуждается роль избыточной экспрессии SGLT2. За счет стимуляции SGLT2 повышается уровень реабсорбции глюкозы, а количество экскретируемой с мочой глюкозы уменьшается [17, 24]. При определенной концентрации глюкозы поток глюкозы становится чрезмерным, приводя к насыщению системы глюкозного транспорта. Вся отфильтрованная глюкоза, превышающая этот порог, выводится с мочой. Даже в условиях гипергликемии механизм натрий-глюкозного котранспорта в почках продолжает функционировать и реабсорбировать глюкозу, являющуюся одной из причин гипергликемии и источником дополнительных калорий [27–29]. Проведенные исследования показали, что ингибирование SGLT2 снижает почечный порог у пациентов с СД2 примерно на 60%, что приводит к увеличению экскреции глюкозы с мочой [21]. Влияние ингибирования SGLT1 выяснено не полностью, однако можно предполагать, что дополнительное ингибирование SGLT1 может ингибировать абсорбцию глюкозы в кишечнике (основной путь поступления экзогенной глюкозы в кровь) и приводить к диарее [23].
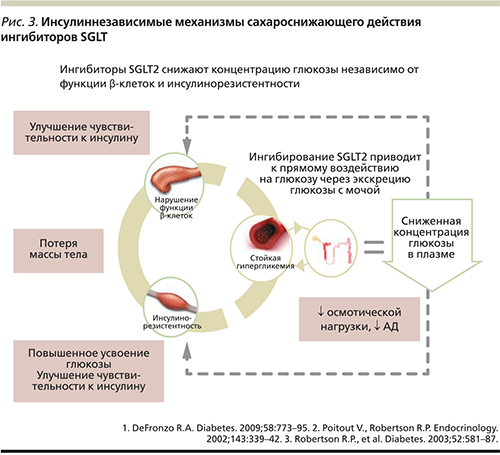
В настоящее время создан ряд молекул, селективно тормозящих SGLT2. Угнетение функции SGLT2 посредством инсулиннезависимого механизма приводит к снижению реабсорбции глюкозы в проксимальных канальцах и влечет за собой глюкозурию с последующим снижением уровня глюкозы в плазме крови без рисков гипогликемии [30, 31]. В отличие от многих применяемых в настоящее время сахароснижающих препаратов механизм действия ингибиторов SGLT2 не зависит от секреции инсулина или инсулинорезистентности (рис. 3). В связи с этим механизмы ингибиторов SGLT2 могут быть эффективными на всех этапах прогрессирования СД2 [32]. Кроме того, показано, что такой механизм снижения гликемии будет приводить к улучшению функции β-клеток и уменьшению центральной и периферической инсулинорезистентности [18, 33]. Есть мнение, будто это косвенный результат быстрого уменьшения глюкотоксичности и отдыха β-клеток [24]. С появлением ингибиторов SGLT2 у врачей впервые появилась возможность не только улучшать гликемический контроль без рисков гипогликемий, но и снижать массу тела у пациентов с СД2.
Клинические возможности (Джардинс) эмпаглифлозина
Одним из первых ингибиторов SGLT2 в арсенале эндокринологов появился препарат эмпаглифлозин (Джардинс) [34]. Препарат зарегистрирован в США, странах Европы (FDA, 2014, EMEA, 2014). В Российской Федерации эмпаглифлозин зарегистрирован 28.11.2014. Эмпаглифлозин является обратимым, высокоактивным, селективным и конкурентным ингибитором SGLT2. Особые фармакологические свойства его молекулы обусловливают хороший клинический эффект у пациентов с СД2; в частности даже небольшая концентрация, равная 1,3 нмоль, достаточна для ингибирования 50%-ной активности фермента SGLT2 (IC50). Причем селективность эмпаглифлозина по отношению SGLT2 в 5000 раз превышает селективность SGLT1, ответственного за абсорбцию глюкозы в кишечнике. Ингибирование котранспортеров SGLT1 может нарушать абсорбцию глюкозы в кишечнике (основной путь поступления экзогенной глюкозы в кровь), а также может вызывать у отдельных пациентов желудочно-кишечные побочные эффекты (диарею) [35].

Эмпаглифлозин отличает пролонгированный период полувыведения (10–19 часов); прием пищи не влияет на фармакокинетику. Существенным обстоятельством, обеспечивающим приверженность пациентов терапии эмпаглифлозином, является возможность однократного применения препарата (1 раз в сутки) в дозе 10 или 25 мг независимо от приема пищи. Эмпаглифлозин не ингибирует, не инактивирует и не индуцирует изоферменты CYP450. Активные метаболиты отсутствуют, выводится препарат в равной степени почками и печенью [36].
В ходе клинических исследований (КИ) было установлено, что у пациентов с СД2 выведение глюкозы почками увеличивалось сразу же после применения первой дозы эмпаглифлозина; причем такой эффект продолжался на протяжении 24 часов. Важно, что увеличение выведения глюкозы почками приводило к быстрому снижению концентрации глюкозы в плазме крови как натощак, так и после еды.
Обладая инсулиннезависимым механизмом действия, эмпаглифлозин, как и другие ингибиторы SGLT2, характеризуется очень низким риском развития гипогликемий, что представляет собой значимое преимущество лекарственных средств этого класса перед другими сахароснижающими препаратами. Эмпаглифлозин может использоваться в комбинации с любым сахароснижающим лекарственным средством, включая инсулин [36].
Основные результаты применения эмпаглифлозина у пациентов с СД2
За время, прошедшее с этапа КИ до появления эмпаглифлозина в клинической практике, накоплена хорошая доказательная база, свидетельствующая о высокой сахароснижающей эффективности и благоприятном профиле безопасности при применении препарата в разных режимах (монотерапии, двойной и тройной комбинированной терапии) [37–42]. Терапевтические возможности также оценивались при добавлении эмпаглифлозина к базальному инсулину и режиму множественных инъекций инсулин [43, 44].
В целом эффективность и безопасность эмпаглифлозина в суточной дозе 10–25 мг по сравнению с плацебо и другими сахароснижающими препаратами были изучены и подтверждены в нескольких КИ III фазы длительностью от 24 до 104 недель более чем у 15 тыс. больных СД2 с разным исходным уровнем гликированного гемоглобина – HbA1c [37–42].
Согласно объединенным данным КИ III фазы применение эмпаглифлозина как в монотерапии, так и при добавлении к другим сахароснижающим препаратам приводит к клинически значимому улучшению контроля гликемии у больных СД2 (рис. 4).
В частности, разница уровня HbA1c при использовании эмпаглифлозина в дозе 10 и 25 мг по сравнению с плацебо составила -0,74 и -0,85% соответственно [38]. Схожий результат был отмечен для обеих доз эмпаглифлозина в комбинации с метформином (-0,57 и -0,64% соответственно) [39], пиоглитазоном (-0,48 и -0,61% соответственно) [40], в режиме тройной терапии при добавлении к комбинации метформин и ПСМ (-0,64 и -0,59% соответственно) [41], при добавлении к инсулинотерапии (-0,46 и -0,62% соответственно) [43, 44].

По сахароснижающей эффективности эмпаглифлозин не уступает другим сахароснижающим средствам. В рандомизированном плацебо-контролируемом 52-недельном расширенном исследовании КИ M. Roden и соавт. сравнивали эффективность применения эмпаглифлозина и ситаглиптина однократно в день у пациентов, не получавших ранее сахароснижающего лечения (n=899) [43]. Пациенты с HbA1c 7,0% (n=899) были рандомизированы в группы для получения один раз в сутки плацебо или 10 мг/25 мг эмпаглифлозина или 100 мг ситаглиптина. Пациенты, соответствующие критериям включения и завершившие 52-недельный период лечения, продолжили прием препарата в слепых условиях в течение дополнительного 72-недельного срока.
Среднее исходное значение уровня HbA1c составило для группы эмпаглифлозина (10 и 25 мг соответственно) 7,87 и 7,86%, для группы ситаглиптина – 7,85%. При применении обеих доз эмпаглифлозина к 24-й неделе было выявлено значительное снижение уровня HbA1c, скорректированное с учетом плацебо – 0,74% (10 мг) и 0,85% (25 мг). В группе ситаглиптина снижение уровня HbA1c составило 0,73%. Концентрация глюкозы плазмы натощак (ГПН) значимо снижалась во всех группах лечения: -1,73, -2,01 и -1,04 ммоль/л для 10 мг/25 мг эмпаглифлозина и ситаглиптина соответственно. Эти данные свидетельствуют о более высокой эффективности эмпаглифлозина в дозе 25 мг по сравнению с ситаглиптином в дозе 100 мг в отношении снижения уровня ГПН.
Интересно, что разница между эмпаглифлозином в дозе 25 мг и ситаглиптином в дозе 100 мг была более выраженной у испытуемых, имевших более высокий уровень HbA1c на исходном этапе (>8,5%): у этой когорты пациентов эмпаглифлозин в дозе 10 и 25 мг снизил уровень HbA1c на 1,44%, а ситаглиптин – на 1,04% (p=0,0119).
В группах терапии к 72-й неделе значение HbA1c снизилось на 0,65, 0,76 и на 0,53% для эмпаглифлозина (10 мг/сут), эмпаглифлозина (25 мг/сут.) и ситаглиптина соответственно. Причем применение эмпаглифлозина в дозе 25 мг/сут позволило достигнуть более выраженных изменений HbA1c по сравнению с ситаглиптином (p=0,005). Нельзя обойти вниманием динамику массы тела пациентов, уровня артериального давления как на этапе 24 недель, так и в конце КИ. В группе пациентов, получавших терапию ситаглиптином, масса тела достоверно не менялась, что отражает нейтральное влияние на этот показатель ингибиторов дипептидилпептидазы-4 (ДПП-4) у пациентов с СД2. Напротив, в группе эмпаглифлозина изменение массы тела от исходного уровня на 76-й неделе терапии составило -2,26+0,0 кг (для 10 мг/сут) и -2,48+0,0 кг (25 мг/сут) (по сравнению с группой ситаглиптина; p<0,001). Применение эмпаглифлозина по сравнению с ингибитором ДПП-4 сопровождалось клинически значимым влиянием на артериальное давление (АД). В частности, в группах эмпаглифлозина как на 24-й неделе, так и к 72-й неделе терапии было достигнуто достоверное снижение систолического АД: на 4,1 и 4,2 мм рт.ст. (для эмпаглифлозина – 10 и 25 мг/сут соответственно) [41].
Многие пациенты со временем нуждаются в комбинированной сахароснижающей терапии, что обусловлено прогрессирующим характером СД2.
В наши дни выбор оптимальной схемы лечения становится все более сложным ввиду существования нескольких вариантов интенсификации терапии при неэффективности метформина, представленных в современных алгоритмах ведения пациентов с СД2 [1, 19]. Все еще нет единого мнения об оптимальном лечении на этом этапе. Следовательно, необходимо лучшее понимание преимуществ и недостатков сахароснижающих средств второй линии.
Не секрет, что многие сахароснижающие препараты обладают высоким потенциалом в отношении снижения уровня HbA1c. Учитывая сложные патофизиологические связи между СД2, ожирением, артериальной гипертензией и атеросклерозом, особое значение для всех имеющихся в практике и появляющихся новых сахароснижающих средств приобретает не только их способность обеспечивать контроль гликемии, но и их влияние на факторы сердечно-сосудистого риска у больных СД2 [2–5]. Как уже подчеркивалось, важным для минимизации сердечно-сосудистого риска является и безопасность препарата в отношении гипогликемических эпизодов [11, 15].
Помимо плацебо-контролируемых КИ были проведены по оценке эффективности эмпаглифлозина при комбинированной терапии с использованием препарата сравнения. Одним из существенных аргументов в пользу выбора оптимального варианта интенсификации сахароснижающей терапии представляют результаты прямого КИ по оценке долгосрочной эффективности и безопасности эмпаглифлозина по сравнению с глимепиридом в качестве 2-й линии терапии [44]. Комбинация метформина с ПСМ до сих пор занимает важное место в лечении СД2.
Больные СД2 с недостаточным контролем гликемии, несмотря на терапию метформином, были разделены на две группы: получавшие один раз в сутки 25 мг эмпаглифлозина (n=765) или глимепирид в дозе 1–4 мг (n=780); период наблюдения – 104 недели. Стартовая доза глимепирида составила 1 мг/сут с последующими рекомендациями по увеличению дозы следующим образом: 2 мг/сут на 4 недели, 3 мг/сут на 8 недель, 4 мг/сут на 12 недель, в случае если глюкоза плазмы натощак (ГПН) (посредством самоконтроля гликемии) была >110 мг/дл. Среднее исходное значение уровня HbA1c в обеих группах фармакотерапии составило 7,92%.
По выраженности сахароснижающего эффекта относительно исходного уровня HbA1c добавление эмпаглифлозина к метформину сопровождалось достоверно бóльшим снижением уровня HbA1c по сравнению с группой, получавшей метформин и глимепирид. Межгрупповая разница через 104 недели составила -0,11 ммоль/л (95% доверительный интервал [ДИ] – -0,21; -0,01; p=0,026).
Нельзя не сказать о том, что эти варианты интенсификации сахароснижающей терапии по-разному отразились на динамике массы тела пациентов. В частности, в группе, получавшей эмпаглифлозин и метформин, наблюдалось устойчивое достоверное снижение массы тела, на 102-й неделе наблюдения межгрупповая разница по скорректированному изменению массы тела составила -4,5 кг (95% ДИ – -5,0; -4,2; p<0,0001). Несомненно, это является существенным преимуществом в пользу применения эмпаглифлозина дополнительно к метформину при его неэффективности.
Гипогликемия часто является ограничивающим фактором контроля гликемии при СД2 [12]. За период наблюдения в группе эмпаглифлозина частота гипогликемий была достоверно ниже, чем в группе глимепирида. По окончаниb КИ эмпаглифлозин демонстрировал превосходство перед глимепиридом в отношении безопасности, о чем свидетельствовал низкий процент пациентов с подтвержденными случаями гипогликемии в течение 104 недель: в группе эмпаглифлозина – 2,5% по сравнению с 24,4% в группе глимепирида (95% ДИ – 0,005–0,16; p<0,0001).
Терапия ингибиторами SGLT2 в настоящее время рекомендована в качестве дополнения к метформину [1, 19]. Результаты КИ указывают на то, что комбинация эмпаглифлозина с метформином является эффективным и безопасным вариантом усиления сахароснижающей терапии для пациентов, не достигших оптимального гликемического контроля на фоне монотерапии метформином.
С течением времени происходит постепенное прогрессирующее ухудшение секреции инсулина β-клетками поджелудочной железы, ухудшаются показатели гликемии, что обусловливает необходимость в более интенсивной сахароснижающей терапии. Перспективным направлением интенсификации сахароснижающей терапии является комбинация ингибиторов SGLT2 с инсулином, поскольку взаимодополняющее действие лекарственных средств может давать ряд существенных клинических преимуществ в случае выбора такой комбинации.
В частности, в 78-недельном исследовании с участием пациентов с неудовлетворительным контролем гликемии на инсулинотерапии добавление эмпаглифлозина в дозах 10 и 25 мг/сут привело к значимому снижению уровня HbA1c на 0,46 и 0,62% соответственно [45]. Применение эмпаглифлозина также сопровождалось улучшением уровня ГПН (-0,7 и -1 ммоль/л для дозы 10 и 25 мг/сут соответственно).
Крайне интересны для клинической практики результаты рандомизированного сравнительного КИ, изучавшего эффективность применения эмпаглифлозина или плацебо у пациентов с СД2 с неудовлетворительным контролем гликемии на фоне множественных инъекций инсулина [46]. В течение 52 недель больные СД2 в дополнение к сопоставимой сахароснижающей терапии получали эмпаглифлозин в дозах 10 мг/сут (n=186, исходно HbA1c – 8,39±0,74%, доза инсулина – 90±38 ЕД) и 25 мг/сут (n=189, исходно уровень HbA1c – 8,29±0,72%, доза инсулина – 93±46 ЕД) или плацебо (n=188, исходно уровень HbA1c – 8,33±0,72%, доза инсулина – 93±49 ЕД). Первичная конечная точка включала изменение от исходного уровня HbA1c. Дизайн КИ предусматривал, что на протяжении 18 недель и с 40-й по 52-ю неделю в группах фармакотерапии доза инсулина оставалась стабильной, а в период с 18-й по 40-ю неделю она титровалась до достижения целевых показателей ГПН<5,5 ммоль/л, постпрандиальной гликемии <7,8 ммоль/л.
Назначение эмпаглифлозина уже через 4 недели привело к улучшению гликемического контроля, которое сохранялось до конца наблюдения. Уровни HbA1c на протяжении всего КИ в группе эмпаглифлозина были значимо ниже по сравнению с группой плацебо. В конце исследования уровень HbA1c снизился на 1,18% в группе эмпаглифлозина 10 мг (разница с группой плацебо составила -0,38%, 95% ДИ – -0,59; -0,16; p<0,001) и на 1,27% в группе эмпаглифлозина 25 мг (разница с группой плацебо составила -0,46%, 95% ДИ – -0,46; -0,67; p<0,001). Следует отметить, что добавление к инсулину эмпаглифлозина позволило достичь целевого уровня HbA1c у большего процента пациентов с СД2. Уровня HbA1c<7,0% достигли 31,4 и 41,7% пациентов в группе эмпаглифлозина 10 и 25 мг соответственно, а в группе плацебо – 21% пациентов. Наконец, терапия эмпаглифлозином привела к потере массы тела (в среднем -2,1 кг) по сравнению с увеличением массы тела, отмеченным у пациентов группы плацебо.
Дополнительные эффекты на факторы сердечно-сосудистого риска
Помимо достижения контроля гликемии лечение СД2 также должно быть направлено на коррекцию других нарушений, сопутствующих заболеванию [4–6, 8]. Эффективность в отношении воздействия на сердечно-сосудистые факторы риска становится дополнительным основанием для использования эмпаглифлозина в качестве сахароснижающего препарата. Проблемой лечения СД2 нередко является повышение массы тела пациентов. К сахароснижающим препаратам, потенциально увеличивающим массу тела, относят производные ПСМ, тиазолидиндионы, инсулин. Важной отличительной чертой ингибиторов SGLT2 является их способность снижать массу тела. Считается, что ингибирование котранспортеров SGLT2 приводит к потере 60–80 г/сут глюкозы с мочой, в результате создается отрицательный энергетический баланс за счет ежедневной потери 240–320 ккал [17, 18]. Согласно результатам КИ, применение эмпаглифлозина приводит к достоверному снижению массы тела пациентов уже через 24 недели лечения. Причем диапазон потери массы тела составляет от 1,4 до 2,9 кг в зависимости от продолжительности КИ и фоновой сахароснижающей фармакотерапии; в частности, при более длительной терапии снижение массы тела достигает 3,1–3,6 кг [37–41]. Следует отметить, что похудение, связанное с применением эмпаглифлозина, поддерживается на протяжении периода до 104 недель [45]. Подобный результат имеет большое значение, поскольку увеличение массы тела у больных СД2 со временем становится одной из весомых причин ухудшения гликемического контроля.
В настоящее время внимание клиницистов привлекает действие ингибиторов SGLT2 на АД. Применение эмпаглифлозина в качестве монотерапии или в сочетании с другими сахароснижающими препаратами снижало не только уровень HbA1c, массу тела, но и оказывало умеренное антигипертензивное действие. Объединенные данные исследований III фазы показали, что терапия эмпаглифлозином в суточных дозах 10 и 25 мг приводила к достоверному уменьшению показателей систолического АД (САД) на 3,4 и 3,8 мм рт.ст. соответственно без изменения частоты сердечных сокращений [37–43]. Важно, что эффект снижения АД не приводит к ортостатической гипотензии. Причем в КИ у пациентов с неконтролируемым САД (САД>140 мм рт.ст.) отмечено заметно большее снижение этого показателя – до 7 мм рт.ст.
Завершая обсуждение вопросов эффективности эмпаглифлозина, следует отметить, что его применение обеспечивает стабильный эффект, характеризующийся значительным снижением уровня HbA1c, ГПН, постпрандиальной гликемии независимо от используемой фоновой сахароснижающей терапии, стабильно обеспечивает дополнительную пользу в виде уменьшения массы тела – даже при его использовании в комбинации с инсулином и в виде снижения САД.
Основные вопросы безопасности эмпаглифлозина
Общий профиль безопасности эмпаглифлозина изучен в полном объеме в КИ с участием более 15 тыс. пациентов. В целом он схож с профилем безопасности, характеризующим класс ингибиторов SGLT2 [24]. Инсулиннезависимый механизм действия ингибиторов SGLT2 способствует низкому риску развития гипогликемии. Объединенные данные исследований III фазы, оценивавшие применение эмпаглифлозина в качестве монотерапии, продемонстрировали низкий риск гипогликемии, аналогичный данному риску при использовании плацебо [37]. Частота гипогликемии несколько выше при применении эмпаглифлозина в комбинации с ПСМ [41]. Повышенный риск гипогликемии присутствует при использовании эмпаглифлозина в дополнение к инсулину [42, 45]. В связи с этим рекомендуется коррекция дозы инсулина и/или ПСМ с целью уменьшения риска гипогликемии.
Что касается побочных эффектов при приеме эмпаглифлозина, то, согласно данным КИ, препарат отличает благоприятный профиль переносимости [37]. Не секрет, что присутствие глюкозы в моче традиционно рассматривается как патологическое явление. Учитывая глюкозурический эффект ингибиторов SGLT2, возможные опасения вызывает риск развития инфекций мочевыводящих путей (ИМВП) и грибковых генитальных инфекций. Эти инфекции являются широко распространенными среди пациентов с СД2, особенно среди лиц с неудовлетворительным гликемическим контролем. Причина лишь частично кроется в присутствии глюкозы в моче, весомое значение имеет хроническая гипергликемия, снижение функции иммунной системы, в т.ч. на локальном уровне [47].
Действительно, все представители класса ингибиторов SGLT2 увеличивают частоту грибковых генитальных инфекций и в гораздо меньшей степени частоту инфекций мочевыводящих путей [18, 24]. Согласно объединенным результатам КИ III фазы, наиболее частыми побочными эффектами эмпаглифлозина были генитальные инфекции, инфекции мочевыводящих путей (большинство легкой или умеренной степени тяжести), особенно у лиц женского пола. Большинство инфекций, а их риск в основном присутствовал у пациентов с СД2, имевших в анамнезе хронические или рецидивирующие генитальные инфекции и инфекции мочевыводящих путей, обычно не требовали прекращения приема эмпаглифлозина в КИ, а их лечение проводилось стандартными лекарственными средствами.
Высокий сердечно-сосудистый риск сопутствует СД2, поэтому определяющим фактором при выборе сахароснижающего препарата для долгосрочного применения является кардиоваскулярная безопасность; снижение риска ССЗ является важной составляющей мероприятий, направленных на улучшение прогноза и увеличение продолжительности жизни больных СД2 [4, 5]. Изучение кардиоваскулярной безопасности эмпаглифлозина стало отправной точкой для проведения исследования EMPA-REG OUTCOME® [48]. Это долгосрочное многоцентровое рандомизированное двойное слепое плацебо-контролируемое исследование сердечно-сосудистых исходов на фоне применения эмпаглифлозина с участием более чем 7000 пациентов с СД2 и высоким риском сердечно-сосудистых событий; критерии включения представлены в таблице.
В соответствии с дизайном исследования пациенты принимали эмпаглифлозин (10 или 25 мг/сут) или плацебо в качестве дополнения к стандартной терапии. Первичная конечная точка была определена как до наступления первого любого из следующих событий комбинированной первичной конечной точки: смерти от сердечно-сосудистых причин, нелетального ИМ или нелетального инсульта. Исследование должно было продолжаться до подтвержденного наступления первичной конечной точки не менее чем у 691 пациента, в итоге средняя длительность лечения составила 2,6 года, а медиана длительности наблюдения – 3,1 года.
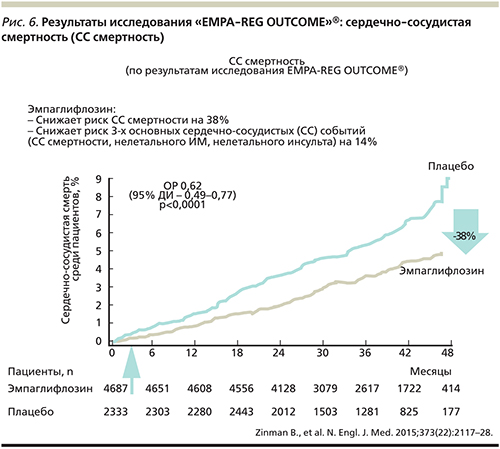
По результатам исследования были сделаны выводы, что при применении эмпаглифлозина в дополнение к стандартной терапии на 14% снизился риск основных неблагоприятных сердечно-сосудистых событий: смерти от ССЗ, нефатального ИМ или инсульта у пациентов с СД2 с высоким риском возникновения сердечно-сосудистых событий (рис. 5). Более того, применение эмпаглифлозина уменьшило сердечно-сосудистую смертность на 38% (рис. 6), общую – на 32%, а количество госпитализаций по поводу сердечной недостаточности на 35%. При анализе данных 7020 пациентов, участвовавших в этом исследовании, было продемонстрировано, что на фоне терапии эмпаглифлозином предотвращается каждый третий летальный исход по причине ССЗ, а для предотвращения 1 случая от сердечно-сосудистой смерти необходимо пролечить в течение трех лет 39 пациентов.
Говоря об итогах исследования «EMPA-REG OUTCOME»®, которое существенно пополнило доказательную базу эффективности препарата, очевидно, что в настоящее время эмпаглифлозин – это единственный препарат для лечения СД2, который продемонстрировал способность снижать риск развития ССЗ и уровень смертности от них. Результаты этого исследования, несомненно, заслуживают внимания практических врачей и имеют большое практическое значение, поскольку именно ССЗ являются основной причиной преждевременной смертности больных СД2.
В заключение следует отметить: эффективная фармакотерапия СД2 остается одной из основных проблем диабетологии. Применение эмпаглифлозина на различных этапах терапии заболевания делает достижение длительного контроля гликемии и снижение сердечно-сосудистых рисков вполне реальной целью, имеет определяющее значение для улучшения прогноза СД2.



