При хронических воспалительных процессах, обусловленных персистирующей или латентной инфекцией, без дополнительной активации иммунной защиты невозможно добиться удовлетворительных результатов лечения. В оптимальном варианте защиты организма острая инфекция должна разрешаться в среднем в течение 2–4 недель от начала заболевания. Переход острого инфекционного воспаления в затяжное или хроническое, тем более наличие хронического инфекционного процесса, который продолжается месяцы или годы, говорят о несостоятельности иммунитета, следовательно, о необходимости его коррекции. Кроме того, роль иммунной системы не ограничена лишь защитными функциями при взаимодействии с патогенами. После ликвидации инфекционного агента и элиминации из организма веществ инфекционной природы иммунная система целенаправленно восстанавливает ткани и способствует регенерации дефектов, возникших на фоне инфекции [1].
Иммуномодуляторы – это лекарственные препараты, восстанавливающие в терапевтических дозах функции иммунной системы (эффективную иммунную защиту). При остром инфекционном воспалении применение иммуномодулятора уменьшает глубину повреждений в воспаленной ткани, сокращает сроки выздоровления, предотвращает хронизацию процесса [8]. При рецидивирующем течении хронической инфекции применение иммуномодулятора позволяет существенно увеличить продолжительность ремиссии, снизить выраженность и длительность клинических проявлений болезни при ее обострении.
Иммунокоррекция должна быть адекватной по периодичности, продолжительности и направленности действия иммуномодулятора на те или иные звенья иммунитета. Нельзя применять иммуномодулирующие препараты бессистемно, каждый иммуномодулятор имеет свои оригинальные свойства и должен применяться в определенных конкретных случаях иммунокоррекции. Только доказанная клиническая эффективность определенного препарата при лечении конкретной болезни может служить основой при выборе иммуномодулятора в практике врача. Более того, для каждого препарата определены не только заболевания, при которых он будет эффективным, но и фазы этих заболеваний, когда применение иммуномодулятора будет наиболее целесообразно.
Так, при вирусной инфекции основным фактором иммунной защиты служит система интерферонов (ИФН). Образование и действие ИФН составляют важнейший механизм врожденного (естественного) иммунитета. Выработка ИФН – первая линия защиты клетки от вирусной инфекции, значительно опережающая синтез специфических антител и другие факторы иммунитета. Система ИФН присутствует во всех клетках организма; при проникновении в клетку любого вируса в ней вырабатываются ИФН, блокирующие синтез вирусспецифических белков. Таким образом, ИФН ингибируют внутриклеточные этапы репродукции вирусов в зараженных клетках и обеспечивают невосприимчивость к вирусам окружающих здоровых клеток [4].
Исходя из вышесказанного, можно сделать выводы, что нарушение в системе ИФН приводит к повышенной восприимчивости макроорганизма к вирусным инфекциям, недостаточно эффективной защите его от вирусов, что в свою очередь способствует хронизации инфекционного процесса и более тяжелому течению вирусной инфекции. Идеи активации собственной системы ИФН в организме за счет индукции ИФН для профилактики и лечения вирусных инфекций были использованы с целью создания лекарственных препаратов – индукторов эндогенного (аутологичного) ИФН [3]. Накопленный опыт их применения позволяет рассматривать индукторы эндогенного ИФН в качестве эффективных противовирусных препаратов.
Индукторы ИФН являются препаратами с комбинированным эффектом: этиотропным, направленным непосредственно на вирус-возбудитель, и иммуномодулирующим, т.е. корригирующим нарушения системы иммунитета. В результате многолетнего целенаправленного скрининга отечественным исследователям удалось выявить несколько весьма перспективных для медицины индукторов ИФН, имеющих высокий химиотерапевтический индекс и пригодных для профилактики и лечения вирусных инфекций, других заболеваний. Широкое системное использование индукторов ИФН различной природы показало, что их активность совпадает с активностью экзогенных ИФН – они активируют макрофаги, цитотоксические Т-клетки, антителообразующие В-клетки, естественные киллеры. Действие индукторов ИФН осуществляется в комплексе с другими медиаторами воспалительных и иммунных ответов (цитокинов), а также совместно с гормонами и нейромедиаторами.
Кроме этого индукторы ИФН обладают рядом преимуществ перед рекомбинантными ИФН [4]:
- в отличие от наиболее широко используемых в настоящее время рекомбинантных ИФН они не обладают антигенностью;
- синтез ИФН при введении индукторов сбалансирован и контролируется организмом, что предотвращает побочные эффекты, наблюдаемые при введении рекомбинантных ИФН;
- однократное введение некоторых из индукторов ИФН приводит к длительной продукции и поддержанию уровня ИФН в терапевтической концентрации, тогда как для достижения подобного уровня ИФН при использовании экзогенных препаратов короткого периода полужизни (20 минут) требуется многократное введение их в значительных дозах;
- некоторые индукторы ИФН обладают уникальной способностью «включать» синтез цитокинов в отдельных популяциях клеток и органов, что нередко имеет определенные преимущества перед поликлональной стимуляцией иммуноцитов.
Отечественный индуктор ИФН Кагоцел® синтезирован на основе натриевой соли карбоксиметилцеллюлозы и низкомолекулярного полифенола, выделенного из хлопчатника. Кагоцел® вызывает образование в организме человека позднего ИФН, являющегося смесью ИФН-α и ИФН-β, обладающих высокой антивирусной активностью. Кагоцел® стимулирует продукцию ИФН практически во всех популяциях клеток, принимающих участие в иммунном ответе организма: Т- и В-лимфоцитах, макрофагах, гранулоцитах, фибробластах, эндотелиальных клетках. При приеме внутрь одной дозы препарата титр ИФН в сыворотке крови достигает максимальных значений через 48 часов, ИФН-ответ на введение Кагоцела® характеризуется продолжительной (до 4–5 суток) циркуляцией ИФН в кровотоке [6].
Показания к применению препарата Кагоцел®:
- лечение герпетической инфекции у взрослых, включая генитальный и рецидивирующий герпес;
- лечение и профилактика гриппа и других острых респираторных вирусных инфекций (ОРВИ) у взрослых и детей в возрасте от 3 лет.
Противопоказания: повышенная индивидуальная чувствительность к препарату, беременность, лактация, детский возраст до 3 лет, дефицит лактазы, непереносимость лактозы, глюкозо-галактозная мальабсорбция.
Для достижения лечебного эффекта прием Кагоцела® следует начинать не позднее четвертого дня от начала заболевания.
Лечение хронических, часто рецидивирующих форм герпесвирусной инфекции до настоящего времени представляет определенные трудности, которые объясняются особенностями взаимодействия вируса с макроорганизмом [2, 10, 16, 18]. Каждый врач в своей практической работе так или иначе сталкивается со сложностью решения этой задачи, требующей индивидуального подхода к каждому пациенту, страдающему герпесвирусной инфекцией. Давно разработаны четкие схемы противовирусной терапии при разных формах герпесвирусной инфекции, но зачастую клиницист приходит к следующему выводу: монотерапия противовирусными препаратами не позволяет достигать желаемых результатов. Поэтому проводится много исследований, призванных подобрать оптимальные схемы сочетанной терапии. Перспективным подходом к лечению рецидивирующей герпесвирусной инфекции наряду с использованием классических противовирусных препаратов (ациклических нуклеозидов) считается восстановление нарушенной работы звена противовирусной защиты, т.е. применение иммунотропных препаратов [5, 13, 15].
Целесообразность применения индукторов ИФН подтверждается исследованиями, свидетельствующими о значительном нарушении ИФН-статуса пациентов с рецидивирующим герпесом [9, 14, 17]. Многие авторы в своих работах отмечают, что использование препаратов ИФН в терапии простого рецидивирующего герпеса приводит к выраженному улучшению течения заболевания: уменьшению клинических проявлений во время рецидива, ускорению реэпителизации, урежению частоты рецидивов. Так, в 2001 г. А.Е. Шульженко и соавт. проведено открытое исследование на базе отделения общей аллергологии и иммунотерапии больницы № 86 клиники ГНЦ Института иммунологии МЗ РФ и отдела интерферонов ГУ НИИЭМ им. Н.Ф. Гамалеи РАМН. В исследовании приняли участие 60 пациентов, мужчин и женщин в возрасте от 18 до 65 лет, страдающих генитальной формой хронической рецидивирующей герпесвирусной инфекции, с частотой рецидивов не менее 6 раз в год [7].

В исследование были включены пациенты в фазе обострения процесса или в период продромы, но не более чем через 48 часов от момента появления высыпаний. Пациентов разделили на 3 группы: 1-я группа (30 человек) получала монотерапию Кагоцелом® по 2 таблетки 3 раза в день внутрь в течение 5 дней, 3-я группа (15 человек) – базисную терапию Ацикловиром по 0,2 г 5 раз в день 5 дней + антиоксиданты (аскорбиновую кислоту по 0,5 г 2 раза в день и α-токоферол по 0,4 г 1 раз в день, также в течение 5 дней) и 2-я группа (15 человек) получала Кагоцел® и стандартную базисную терапию (Ацикловир + антиоксиданты) по указанным выше схемам. Оценивались частота, длительность и тяжесть рецидива, ИФН-статус пациентов до и после лечения, профиль безопасности препарата.
Сравнительный анализ клинической оценки эффективности показал: до начала лечения частота рецидивов у пациентов колебалась от 5,7 в 1-й группе до 6,3 во 2-й; в 3-й группе она составляла 6,0 в течение 6 месяцев до участия в исследовании. То есть в общей сложности частота рецидивов у пациентов составляла от 6 и более раз за год. После терапии у пациентов 1-й группы частота рецидивов снизилась с 5,7 до 2,9 раза; у пациентов 2-й – с 6,3 до 2,9; у пациентов 3-й группы – с 6,0 до 5,6 раза в год. Длительность рецидивов до лечения у пациентов 1-й группы составила в среднем 7,2 дня; у пациентов 2-й – 5,4; у пациентов 3-й группы – 5,7 дня. Длительность рецидивов после лечения составила у пациентов 1-й группы в среднем 3,5 дня (уменьшилась на 3,7 дня); у пациентов 2-й – 2,8 (уменьшилась на 2,6 дня), у пациентов 3-й группы – 5,5 дня. Тяжесть течения рецидивов до лечения составила 12,7 балла у пациентов 1-й группы; 12,0 баллов – у пациентов 2-й и 10,9 балла у пациентов 3-й группы. После лечения пациентов 1-й группы тяжесть течения рецидивов в среднем уменьшилась до 9,2 балла (на 3,5 балла); у пациентов 2-й группы – до 7,3 (на 4,7 балла); у пациентов 3-й группы – до 10,7 (на 0,2 балла). Таким образом, у пациентов, получавших Кагоцел®, наблюдалось достоверное уменьшение частоты (в 1,97 раза в 1-й группе; в 2,17 – во 2-й), длительности (в 2,06 раза в 1-й группе, в 1,93 – во 2-й) и тяжести течения рецидивов (в 1,38 раза в 1-й группе, в 1,64 – во 2-й). Ни у кого из пациентов в ближайшем отдаленном периоде после лечения (т.е. в течение 6 месяцев с момента проведения терапии) ухудшения течения заболевания не отмечено.
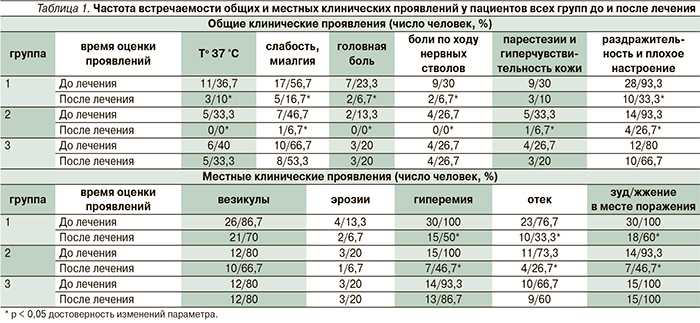
До лечения у пациентов всех групп как местные, так и общие клинические признаки рецидива заболевания встречались практически с одинаковой частотой. После лечения наблюдалось уменьшение как местных, так и общих признаков воспаления у пациентов 1-й и 2-й групп. У пациентов 3-й группы существенных изменений после лечения не произошло (табл. 1). Среди местных симптомов произошло заметное уменьшение гиперемии, отека и зуда/жжения в местах поражения (у пациентов 1-й группы снизилось на 50,0; 43,4 и 40,0 % соответственно; у пациентов 2-й группы – на 53,3, 46,6 и 46,6 % соответственно). У пациентов 3 (контрольной) группы наблюдалось недостоверное уменьшение частоты, длительности и тяжести течения рецидивов, а также незначительное снижение частоты встречаемости местных и общих клинических проявлений воспаления в ближайшем отдаленном периоде после лечения [11] (табл. 1).
Таким образом, у пациентов 1-й и 2-й групп наблюдается достоверное снижение частоты, длительности и тяжести течения рецидивов в ближайшем отдаленном периоде: у пациентов 1-й и 2-й групп частота в среднем составляет 2,9 раза в год, длительность рецидива – 3,5 и 2,8 дня, а тяжесть течения рецидива – 9,2 и 7,3 балла соответственно. У пациентов 3-й группы наблюдается недостоверное уменьшение частоты, длительности и тяжести течения рецидивов в ближайшем отдаленном периоде. Уменьшение частоты встречаемости местных клинических проявлений воспаления у пациентов 1-й группы в среднем произошло на 44,5 %; у пациентов 2-й – на 48,8 %; у пациентов 3-й группы – на 4,5 %. Уменьшение частоты встречаемости общих клинических проявлений у пациентов 1-й группы в среднем произошло на 20 %; у пациентов 2-й – на 24,4 %; у пациентов 3 группы – на 10,1 %.
У всех пациентов до лечения наблюдалась недостаточность стимулированной ИФН-реакции лейкоцитов периферической крови в отношении как ИФН-α, так и ИФН-γ; показатели иммунограммы находились в пределах физиологической нормы, показатель NK-активности был снижен или достигал уровня нижней границы нормы; в цитокиновом профиле превалировала выработка провоспалительных цитокинов [12]. Выяснилось, что Кагоцел® обладает иммунотропным влиянием, которое выражается в нормализации показателей расширенного ИФН-статуса, иммунограммы и преимущественной выработки цитокинов профиля Th-1 (рис. 1). Так, при изучении показателей цитокинового профиля методом определения мРНК цитокинов у пациентов, страдающих генитальной формой хронической рецидивирующей герпесвирусной инфекцией, во время рецидива наблюдалась следующая закономерность:
- в начале обострения превалируют ИФН-α и ИЛ-18; в меньшей степени повышены ИЛ-4, ИЛ-6, ИЛ-8 и ИЛ-10, что указывает на активацию Th-2 лимфоцитов;
- в конце рецидива (после лечения) преобладают ИЛ-1β, ИЛ-12 и ФНО-α, а также ИФН-γ и ИЛ-2, что в свою очередь указывает на активацию моноцитарно-макрофагального звена, а также Th-1 лимфоцитов.
Известно, что цитокины, вырабатываемые лимфоцитами Th-1-типа, способствуют уменьшению репликации вируса и ускорению клинического выздоровления, в то время как цитокины Th-2-типа обладают противоположным действием. Являясь основным продуктом Th-1-клеток, ИФН-γ усиливает развитие клеточного иммунитета, обладает противоопухолевым и противовирусным действиями, повышает цитотоксичность CD8-лимфоцитов, являющихся важными участниками противовирусного иммунитета. На фоне приема Кагоцела® в большей степени развивался цитокиновый ответ по Th-1-типу, в то время как Th-2-ответ подавлялся; этот сдвиг иммунного ответа является положительным моментом в лечении, т.к. нивелирует парадоксальную активацию гуморального звена при герпесвирусной инфекции [12].
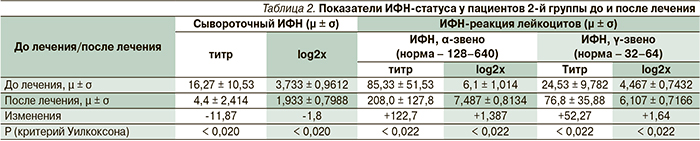
Количество стимулированного ИФН-α до лечения у пациентов 1-й группы в среднем было 60,0 ЕД/мл (при норме от 128 до 640 ЕД/мл); у пациентов 2-й – 85,3; у пациентов 3-й группы – 56,0 ЕД/мл, что является проявлением ИФН-недостаточности у пациентов со среднетяжелым и тяжелым течением хронической рецидивирующей герпесвирусной инфекции. Количество стимулированного ИФН-γ также было недостаточным – в среднем 23,5, 24,5 и 17,1 ЕД/мл соответственно по группам (норма – 32–64 ЕД/мл). Таким образом, в среднем эти показатели не достигали даже нижней границы нормы.
У пациентов 1-й группы наблюдалось 100 %-ное снижение стимулированного ИФН-α до лечения; у пациентов 2-й – у 73,3 %, в 3-й группе – у 93,3 % пациентов. Стимулированной выработкой ИФН-γ до лечения страдали 53,3 % пациентов 1-й группы, 40 % пациентов 2-й и 93,3 % пациентов 3-й группы. У остальных пациентов показатель соответствовал нижней границе нормы (т.е. 32 ЕД/мл) и лишь у одной пациентки 1-й группы был 64 ЕД/мл.
После лечения выработка лейкоцитами ИФН-α в ответ на стимуляцию ВБН у пациентов 1-й группы увеличилась на 110,7 ЕД/мл; у пациентов 2-й – на 122,7; у пациентов 3-й группы – на 29,3 ЕД/мл после курса терапии. Выработка ИФН-γ лейкоцитами периферической крови в ответ на стимуляцию СЭА после лечения увеличилась на 49, 52 и 2 ЕД/мл соответственно по группам. После курса терапии произошла нормализация стимулированной продукции ИФН-реакции лейкоцитов периферической крови по α-звену у 73,3 % пациентов 1-й группы, у 86,7 % пациентов 2-й; по γ-звену у 100 % пациентов 1- и 2-й групп.
В табл. 2 представлены наиболее значимые результаты восстановления ИФН-статуса, полученные у пациентов в группе 2. У пациентов 3-й (контрольной) группы нормализация этих показателей после лечения произошла лишь в 26,7% случаев как по α-, так и по γ-звену.
Многочисленные данные указывают на то, что ИФН являются основными цитокинами в противовирусном иммунном ответе, а также важным компонентом врожденного иммунитета, ограничивающим герпесвирусную инфекцию [4]. ИФН может полностью блокировать экспрессию вирусных генов в инфицированных клетках и даже регулировать фенотип дикого и мутантного типов вирусов герпеса в условиях in vivo. Противовирусный эффект ИФН-α/β при герпесвирусной инфекции уже давно доказан и широко используется в терапии [8]. Кроме того, действие ИФН-α и -β на иммунный ответ проявляется в усилении выработки некоторых цитокинов, в частности ИЛ-1 и ИЛ-2, активирующих клеточный иммунный ответ. ИФН-γ вносит более существенный, чем ИФН-α/β, вклад в иммунорегуляцию. Важнейшей функцией ИФН-γ является его участие в опосредовании взаимосвязей между лимфоцитами и макрофагами и в регуляции соотношения клеточной и гуморальной составляющих иммунного ответа [17]. Кроме этого под воздействием ИФН-γ макрофаги активно вырабатывают и выделяют NO – вещество, обладающее антивирусными свойствами.
У пациентов 1-й, 2-й и 3-й групп определяли уровень чувствительности к препаратам ИФН-α (с использованием прайминг-эффекта). Пациента считали чувствительным к ИФН-α, если его клетки крови отвечали увеличением ВБН-индуцируемой продукцией ИФН при праймировании хотя бы одним из 3 препаратов ИФН-γ: человеческим лейкоцитарным ИФН (ЧЛИ), лейкинфероном, реафероном. Определялся также и уровень чувствительности к препарату ИФН-γ – гаммаферону (с использованием прайминг-эффекта). Кроме этого проводилось определение уровня чувствительности к следующим индукторам ИФН: ридостину, циклоферону и Кагоцелу®. Пациента считали чувствительным к индукторам ИФН, если его клетки крови продуцировали ИФН при действии хотя бы одного из препаратов. Все эти данные получены in vitro; параметры определялись в первые сутки на фоне рецидива до приема препаратов, а также на 7-е сутки от начала терапии. В среднем у пациентов 1-й группы до лечения отмечалась слабая чувствительность к препаратам ИФН (от 2,5 до 3,3 балла) и нормальная чувствительность к индукторам интерферона (от 14,1 до 19,2 ЕД-титр). После лечения чувствительность ко всем препаратам ИФН и к индукторам ИФН снизилась. У пациентов 2-й группы изначально до лечения, так же как и у пациентов 1-й группы, отмечается низкая чувствительность in vitro к препаратам интерферона (в среднем от 2,5 до 3,3 балла) и нормальная чувствительность к индукторам интерферона (от 11,7 до 22,4 ЕД). После курса терапии чувствительность к препаратам интерферона снизилась; по отношению к гаммаферону наблюдалось достоверное снижение чувствительности. Ко всем индукторам интерферона, используемым в эксперименте, после лечения чувствительность in vitro возросла; причем к Кагоцелу® чувствительность возросла на 6 ЕД, к циклоферону на 8,8 , к ридостину – на 9 ЕД.
У пациентов 3-й (контрольной) группы до лечения аналогично двум предыдущим группам отмечалась слабая чувствительность к препаратам интерферона (от 2,3 до 2,6 балла) и нормальная чувствительность к индукторам (в среднем от 8,5 до 11,2 ЕД). После лечения не отмечается достоверного изменения чувствительности как к препаратам ИФН-α и ИФН-γ гаммаферону, так и к индукторам интерферона (рис. 2, 3).

На основании полученных результатов доказано, что комбинированная терапия (Кагоцел®, Ацикловир и антиоксиданты) приводит к увеличению чувствительности к индукторам ИФН in vitro после лечения, что дает возможность при необходимости продолжить терапию в фазе ремиссии (возможность назначения поддерживающих доз препарата). Назначение же монотерапии Кагоцелом® после лечения приводит к логичному снижению чувствительности (в т.ч. достоверному) как к препаратам ИФН, так и к индукторам ИФН. Следовательно, сочетанное использование Кагоцела® и Ацикловира более перспективно, чем монотерапия одним из этих препаратов [6]. Среди пациентов, страдающих хронической рецидивирующей герпесвирусной инфекцией, особенно при средней и тяжелой степени течения заболевания (т.е. более 6 рецидивов в год), наблюдается интерфероновая недостаточность различной степени; эти пациенты не в состоянии адекватно отвечать выработкой интерферонов на герпесвирусную индукцию. Кроме этого вирус простого герпеса вообще является довольно слабым интерфероногеном в силу отсутствия в цикле его репликации производства двуспиральных РНК, которые являются наиболее мощными стимуляторами выработки интерферонов человеческой клеткой.
При герпесвирусной инфекции вирусиндуцированная выработка ИФН происходит другими путями. Ацикловир не стимулирует выработку ИФН, но в процессе течения рецидива у этих пациентов естественным образом производится некоторое количество ИФН-α и еще меньшее количество ИФН-γ. Несмотря на то что ИФН-система работает у них с напряжением, без дополнительной стимуляции выработанного количества ИФН едва хватает на купирование рецидива. Это в определенной степени может быть связано с истощением механизмов синтеза ИФН при частых рецидивах и неадекватным восстановлением этой системы во время коротких ремиссий. Следовательно, можно предположить, что выработка того или другого типа ИФН во время рецидива на фоне терапии по типу обратной связи подавляет in vitro-чувствительность к тому типу ИФН, который вырабатывался в большем количестве.
Сочетание индуктора интерферона Кагоцела® и Ацикловира привело к повышению, в т.ч. достоверному, чувствительности клеток к индукторам ИФН, что дает возможность продолжения терапии (назначения поддерживающих доз препарата) в фазе ремиссии.
Терапия рецидива генитального герпеса Кагоцелом® клинически эффективна: наибольшее влияние на течение заболевания отмечается при назначении сочетанной терапии Кагоцелом®, Ацикловиром и антиоксидантами.
Эпизодическая терапия базисными противовирусными препаратами эффективна только на период длительности рецидива и не оказывает влияния на дальнейшее течение заболевания.
Кагоцел® не обладает токсическим воздействием на функции почек, печени и периферического кроветворения; не вызывает аллергических реакций и побочных эффектов.
К аналогичным выводам пришли А.А. Халдин и соавт. по результатам многоцентрового когортного открытого контролируемого исследования эффективности препарата Кагоцел® при лечении генитального и лабиального герпеса. В исследование были включены пациенты обоего пола в возрасте от 18 до 65 лет с первичным эпизодом и рецидивами генитального и лабиального герпеса. Всего под наблюдением находились 146 пациентов: 63 мужчины и 83 женщины. Больные были разделены на три группы. Пациенты I группы получали только Кагоцел® по схеме 2 таблетки 3 раза в сутки в течение 5 дней (106 больных: 48 мужчин и 58 женщин), III – только Ацикловир по схеме 1 таблетка (200 мг) Ацикловира 5 раз в день в течение 5 дней (30 больных: 12 мужчин, 18 женщин), II группа – Кагоцел® и Ацикловир по указанным выше схемам (10 больных: 4 мужчины и 6 женщин). Выраженность клинических признаков – боли, зуда, жжения, эпителизации эрозий, очищения от высыпаний – оценивалась в баллах до лечения, на 5-й день лечения и через 10 дней после его окончания.
Сравнительный анализ клинической оценки эффективности лечения показал, что наилучшие результаты получены от больных I и II групп: эволюция клинических проявлений завершилась через 5,6 и 3,2 дня соответственно, тогда как в III группе этот срок составил 6,4 дня. При наблюдении в течение года после лечения у 22,2 % пациентов рецидивов не отмечено, у 11 % был один рецидив, у 38,9 % два и у остальных три рецидива. При оценке безопасности Кагоцела® ни у одного больного не было отмечено побочных действий и случаев отмены препарата, а также не наблюдалось неблагоприятных или серьезных неблагоприятных явлений [9].
Подводя итоги, можно сказать, что к настоящему времени индукторы ИФН заняли достойное место в терапии герпесвирусных инфекций как антивирусные препараты и корректоры иммунитета в период развития иммунного ответа для эффективного завершения терапии, предотвращения хронизации процесса и рецидивов. Отечественный индуктор ИФН Кагоцел® благодаря его клинико-иммунологической эффективности (противовирусное действие, повышение неспецифической и специфической резистентности организма) является высокоэффективным средством лечения хронической герпесвирусной инфекции. Кроме того, Кагоцел® обладает высоким профилем безопасности и доступен каждому пациенту.



