Малокровие, или анемия, – это синдром, объединяющий клинические проявления и гематологические лабораторные показатели. В основе данного собирательного синдрома лежит гипоксия тканей и органов, которая развивается вследствие снижения уровня гемоглобина в крови. Причин снижения уровня гемоглобина множество: острая или хроническая кровопотеря, нарушение образования эритроцитов, усиленное разрушение эритроцитов, токсическое действие ряда веществ на эритроциты или сочетание нескольких причин [1]. В современном мире анемии, развившиеся в результате разных этиологических факторов, выявляются у 20% населения, бóльшую часть которого составляют женщины. Самый распространенный вид ане-мии – это анемия, связанная с дефицитом железа, на ее долю приходится до 90% от всех остальных анемий.
В медицинской практике практически каждый врач сталкивается с железодефицитными состояниями (ЖДС) [2, 3]. Однако врачу важно помнить, что помимо пациентов с клинически ярко выраженной анемией на практике часто встречаются лица с латентным (скрытым) дефицитом железа (ЛДЖ). Статистически частота ЛДЖ колеблется от 19,5 до 30%. Дополнительно необходимо помнить, что от 50 до 86% женщин имеют факторы риска развития ЛДЖ или анемии. В ходе динамического наблюдения выявлено, что развитие дефицита железа у соматически здоровых женщин трудоспособного возраста колеблется от 6,3 до 25% случаев, а у женщин с наличием факторов риска развития ЖДС составляет от 12,3 до 46,2% соответственно [1].
Если это не острая и массивная кровопотеря, то развитие ЖДС – это длительный и часто скрытый, медленноразвивающийся процесс, когда вследствие множества причинных факторов развивается недостаток такого микроэлемента, как железо. Среднее содержание железа в организме человека составляет 4,5–5,0 г, из этого количества 2,5 г входит в состав гемоглобина, 140 мг уходит на миоглобин, в форме ферритина содержится 1600 мг железа у мужчин и 100–400 мг у женщин, в виде трансферрина 4 мг и 1 мг железа необходимы организму с целью утилизации кислорода в составе ферментов. При этом нельзя забывать о физиологической потере железа, которое выделяется с мочой, потом, калом, волосами, ногтями и не зависит от пола и возраста человека. Эти потери насчитывают до 1 мг/сут и более. Нельзя забывать и о таком физиологическом процессе, как менструация у женщин. Так, при умеренной менструации, длящейся 3–4 дня, потеря крови составляет 30–50 мл, при таком объеме потеря железа достигает примерно 15 мг. Ситуация значимо осложняется, если у женщины гиперполименорея, т.е. кровопотеря составляет более 50 мл. В таких ситуациях потеря железа может значимо возрастать. Еще одна важная ситуация в жизни женщины – это беременность, роды и кормление грудью. В этот период женщина отдает до 1700–1800 мг железа. Если провести сравнение с уровнем поступления железа в организм с пищей, то в суточном стандартном рационе содержится не более 2 мг железа. С учетом данного факта понятно, что при избыточной потребности организма в железе его дефицит первоначально пополняется из запасов депо железа в организме, но если ситуация не меняется, запасной фонд истощается, что приводит к формированию ЛДЖ и при сохранении такого режима расходования формируется ЖДА [4].
Причин железодефицита множество, но в его основе всегда лежит нарушение баланса между поступлением железа в организм и его расходом в сторону увеличения расхода.
Данное патологическое состояние наблюдается при следующих состояниях:
- острых и длительных хронических кровопотерях, связанных с множеством причин;
- повышенной потребности организма в железе;
- нарушении процесса усвоения железа в кишечнике;
- врожденных дефицитах железа;
- нарушении транспортировки железа вследствие дефицита трансферрина, что встречается при различных соматических патологиях.
Результатом всех вышеперечисленных факторов служит формирование железодефицита и гипосидеропенического и анемического синдромов в организме [5–17].
Клинически сидеропенический и анемический синдромы выражаются комплексом соматических проявлений, причиной которых служат недостаток железа и как следствие – развивающаяся тканевая и гемическая гипоксия. Это приводит к появлению множества клинических проявлений, таких как усиленное выпадение и истончение волос, сухость кожного покрова. Пациенты отмечают повышенную ломкость ногтей, появление поперечной исчерченности ногтевых пластин; ногтевые пластины искривляются и деформируются вплоть до образования ложкообразных (койлонихия) ногтевых пластин. Со стороны мочевыделительной системы может наблюдаться недержание мочи. У пациентов с дефицитом железа, особенно у девушек и женщин, часто возникает извращение вкусовых ощущений. Это может проявляться появлением необычных пристрастий, таких как пристрастие к сырому мясу, тесту, мелу, зубному порошку и т.д. Таких пациентов привлекают необычные и не привычные для здорового человека запахи плесени, бензина, керосина, ацетона, у них возникают другие необычные для здорового человека пристрастия. Сидеропения приводит к атрофии слизистой оболочки языка, ангулярному стоматиту, глосситу, кариесу зубов. При исследовании слизистой оболочки пищевода у таких больных могут выявляться участки ороговения, атрофических изменений в слизистой и мышечной оболочках пищевода, что может проявляться сидеропенической дисфагией (синдромы Пламмера–Винсона, Россолимо–Бехтерева). Кроме этого пациенты с ЖДС предъявляют жалобы на выраженную общую слабость, быструю утомляемость, постоянное ощущение усталости, разбитости, отмечают снижение работоспособности, частые головные боли, эпизоды головокружения, появление «мушек перед глазами», легкий шум в голове.
При осмотре врач выявляет у пациентов с ЖДС бледность кожных покровов и слизистых оболочек, сухость кожного покрова, изменения ногтевых пластин, тусклость и ломкость волос. Выраженность данных проявлений сидеропении зависит от длительности существования дефицита железа и степени тяжести анемии. При ЛДЖ эти симптомы выражены не так ярко и встречаются в 70% случаев, в то время как при выраженной ЖДА эти проявления присутствуют у 100% пациентов и обусловлены снижением не только уровня гемоглобина в крови, но и значительным снижением железозависимых и железосодержащих ферментов в организме, в т.ч. в мышцах, что способствует развитию внутриклеточной гипоксии [4, 6].
Если врач диагностирует истинную железодефицитную анемию (ЖДА), он обязан указать и степень тяжести выявленной анемии. От этого зависит и тактика ведения пациентов.
Эксперты Всемирной организации здравоохранения приняли следующую классификацию ЖДА [18]:
- Анемия легкой степени тяжести – уровень гемоглобина от 110 до 90 г/л.
- Умеренно выраженная анемия – уровень гемоглобина от 89 до 70 г/л.
- Тяжелая анемия – уровень гемоглобина в крови ниже 69 г/л.
С целью точного представления о состоянии обмена железа в организме врач наряду с определением концентрации сывороточного железа должен провести исследование общей железосвязывающей способности сыворотки (ОЖСС), определить насыщение трансферрина железом и уровень ферритина. У больных ЖДА выявляют снижение уровня сывороточного железа, повышение ОЖСС, увеличение латентной железосвязывающей способности, снижение процента насыщения трансферрина, а т.к. запасы железа в организме снижены, следовательно, закономерно снижено содержание ферритина в сыворотке крови. При этом важно помнить, что снижение уровня ферритина – это наиболее чувствительный и специфичный показатель дефицита железа в организме [14, 19, 20].
Помимо истинной ЖДА, о которой мы написали выше, выделяют и три стадии дефицита железа: предлатентный, латентный и манифестный [19–22]:
1. Дефицит железа – предлатентный.
В данный период в организме имеется истощение только депо. При обследовании пациентов только уровень ферритина служит признаком истощения запасов депо железа. В этот период сывороточное железо остается в пределах референсных значений, и если врач не провел исследования уровня ферритина, а определил только уровень сывороточного железа, диагноз предлатентного дефицита железа не будет установлен и в результате не буду предприняты необходимые шаги, направленные на поиск причины данных изменений и их коррекции. Осложняет данную ситуацию и отсутствие клинических проявлений. Единственный способ установить предлатентный дефицит железа – это назначить пациенту исследование уровня ферритина сыворотки крови.
2. Дефицит железа – латентный. В ситуации когда врач пропустил предлатентный дефицит железа, происходит снижение уровня железа в сыворотке крови или ЛДЖ. В данной стадии в результате дисбаланса между поступлением и расходом железа в организме в тканях отмечается снижение активности тканевых ферментов, содержащих железо (цитохромов, каталазы, сукцинатдегидрогеназы и др.), что приводит к развитию сидеропенического синдрома с соответствующей клинической картиной.
3. Дефицит железа – манифестный или истинная ЖДА развивается при снижении уровня железа и гемоглобина в сыворотке крови, как следствие – проявляется классическими клиническими симптомами анемического и сидеропенического синдромов [19, 20, 23, 24].
Диагноз ЖДА основан на комплексе, состоящем из ряда клинических проявлений, описанных выше, и специфических гематологических признаках, среди которых главенствующую роль отводят снижению уровня гемоглобина.
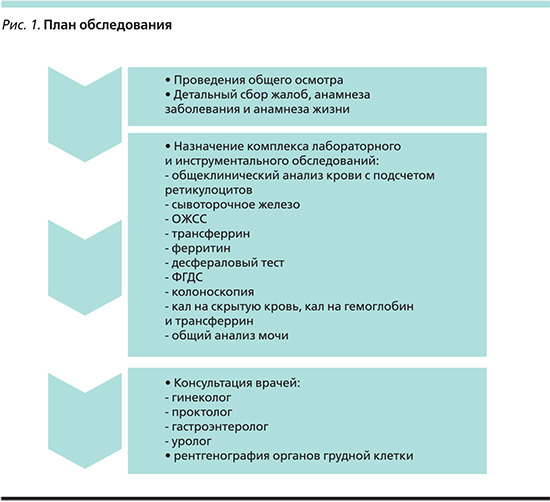
Если врач выявил у пациента ЖДС, первое, что необходимо сделать, – это назначить комплексное дообследование с целью установления причины (рис. 1), повлекшей за собой этот дефицит; второе – назначить лечение выявленной причины, чтобы избежать дальнейшего снижения уровня железа, и назначить медикаментозную терапию, направленную на восстановление уровня железа сыворотки крови и восполнение депо.
При выявлении причины, приводящей к потере железа, врач назначает медикаментозную терапию, направленную на купирование патологического процесса, и препараты, содержащие железо, для восполнение развившегося железодефицита.
Важно соблюдать все принципы, направленные на восполнение уровня железа в организме, т.к. отступление от них не приведет к успеху в лечении.
Основные принципы лечения:
- Объяснить пациенту, что восстановление уровня железа в организме без применения лекарственных препаратов, содержащих железо, невозможно. Этот миф врач должен развенчать при общении с пациентом.
- Восполнение железодефицита врачу необходимо начинать с назначения пероральных препаратов, содержащих железо.
- Важно объяснить пациенту, что после нормализации уровня гемоглобина крови нельзя прекращать лечение, т.к. депо в этот период еще пустое и требует восполнения.
- Прибегать в стационарных условиях к проведению гемотрансфузии при тяжелой степени ЖДА необходимо только по жизненным показаниям.
Важно объяснить пациенту, что даже предлатентный и латентный дефицит железа требует медикаментозной коррекции. Для этой цели разработан и успешно применяется препарат Фероглобин-В12 (Витабиотикс, Великобритания).
Фероглобин-В12 – это уникальный комбинированный препарат, действие которого обусловлено свойствами входящих в его состав компонентов. Железо является обязательным компонентом гемоглобина, осуществляющим транспорт кислорода к тканям. Витамины В1, В2, В6, В12, фолиевая (Вс) и пантотеновая кислоты, цинк необходимы для формирования эритроцитов и синтеза аминокислот, способствуют нормализации эритропоэза. Витамин С и медь повышают эффективность всасывания железа. Марганец регулирует обмен углеводов. Восполнение дефицита железа, минеральных веществ, витаминов группы В приводит к нормализации биосинтеза гемоглобина и активации всего комплекса окислительно-восстановительных процессов, устраняя сопутствующие анемии симптомы – общую слабость, вялость, повышая физическую и умственную активность.
 Важной особенностью комплекса является наличие в составе ко-ферментов, способствующих железу лучше усваиваться в организме. Это позволяет получать клинически значимые результаты при лечении низкими дозами железосодержащего препарата, что повышает безопасность терапии.
Важной особенностью комплекса является наличие в составе ко-ферментов, способствующих железу лучше усваиваться в организме. Это позволяет получать клинически значимые результаты при лечении низкими дозами железосодержащего препарата, что повышает безопасность терапии.
Еще одной особенностью является тот факт, что железо, входящее в состав комплекса, содержится в виде железа аммония цитрата. Это трехвалентное соединение железа, которому и необходимо отдавать предпочтение при выборе железосодержащего препарата.
В состав Фероглобин-В12 входит 150 мкг фолиевой кислоты, которая также играет важную физиологическую роль в процессах кроветворения. Фолиевая кислота необходима в первую очередь для нормального образования клеток крови, включая процессы созревания мегалобластов и образования нормобластов. Именно недостаток фолиевой кислоты в большинстве случаев служит причиной, тормозящей переход процессов кроветворения из мегалобластической фазы в нормобластическую. Вместе с витамином В12 фолиевая кислота стимулирует эритропоэз, участвует в синтезе аминокислот, нуклеиновых кислот, пуринов и пиримидинов, в обмене холина. Первым признаком дефицита фолиевой кислоты (витамина Вс) является нарушение эритропоэза (мегалобластическая анемия), т.к. фолиевая кислота участвует в кроветворении, синтезе ДНК, формировании и созревании эритроцитов.
Одним из наиболее сильных стимуляторов всасывания железа является витамин С. Транспорт через клетки слизистой оболочки тонкой кишки осуществляется при участии специального белка-носителя, связывающего ионы Fe2+. Абсорбция ионов Fe2+ происходит быстрее, чем абсорбция ионов Fe3+. Для «превращения» трехвалентного железа в двухвалентное необходим восстановитель, роль которого в большинстве случаев играет аскорбиновая кислота. Именно поэтому сочетание в витамино-минеральных комплексах и препаратах, предназначенных для профилактики и лечения железодефицитных состояний Fe3+с аскорбиновой кислотой, весьма рациональное.
Важными дополнительными элементами комплекса являются витамины группы В. В1 – один из наиболее важных витаминов в энергетическом обмене организма. Витамин В2 наряду с участием в процессах энергообеспечения участвует в образовании эритроцитов. Витамин В6 необходим для эффективного синтеза белков и образования гемоглобина. Витамин В12 является гематическим нутриентом, необходимым для синтеза гемоглобина и формирования эритроцитов.
Метаболизм пантотеновой кислоты тесно связан с обменом витаминов С, В12 и фолиевой кислоты.
В комплексном витаминно-минеральном препарате Фероглобин-В12 присутствует лизин – незаменимая аминокислота, входящая в состав молекулы гемоглобина.
Известен факт того, что медь способствует усилению абсорбции железа.
Рядом исследователей доказано, что цинк и железо обладают аддитивным эффектом в профилактике и лечении анемий.
Все вышеприведенные факторы объясняют высокую эффективность и хорошую переносимость при использовании низкодозового железосодержащего комплекса Фероглобин-В12.
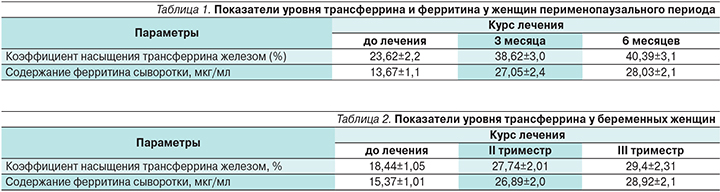
Эффективность сиропа Фероглобин- В12 проверена на разных возрастных группах: от детей 2–3 лет до женщин в перименопаузальном периоде. Во всех клинических исследованиях была доказана высокая терапевтическая эффективность препарата. Проведенные клинические исследования подтвердили эффективность и безопасность его применения, в т.ч. для детей и беременных женщинам [25, 26]. Так, среди детей младшей возрастной группы от 2 до 5 лет применение сиропа Фероглобин-В12 привело к увеличению уровня гемоглобина, который за 4 месяца увеличился с 9,4±0,26 до 12,6±0,13 (р<0,05), что наглядно представлено на рис. 2.
В группе сравнения, сопоставимой по возрасту и полу, получены сле-дующие данные: до лечения уровень гемоглобина составлял 10,6±0,02 и 10,9±0,02 после лечения соответственно.
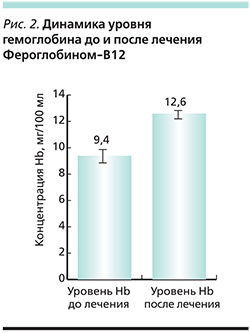
Подтверждение эффективности применения сиропа Фероглобин-В12 было выявлено и у женщин перименопаузального периода, а также в группе беременных женщин, что наглядно представлено в табл. 1 и 2.
Таким образом, можно сделать следующий вывод: препарт Фероглобин-В12 обладает достоверной терапевтической эффективностью и высоким профилем безопасности в лечении пациентов с ЖДС. Препарат характеризуется хорошей переносимостью, выпускается в двух лекарственных формах – в капсулах с замедленным высвобождением железа для взрослых и в форме сиропа для детей с 2 лет, что делает возможным лечение пациентов разных возрастных групп, обеспечивая высокую приверженность лечению.



