Введение
Хроническая болезнь почек (ХБП) становится ведущей патологией в структуре социально значимых заболеваний XXI в. [1, 2]. Как в развитых [3, 4], так и развивающихся [5] странах мира регистрируется увеличение числа новых случаев ХБП [6]. В ряде случаев признаки ХБП и почечной недостаточности (ПН) выявляются у двоих, иногда и у троих членов одной семьи. ХБП представляет собой сложный патофизиологический каскад, при котором наблюдаются нарушения гомеостаза и создаются условия для ускоренного развития сердечно-сосудистых, цереброваскулярных, тромбоэмболических осложнений, а также злокачественных новообразований [7, 8–10]. Между степенью снижения фильтрационной функции почек и ростом частоты неблагоприятных осложнений существует двунаправленная взаимосвязь. В последние годы внимание исследователей и клиницистов приковывает проблема минерально-костных нарушений (МКН) при ХБП. В клинической нефрологии изучение МКН при ХБП, предложенное KDIGO (Kidney Disease Improving Global Outcomes), используется с 2006 г. [11]. В настоящее время под МКН при ХБП подразумеваются системные нарушения минерального и костного обменов, проявляющиеся изменениями концентраций сывороточного паратиреоидного гормона (ПТГ), фосфора, кальция, или витамина D, нарушениями обновления и минерализации костной ткани [12]. В последующем МКН при ХБП приводят к развитию кальциноза сосудистой стенки и/или других мягких тканей [13, 14]. Хочется отметить, что много научных работ посвящено изучению распространенности МКН среди популяции пациентов с ХБП на С5–Д-стадиях заболевания [15]. В то же время данные, описывающие характер МКН при ХБП на додиализной стадии, малочисленны. Разнонаправленные изменения баланса минерального состава крови у лиц с ХБП также вносят вклад в развитие экстраренальных осложнений. Исследования минерального состава крови на начальных этапах формирования ХБП могут отсрочить диализ-зависимую стадию заболевания.
Цель исследования: изучить показатели минеральных и костных нарушений, а также центрального аортального давления (ЦАД) на дои преддиализных стадиях ХБП.
Материал и методы
Обследованы 108 пациентов на дои преддиализной стадиях ХБП в возрасте от 22 до 83 лет, из них 66 (61,1%) мужчин, 42 (38,9%) женщины. Средний возраст пациентов составил 53,6±14,9 года. Наличие синдрома ХБП устанавливалось в соответствии с критериями и стандартами НОНР (Научное общество нефрологов России). Настоящее исследование одобрено Комитетом по этике Общества специалистов по хронической болезни почек Кыргызстана (протокол № 3 от 12.05.2021). В общеклинической части исследования регистрировали показатели роста (см), массы тела (кг), индекса массы тела (ИМТ, кг/м2), частоты сердечных сокращений (ЧСС, уд/мин), уровни систолического (САД, мм рт.ст.) и диастолического (ДАД, мм рт.ст.) артериального давления. У всех обследованных лиц также собирали анамнез (прием фосфат-связывающих препаратов и кетоаналогов). Исследовали параметры периферической крови: концентрацию гемоглобина (Hb, г/л), число эритроцитов (×1012/л) и тромбоцитов (×109/л). При биохимическом анализе крови определяли параметры липидного спектра: общего холестерина (ОХ, ммоль/л), липопротеидов высокой плотности (ЛПВП, ммоль/л), липопротеидов низкой плотности (ЛПНП, ммоль/л), триглицеридов (ТГ, ммоль/л), минерального состава крови: уровни калия (К, ммоль/л), натрия (Na, ммоль/л), кальция (Ca, ммоль/л), магния (Mg, ммоль/л), фосфора (Р, ммоль/л), витамина D (25-гидроксикальциферола, нг/мл), ПТГ (пг/мл), щелочной фосфатазы (ЩФ, ЕД/л), мочевой кислоты (МК, ммоль/л), маркеров воспаления (С-реактивного белка (СРБ, мг/л), фибриногена (г/л) и показателей функции почек: сывороточного креатинина (Cr, мкмоль/л), сывороточного цистатина С (ЦС, мг/л). Расчетную скорость клубочковой фильтрации (рСКФ) определяли по методике CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration Formula) на основе сывороточного креатинина [16]. Измерение уровня ЦАД проводилось на приборе «Ангио-Скан» (Россия). При проведении исследования строго соблюдались принципы Хельсинкской декларации Всемирной медицинской ассоциации. По характеру и дизайну наше исследование было описательным и одномоментным. Клинико-нозологические диагнозы зафиксированы из представленных медицинских карт пациентов. Поскольку нарушение баланса минерального состава крови в основном выявляется при ПН, нами были сформированы две сопоставимые по возрасту группы: 1-я группа – лица с ХБП с СКФ>60 мл/мин/1,73 м2 (n=33), 2-я – пациенты с ХБП c СКФ≤60 мл/мин/1,73 м2 (n=75).
Полученные данные подвергались статистической обработке при помощи программного обеспечения Statistica 10.0. Для оценки нормальности распределения использовали критерий Колмогорова–Смирнова, в случае распределения, отличного от нормального, для анализа с применением параметрических критериев проводилась трансформация показателей с использованием натурального логарифмирования. Полученные данные в таблицах и тексте представлены как абсолютные и относительные величины (n, %), а также как (М±σ), где М – среднее арифметическое значение; σ – стандартное отклонение. Для анализа выборочных данных из совокупностей, отличающихся от нормального распределения, использовали непараметрические методы. При установлении непараметрического распределения показателей данные представлены как медиана, 25–75-й процентили. Для изучения взаимосвязи количественных и качественных признаков применяли метод Пирсона или Спирмена. При p<0,05 данные считались статистически значимыми.
Результаты
На рис. 1 представлена сравнительная нозологическая характеристика обследованных пациентов с синдромом ХБП. Из нее видно, что в общей выборке (n=108) ХБП в большей степени ассоциировалась с артериальной гипертензией – АГ (68%), сахарным диабетом 2 типа (СД2) (41%), ожирением (35%) и ишемической болезнью сердца – ИБС (19%). В 1-й группе, т.е. у лиц с ХБП в отсутствие ПН (n=33), превалировали пациенты с АГ (29%) и СД2 (25%). Тогда как во 2-й группе (пациенты с ХБП и наличием ПН, n=75) доминировали АГ (39%), СД2 (16%), ожирение (15%), ИБС (13%). Как в 1-й, так и во 2-й группе доля лиц с цереброваскулярными болезнями (4 и 5%), хронической обструктивной болезнью легких (6 и 7%), гломерулонефритами и пиелонефритами (5 и 3%) были малочисленными. При сравнительном анализе установлено, что в группе пациентов с ХБП и наличием ПН процентное соотношение АГ, СД2 и ИБС различалось (рис. 1). В частности, АГ и ИБС достоверно чаще выявлялись во 2-й группе (р<0,05).
В таблице представлена сравнительная характеристика обследованных пациентов с ХБП. Пациенты обеих групп достоверно не различались по возрасту, полу, ИМТ и ЧСС (p>0,05). Как и следовало ожидать, уровни систолического (146±28 и 140±24 мм рт.ст.; p<0,05), диастолического (88±11 и 83±10 мм рт.ст.; p<0,05) АД, а также ЦАД (149±29 и 143±26 мм рт.ст.; p<0,05) были значимо выше у пациентов с ХБП и наличием ПН. При рассмотрении параметров периферической крови наблюдались существенные различия в концентрациях Hb (121±31 и 136±18 г/л; p<0,05) и числе эритроцитов (4,06±0,88х109/л и 4,82±0,75×101/л; p<0,05), которые были значимо ниже в группе лиц с ХБП и ПН. Примечательно, что различий в группах по содержанию тромбоцитов в периферической крови, ОХ, ЛПНП, ТГ и СРБ обнаружено не было. Значимые снижения концентрации ЛПВП (0,96±0,30 и 1,13±0,33 ммоль/л; p<0,05) и повышение уровня МК (0,439±0,07 и 0,398±0,09 ммоль/л; p<0,05) были свойственны пациентам с ХБП, осложненной ПН. В этой группе также отмечалось статистически значимое повышение уровня фибриногена крови 5,20 (3,90;5,59) и 3,15 (2,40;4,60) г/л (p<0,05).
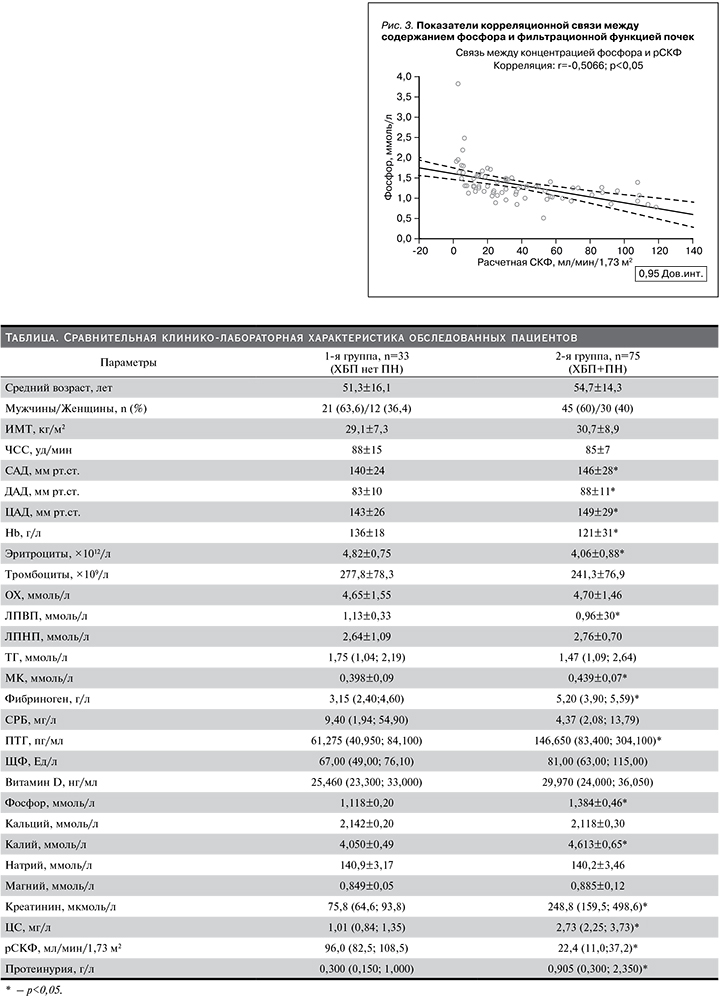
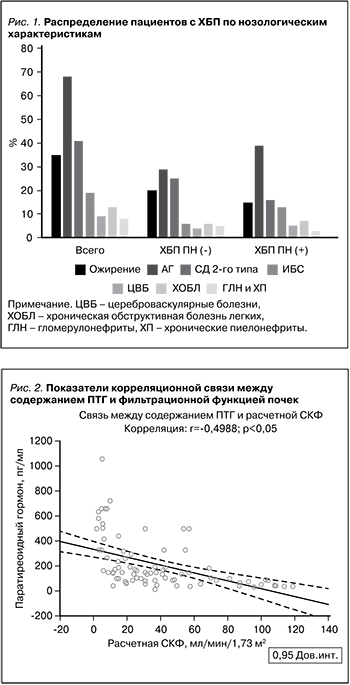
При рассмотрении параметров МКН отмечено, что у лиц с ХБП и наличием ПН концентрации ПТГ 146,650 (83,400; 304,100) и 61,275 (40,950; 84,100) пг/мл (p<0,05) и фосфора 1,384±0,46 и 1,118±0,20 ммоль/л (p<0,05) были существенно выше по сравнению с таковыми у пациентов с ХБП, не имевших признаков ПН. Полученная разница в показателях ЩФ крови 81,00 (63,00; 115,00) и 67,00 (49,00; 76,10) ЕД/л (p=0,052) между исследуемыми группами не носила статистически значимого характера. Вместе с тем концентрация витамина D, кальция, магния и натрия сыворотки в представленных когортах также значимо не различалась. Полученную разницу в содержании калия сыворотки крови в двух группах стоило ожидать (см. таблицу). Согласно критериям деления пациентов, исследуемые группы имели значимые различия (p<0,05) по уровню сывороточного Cr, ЦС, а также по величине рСКФ. Для выявления значимых связей между исследуемыми параметрами нами проведен корреляционный анализ. Как представлено на рис. 2, статистически значимая зависимость повышения содержания ПТГ со снижением фильтрационной функции почек (r=-0,4988; p<0,05), с одной стороны, и увеличением концентрации фосфора сыворотки крови (r=-0,5066; p<0,05), с другой (рис. 3).
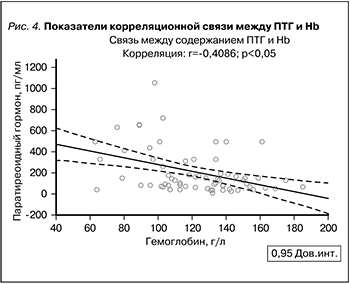
Следует отметить (рис. 4), что между концентрацией Hb и ПТГ регистрировалась значимая обратная взаимосвязь (r=-0,4086; p<0,05). Прямая корреляционная взаимосвязь обнаружена между уровнем ПТГ с концентрацией фибриногена (r= 0,6849; p<0,05), СРБ крови (r=0,5905; p<0,05), а также уровнем ЦАД (r=0,5640; p<0,05).
Обсуждение
В физиологических условиях почки выполняют в организме ряд важнейших функций, в т.ч. и регуляцию постоянства внутренней среды. В частности, почки участвуют в поддержании водного, электролитного, кислотного и щелочного балансов организма [17]. Продуцируя различные биологически активные вещества и ферменты, почки регулируют тонус сосудистой стенки, гемопоэз, гемостаз и многие другие факторы гомеостаза организма. Таким образом, многообразие функций, выполняемых почками, обеспечивается благодаря ультрафильтрации плазмы в клубочках, реабсорбции и секреции веществ в канальцах, деятельностью противоточно-множительной системы, синтезом новых веществ в паренхиме и уникальной гемодинамикой, являющейся основой функционирования почек [18]. Своевременная и правильная оценка этих показателей, а также понимание закономерностей развития нарушения деятельности почек – одни из ключевых моментов в своевременной диагностике и управлении почечными факторами риска. В проведенном нами исследовании (рис. 1) синдром ХБП в представленной выборке (n=108) часто ассоциировался с АГ (68%), СД2 (41%), ожирением (35%) и ИБС (19%). Эти данные вполне согласуются с результатами других исследований, где подчеркнута ведущая роль АГ, СД2, ожирения и ИБС в формировании и прогрессировании ХБП [19]. В публикации Ж.Д. Кобалава и соавт. (2018) отмечено, что в Российской Федерации пациенты с АГ независимо от наличия СД2 характеризуются высокой частотой маркеров ХБП [20]. Исследователи утверждают, что среди лиц с СД2 чаще выявляется снижение рСКФ<60 мл/ мин/1,73 м2. Столь высокая распространенность синдрома ХБП среди лиц с АГ и СД2 объясняется более высокой частотой сопутствующих состояний, таких как гипери дислипидемия, мультифокальный атеросклероз, фибрилляция предсердий, инсульт, сердечная недостаточность, анемия и гиперурикемия. Согласно литературным данным [20], у лиц с СД2, находящихся на инсулинотерапии, наблюдается высокий риск прогрессирования не только ХБП, но и кардиоваскулярных событий. В известном регистре NHANES (The National Health and Nutrition Examination Survey) распространенность синдрома ХБП среди пациентов с СД2 старше 65 лет составила 58,7% и 25,7% – у лиц, младше 65 лет [21]. Высокая распространенность ХБП при ИБС сообщается и другими исследователями [22]. Во многих клинических ситуациях лабораторные признаки ХБП обнаруживаются уже на стадии ПН. Именно начиная С3-периода ХБП регистрируются собственные «почечные факторы» риска кардиоваскулярных событий: анемия, гиперурикемия, гиперфосфатемия, гиперпаратиреоз и т.д. Следует отметить: при стойком снижении фильтрационной функции почек ниже 60 мл/мин/1,73 м2 отмечается прирост АД либо существующая АГ становится резистентной к терапии. Сопутствующие атеросклеротические и сердечно-сосудистые заболевания приобретают манифестную форму. Так, в серии публикаций исследователей НОНР продемонстрировано [9, 13, 14, 23–25], что при уменьшении числа функционирующих нефронов наблюдается снижение активной формы витамина D и кальция, повышается концентрация фосфора и ПТГ в сыворотке крови. Как указано в нашей работе (см. таблицу), сывороточные уровни витамина D и кальция у пациентов с наличием и без ПН существенно не различались. По-видимому, это объясняется небольшим объемом выборки в обеих группах. Значимо высокие уровни фосфора и ПТГ отмечены в группе лиц с ХБП, осложненной ПН. Примечательно (рис. 2, 3), что между снижением фильтрационной функции почек и повышением уровней фосфора, а также ПТГ отмечалась статистически значимо тесная взаимосвязь. Прогрессирование синдрома ХБП сопровождается повышением сывороточного уровня фосфора, которая в свою очередь стимулирует продукцию ПТГ и одновременно развивается снижение уровня кальция в сыворотке крови [15]. Усиленная продукция ПТГ при ХБП сопровождается морфофункциональными изменениями околощитовидных желез (пролиферация, диффузная и поликлональная гиперплазия клеток) [26]. По мнению исследователей [15, 26], при ХБП и наличии ПН на некоторое время околощитовидные железы принимают активное участие в поддержании гомеостаза минерального и костного метаболизма. Нужно подчеркнуть [27], что прогрессирование ХБП приводит к уменьшению ренальной экспрессии трансмембранной формы белка Клото, что способствует формированию резистентности к действию фактора роста фибробластов 23-го типа и возникновению стойкой гиперфосфатемии. Как сказано в публикациях Г.В. Волгиной [13, 23, 24] и О.Н. Ветчинниковой [14], увеличение продукции фактора роста фибробластов 23-го типа начинается на ранних этапах ХБП в ответ на повышение уровня сывороточного фосфора. Эволюционно чрезмерная (на начальной стадии ХБП) продукция фактора роста фибробластов 23-го типа препятствует возникновению и усугублению гиперфосфатемии. Однако развивающийся дефицит кальцитриола (активная форма витамина D), вызванный избыточной продукцией фактора роста фибробластов 23-го типа, способствует развитию гиперпаратиреоза за счет угнетения геномных механизмов контроля синтеза ПТГ [15]. В условиях стойкого повышения продукции ПТГ регистрируется дальнейшее снижение фильтрационной функции почек и развитие неблагоприятных осложнений [26]. В нашей работе у пациентов с ХБП, осложненной ПН, значимое повышение концентрации ПТГ ассоциировалось с повышением уровня АД, МК, а также снижением концентрации Hb, числа эритроцитов и уровня ЛПВП. Следует отметить, что наибольшее число рецепторов к ПТГ находится в почках и костной ткани [27]. Механизм повышения уровня АД в условиях стойкой гиперпродукции ПТГ можно рассматривать как фактор регуляции морфофункционального статуса почки, который может участвовать в регуляции ренального кровотока и СКФ, ограничивая биологическую активность сократительных стимулов в стенке артериальных сосудов почек [15, 27]. Известно, что у лиц с ХБП внутрипочечная продукция ангиотензина-II многократно повышается, что сопровождается генерализованной вазоконстрикцией и ускорением эндотелиальной дисфункции.
В ранее опубликованных работах сообщалось [28], что при гиперпаратиреозе наблюдается повышение содержания МК сыворотки крови вследствие снижения чувствительности канальцев почек к антидиуретическому гормону, уменьшения фильтрационной функции почек, которая вследствие недостаточной перфузии капиллярной сети вызывает снижение канальцевой секреции уратов и нарушение выведения МК. Нам удалось продемонстрировать статистически значимые взаимосвязи повышенного уровня ПТГ с концентрацией Hb (r=-0,4086; p<0,05), с одной стороны, и ростом ЦАД (r=0,5640; p<0,05), с другой. Механизм прогрессирования как ХБП, так и кардиоваскулярных событий при анемии хорошо изучены и объясняются повышением продукции ангиотензина-II, развитием тахикардии, а также объемной перегрузкой миокарда желудочков [29]. Ю.С. Милованов и соавт. (2017) продемонстрировали, что у пациентов с ХБП, осложненной анемией, выявлены более высокие уровни систолического АД и более выраженная степень структурной перестройки миокарда с формированием гипертрофии левого желудочка эксцентрического типа и значительно более высоким уровнем сывороточного Cr, а также низкой СКФ по сравнению с аналогичными показателями лиц ХБП без анемии [30]. По данным научных исследований [2], анемия при ХБП, особенно на стадии ПН, способствует развитию гиперкинетического типа кровообращения, что характеризуется увеличением венозного возврата к сердцу, сердечного выброса и повышением АД. Вклад повышения давления в аорте лиц с ХБП детально изложены в ряде клинико-эпидемиологических исследований, где показано [31, 32], что прирост ЦАД ускоряет атерои артериосклеротические изменения ренальных артерий, при этом повышается давление в полостях сердца, развивается диастолическая и систолическая дисфункция левого желудочка. Как отмечено, в проведенном нами исследовании установлена прямая связь между повышением уровня ПТГ с увеличением концентрации фибриногена (r=0,6849; p<0,05) и СРБ (r=0,5905; p<0,05) крови. На наш взгляд, стойкое повышение продукции ПТГ запускает также атеротромботические осложнения, особенно у популяции пациентов на С5–Д-стадии ХБП. Накопленные научные сведения демонстрируют, что при ХБП, осложненной ПН, наблюдается повышение продукции сывороточных маркеров воспаления [33, 34]. Повышение концентрации СРБ и фибриногена крови при ХБП запускает процессы эндотелиальной дисфункции, а также ускоряет механизмы системного атеросклероза [35]. Повышение концентрации фибриногена крови при снижении фибринолитической активности сосудистой стенки отмечено также в работе А.П. Реброва и Н.Ю. Зелепукина [36]. По отчетам зарубежных исследователей [37], при ХБП риск развития венозной тромбоэмболии повышается с увеличением концентрации СРБ, фибриногена и других плазменных белков крови. В научной литературе имеются сведения о том, что повышение уровня фибриногена крови у лиц с ХБП и наличием ПН может быть одним из проявлений развития хронического ДВС-синдрома, который потенциально является патогенетическим звеном возникновения носовых кровотечений [38]. При ПН в условиях стойкой активации воспалительного синдрома ускоряются также и склеротические изменения в сосудистой стенке, миокарде и почек. На С5–Д-стадии ХБП уровень СРБ положительно коррелирует с массой миокарда левого желудочка [39]. По другим сообщениям, повышение уровня фибриногена в крови на 1 г/л может приводить к 1,8-кратному увеличению риска развития ИБС [40]. Среди лиц с ПН при уровне фибриногена крови более 3 г/л риск развития очаговых изменений миокарда возрастает в 2 раза [40].
Заключение
Таким образом, у лиц с ХБП при наличии ПН минеральные и костные нарушения представлены повышением содержания фосфора, калия и ПТГ. У пациентов этой категории зарегистрировано значимое повышение ЦАД, САД и ДАД, уровней фибриногена, МК крови, а также существенное снижение концентрации Hb, числа эритроцитов и уровня ЛПВП. Установлена тесная зависимость между повышением содержания ПТГ и ростом уровня ЦАД, фибриногена и СРБ крови, а также снижением концентрации Hb и рСКФ. В связи с этим мониторирование уровней фосфора, ПТГ и ЦАД необходимо начинать как можно раньше с целью усиления вторичной профилактики атеросклеротических и сердечно-сосудистых осложнений при ХБП.



