Эпидемиология меланомы кожи в Российской Федерации
На протяжении последних десятилетий в мире отмечается неуклонный рост заболеваемости меланомой кожи (МК), превысившей 200 тыс. вновь выявленных больных в год. Наряду с ростом заболеваемости отмечается и рост показателей смертности [1]. На территории Российской Федерации ежегодно регистрируется в среднем 8000 новых случаев МК, при этом средний показатель заболеваемости в 2013 г. составил 6,25 на 100 тыс. населения (5,1 для мужчин и 7,25 для женщин), среднегодовой темп прироста – 2,59%, а прирост за 10-летний период – 30,23%. Стандартизированный показатель заболеваемости в 2013 г. находился в пределах 3,77 у мужчин и 4,28 у женщин на 100 тыс. населения [2–3].
На фоне роста заболеваемости МК отмечается увеличение показателей смертности. Стандартизированный показатель смертности от меланомы в Российской Федерации в 2013 г. составил 1,48 на 100 тыс. населения. За 10-летний период (2003–2013) у мужчин на фоне значительного снижения стандартизованного показателя смертности (-11,3%) от всех злокачественных новообразований отмечено нарастание показателя смертности от МК (14,7%). Среди женского населения наблюдается та же тенденция: снижение общего стандартизованного показателя смертности (-6,9%) и рост показателя смертности от МК (8,0%).
Средний возраст больных меланомой с впервые в жизни установленным диагнозом составил 60,8 года. Наибольшая заболеваемость отмечена в возрасте 75–84 лет. Следует отметить рост заболеваемости и среди лиц молодого возраста. Среди всех онкологических заболеваний у пациентов в возрасте 20–25 лет удельный вес МК занимает 4-е место [3]. Особую социальную значимость МК придает высокая смертность: на долю заболевания приходится всего 4% злокачественных новообразований кожи, но до 80% смертельных исходов. Такой уровень смертности обусловлен высоким метастатическим потенциалом опухоли и низкой эффективностью системной терапии диссеминированных форм заболевания. Если при ранней стадии заболевания 5-летняя выживаемость превышает 90%, то при II составляет около 65%, при III (локально-регионарной) снижается до 45%, а при IV (метастатической) стадии не превышает 10%. К сожалению, в России около 25% пациентов на момент установления диагноза имеют запущенные (III–IV) стадии заболевания [4].
Таргетная терапия метастатической меланомы
При неуклонном росте заболеваемости и отсутствии эффективных методов терапии большие надежды возлагаются на реализацию достижений молекулярно-генетических исследований. За последние годы удалось расшифровать сложный генетический профиль меланомы и показать, насколько гетерогенна опухоль. Открыты новые пути сигнальной трансдукции, определены и изучаются молекулярные мишени таргетной терапии [5, 6].
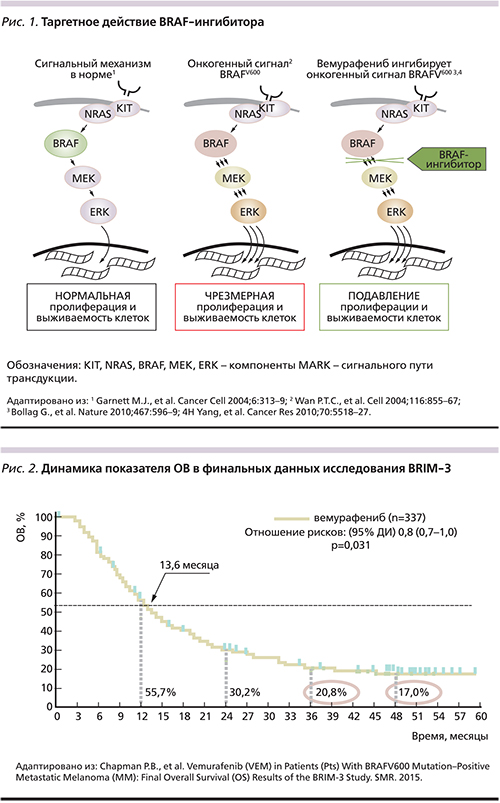
Появление молекулярно-направленных таргетных препаратов, а также ингибиторов иммунных «точек контроля» изменило тактику лечения больных метастатической меланомой (мМК) [7, 8]. МАРК (mitogen_activated protein kinase) – сигнальный путь трансдукции, включающий RAS (HRAS, NRAS, KRAS), RAF серин/треониновые протеинкиназы (ARAF, BRAF, CRAF), MEK, ERK; регулирует клеточный рост, дифференцировку, апоптоз и играет ключевую роль в прогрессировании меланомы (рис. 1) [7, 9–15]. Активирующие BRAF-мутации (чаще всего BRAF V600E) определяются примерно у 50% больных МК и приводят к активации MAPK сигнального каскада [16]. У больных неоперабельной или метастатической меланомой с наличием мутации в гене BRAF V600, BRAF-ингибиторы вемурафениб и дабрафениб продемонстрировали высокую эффективность [8].
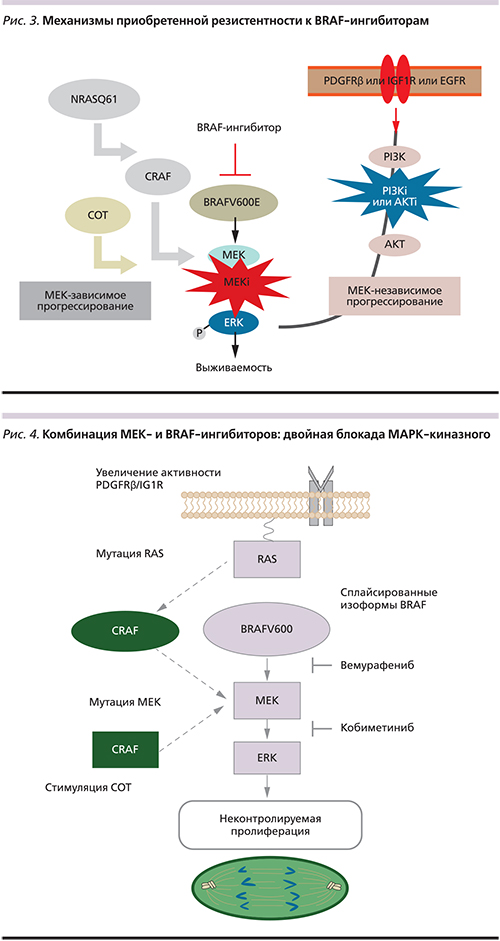
Рандомизированное исследование BRIM-3, на основании которого вемурафениб был одобрен Управлением по контролю за качеством пищевых продуктов и лекарственных препаратов США (Food and Drug Administration, FDA), продемонстрировало явные преимущества препарата перед стандартной химиотерапией: было отмечено увеличение общей выживаемости (ОВ) (13,6 против 9,7 месяца, p<0,001), выживаемости без прогрессирования (ВБП) (6,9 против 1,6 месяца, p<0,001). Частота объективных ответов на терапию вемурафенибом была в 9 раз выше, чем у дакарбазина (57 и 9% соответственно) [17]. Согласно финальным данным исследования BRIM-3, 17% пациентов мМК живы в течение 4 лет и более на фоне терапии вемурафенибом (рис. 2) [18].
Механизмы резистентности к BRAF-ингибиторам
Примерно у 15% пациентов отмечается первичная резистентность к BRAF-ингибиторам [16]. Определены возможные множественные механизмы первичной резистентности к BRAF-ингибиторам, включившие наличие RACI P29S-мутации, потерю функции PTEN, дисрегуляцию циклин-зависимой киназы-4 и циклин D1, инактивацию NF1, активацию киназы COT1, секрецию стромального фактора роста гепатоцитов и мутации в HOXD8 [16]. Интересно, что подобная геномная гетерогенность опухоли не оказывает отрицательного воздействия на результат лечения в случае комбинированной терапии BRAF- и МЕК-ингибиторами. Например, в исследовании co-BRIM потеря функции PTEN и высокий уровень Ki67 стали отрицательным фактором в отношении ОВ в группе пациентов, получавших монотерапию вемурафенибом, но не оказывали влияния на ОВ пациентов при комбинированной терапии вемурафениб+кобиметиниб [19]. Ретроспективный анализ образцов опухоли до начала лечения в четырех исследованиях, включая BRIM-7 и co-BRIM, демонстрирует, что экспрессия изучаемых генов коррелирует с низкими показателями ВБП у пациентов, получавших только вемурафениб. При комбинированной терапии такого эффекта не наблюдается [20].
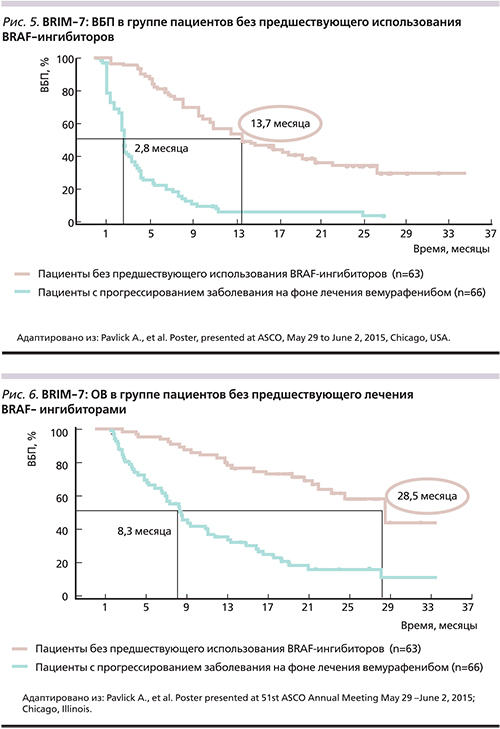
У большинства пациентов, получавших лечение BRAF-ингибиторами, развивается вторичная резистентность, что неизменно ведет к прогрессированию заболевания [16]. Самым частым механизмом приобретенной резистентности к вемурафенибу является реактивация MAPK сигнального пути (52%): активирующие мутации в генах NRAS и MEK, амплификация или альтернативный сплайсинг BRAF V600E [16, 21]. Другой причиной вторичной резистентности может быть усиление передачи сигнала посредством пути PI3K/AKT/mTOR (4%), в 18% случаев задействовано оба пути и в 26% механизмы остаются неизвестными (рис. 3) [16]. С учетом вышеизложенного становится очевидной необходимость поиска путей преодоления резистентности к BRAF-ингибиторам при мМК. Одной из реальных возможностей является комбинированное применение МЕК- и BRAF-ингибиторов (рис. 4).
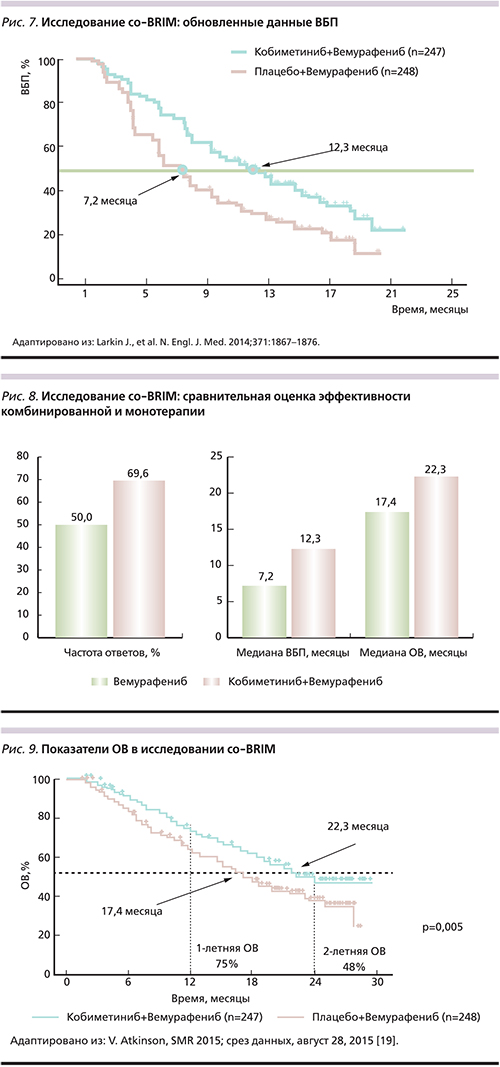
В настоящее время для лечения пациентов с неоперабельной или мМК при наличии мутации BRAF V600E или V600K одобрены к применению следующие МЕК-ингибиторы: траметиниб (Мекинист) в комбинации с дабрафенибом, кобиметиниб (Котеллик) в сочетании с вемурафенибом.
Фармакодинамические и фармакокинетические исследования доказали целесообразность их комбинированного использования, а также возможность применения комбинации препаратов при легкой и средней степеней тяжести почечной и печеночной недостаточности [22–24]. Фармакокинетический анализ показал, что возраст, вес, раса и пол не имеют клинически значимого влияния на фармакокинетику кобиметиниба и вемурафениба [25, 26]. Совместное применение МЕК- и BRAF-ингибиторов приводит к двойной блокаде МАРК-киназного пути: усиливает ингибирование опухолевого роста, препятствует или замедляет развитие приобретенной резистентности, блокирует парадоксальную активацию пути MAPK [27, 28]. Ключевыми международными исследованиями по оценке эффективности и безопасности комбинации кобиметиниб+вемурафениб для пациентов с мМК и мутацией BRAF V600 стали BRIM-7 и со-BRIM.
Исследование BRIM-7
BRIM-7 – нерандомизированное открытое мультицентровое исследование Ib-фазы, основной целью которого была оценка безопасности комбинации кобиметиниб+вемурафениб и определение дозолимитирующей токсичности и максимально переносимой дозы. В исследование были включены пациенты с IIIC- или IV-стадией BRAF V600-позитивной МК: одна группа больных ранее не получала лечения BRAF-ингибиторами (n=63), другую группу пациентов составили больные с прогрессированием заболевания на фоне лечения вемурафенибом (n=66) [27]. В процессе эскалации дозы пациенты получали вемурафениб по 720 или 960 мг дважды в день в комбинации с различными режимами кобиметиниба. Дозолимитирующей токсичностью 3-й степени были слабость, стоматит, артралгия, миалгия, удлинение QT (QTc) интервала. Установлены максимально переносимые дозы: кобиметиниб – 60 мг 1 раз в день в течение 21 дня в комбинации с вемурафенибом по 960 мг дважды в день каждые 28 дней. Этот режим был выбран для использования в последующих исследованиях [27].
В группе ранее нелеченных пациентов при медиане наблюдения 13 месяцев объективный ответ на комбинированную терапию кобиметинибом и вемурафенибом составил 87%, медиана ВБП – 13,7 месяца (рис. 5), медиана ОВ не была достигнута и 1-годичная ОВ равнялась 83% [27, 29]. У пациентов, ранее получавших BRAF-ингибиторы, объективный ответ на комбинированную терапию составил 15%, медиана ВБП – 2,8 месяца, медиана ОВ – 8,3 месяца, 1-годичная ОВ была достигнута в 32% случаев. Медиана наблюдения составила 6 месяцев [27, 29]. При последующем наблюдении медиана ОВ у пациентов, ранее не получавших BRAF-ингибиторы, составила 28,5 месяца (медиана наблюдения – 21 месяц) (рис. 6), 2-летняя ОВ равнялась 61 против 15% в группе больных, ранее леченных вемурафенибом (медиана наблюдения – 8 месяцев) [29].

Исследование co-BRIM
co-BRIM – многоцентровое рандомизированное двойное слепое плацебо-контролируемое исследование III фазы по сравнению эффективности комбинации кобиметиниб+вемурафениб против плацебо+вемурафениб у ранее не леченных пациентов с неоперабельной местно-распространенной или метастатической BRAF V600 позитивной МК [28]. Пациенты были рандомизированы на две группы: в первой группе больные получали комбинацию кобиметиниб (60 мг один раз в день в течение 21 дня каждые 28 дней)+вемурафениб (по 960 мг 2 раза в день), во второй группе курс терапии состоял из вемурафениба (по 960 мг 2 раза в день)+плацебо. Лечение проводилось до прогрессирования заболевания, непереносимой токсичности или отзыва согласия пациента.
В исследование были включены пациенты, первично леченные по поводу метастатического поражения головного мозга при условии стабилизации процесса в течение >3 недель [28].
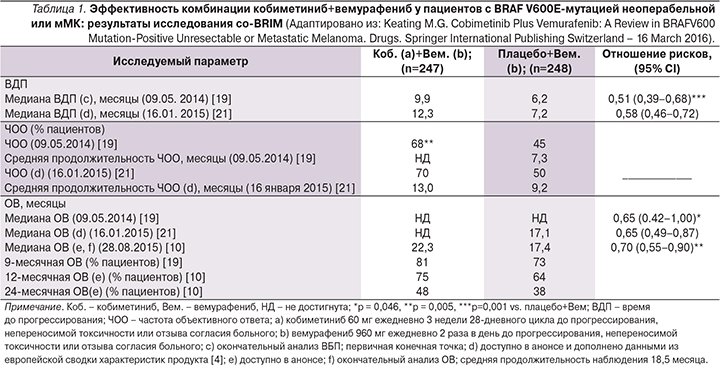
Основной целью исследования было изучение ВБП по оценке исследователей. Анализ данных проводился неоднократно: 9 мая 2014 г. (медиана длительности наблюдения для группы комбинированного лечения составила 7,4 месяца, для вемурафениба – 7), 16 января 2015 г. (медиана длительности наблюдения в первой группе равнялась 14,9 и 13,6 месяца – во второй). Терапия комбинацией кобиметиниб+вемурафениб достоверно увеличила ВБП по сравнению с монотерапией вемурафенибом у больных неоперабельной местно-распространенной или метастатической BRAF V600-позитивной МК. Медиана ВБП составила 9,9 месяца в группе пациентов, получавших комбинацию BRAF- и MEK-ингибиторов, и 6,2 – в группе вемурафениба (анализ данных на 09.05.2014). Обновленные данные на 16 января 2015 г. показывают, что ВБП при комбинированной терапии составила 12,3 месяца, при монотерапии вемурафенибом – 7,2 (рис. 7). Риск прогрессирования или смерти достоверно снизился на 42% (табл. 1) [30].
Объективный ответ был достоверно выше при комбинированной терапии кобиметиниб+вемурафениб по сравнению с монотерапией вемурафенибом (рис. 8). В соответствии с анализом данных на 09.05.2014 полный регресс опухоли отмечен у 10% больных, получавших комбинацию BRAF- и MEK-ингибиторов, и у 4% получавших монотерапию вемурафенибом. Частичный регресс составил 57 и 40% соответственно [28]. Большинство объективных ответов отмечено датой первого обследования на 8-й неделе лечения. Срез данных на 16.01.2015 показал, что частота полного регресса опухоли составила 16 против 11%, частичного регресса – 54 против 40%. Медиана продолжительности ответа равнялась 13 месяцам при комбинированной терапии кобиметиниб+вемурафениб и 9 месяцам – при монотерапии вемурафенибом [30].
Анализ финальных данных ОВ по состоянию на 28.08.2015 свидетельствует о достоверном снижении риска смерти на 30% при лечении комбинацией кобиметиниб+вемурафениб. Медиана ОВ у пациентов, получавших кобиметиниб+вемурафениб, составила 22,3 месяца, у больных, получавших только вемурафениб, – 17,4 (рис. 9). Одногодичная ОВ составила 75 против 64%, двугодичная – 48 против 38% соответственно (табл. 1) [8, 19]. Данные исследования свидетельствуют, что у пациентов с распространенной меланомой и мутацией BRAF лечение комбинацией кобиметиниб+вемурафениб приводило к достижению более длительной ОВ во всех клинических и молекулярных подгруппах по сравнению с лечением плацебо+вемурафениб. Так, утрата экспрессии PTEN и высокие уровни Ki67 оказывали отрицательное влияние на ОВ у пациентов группы плацебо+вемурафениб. Кобиметиниб ослаблял отрицательное влияние утраты экспрессии PTEN и высокого уровня Ki67; у пациентов группы кобиметиниб+вемурафениб отмечен сходный показатель ОВ независимо от статуса PTEN или Ki67. Количество копий BRAFV600 (частота аллеля BRAFV600) и активация пути, измеряемая по уровням pERK и pS6, не влияли на ОВ ни в одной группе лечения [19].
Переносимость и безопасность комбинации кобиметиниб+вемурафениб
Комбинация кобиметиниба с вемурафенибом имеет для пациентов с неоперабельной или мМК управляемый профиль токсичности и характеризуется удовлетворительной переносимостью. Профиль нежелательных явлений (НЯ) согласуется с данными предыдущих исследований комбинированной терапии. Нежелательные явления отмечены практически у всех пациентов с частотой 94–96% (табл. 2).
Однако наиболее частые НЯ обычно не превышали 1-й или 2-й степени выраженности и купировались путем коррекции дозы и симптоматической терапией. Отмена терапии в группе комбинированного лечения применялась в 13% случаев. Нежелательные явления 3–5-й степеней тяжести наблюдались с одинаковой частотой в обеих группах, что свидетельствует о благоприятном профиле безопасности комбинированной схемы лечения [31].
В исследовании co-BRIM для пациентов, получавших кобиметиниб+вемурафениб, наиболее частыми НЯ были следующие: диарея, тошнота, сыпь, артралгии, астения, реакции светочувствительности, гипертермия, рвота, повышение уровня аланинаминотрансферазы (AЛТ), повышение уровня аспартатаминотрансферазы (AСТ) и повышение уровня креатинина крови [28]. Некоторые НЯ (диарея, тошнота, рвота, реакции светочувствительности, повышение уровня креатинина крови, хориоретинопатии) чаще наблюдались у пациентов, получавших комбинированную терапию кобиметиниб+вемурафениб. В основном эти НЯ были 1-й или 2-й степени тяжести. Например, диарея 1-й, 2-й или 3-й степеней тяжести наблюдалась у 39%, 11и 6% пациентов, получавших комбинированную терапию, против 21%, 7 и 0% пациентов, получавших монотерапию вемурафенибом. Реакции светочувствительности 1-й, 2-й или 3 степеней тяжести были выявлены у 19%, 7 и 2% пациентов, получавших комбинированную терапию, против 10%, 5 и 0% пациентов, получавших вемурафениб в монотерапии.
Сыпь (любой степени тяжести) была отмечена у 39% пациентов, получавших вемурафениб в комбинации, по сравнению с 36% больных, получавших монотерапию вемурафенибом. Частота астении (любой степени тяжести) составила 32 и 31% соответственно, гипертермия (любой степени выраженности) отмечена в 26 и 22% случаев соответственно. Важно отметить, что кожные НЯ (например, плоскоклеточный рак кожи, кератоакантома, алопеция) наблюдались значительно реже среди пациентов, получавших комбинированную терапию, чем среди пациентов, получавших только вемурафениб [28].
В исследовании co-BRIM медиана времени до наступления диареи составила 0,33 месяца при терапии комбинацией против 1,84 – при монотерапии вемурафенибом, медиана времени до наступления реакций светочувствительности составила 1,38 по сравнению с 0,59 месяца, а медиана времени до появления кожной токсичности составила 0,43 по сравнению с 0,39 месяца [32]. Диарея купировалась в основном с помощью применения противодиарейных препаратов (у 6% больных), редко требовалось прерывание лечения или редукция дозы (2%) для пациентов, получавших кобиметиниб+вемурафениб. Терапия светочувствительности в большинстве случаев проводилась консервативно, прерывание лечения потребовалось в 1% случаев при комбинированной терапии; ни для одного пациента в этой группе лечения не потребовалось снижения дозы или отмена терапии из-за некупируемых реакций светочувствительности. Прерывание лечения, снижение дозы или прекращение терапии из-за сыпи имели место у 5%, 4 и 3% пациентов, получавших комбинацию кобиметиниба с вемурафенибом соответственно [32].
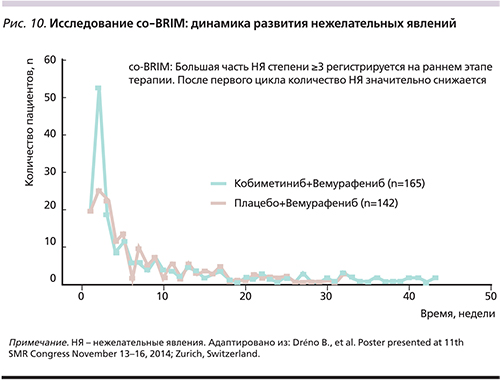
Наиболее часто выявляемыми НЯ 3-й степени тяжести для пациентов, получавших вемурафениб в комбинации, оказались повышение уровня АЛТ (11 против 6% пациентов при монотерапии), повышение уровня AСТ (8 против 2%), повышение уровня креатинина крови (7 против 0%), диарея (6 против 0%), сыпь (5 против 5%) и астения (4 против 3%) [28]. Нежелательные явления 4-й степени для пациентов, получавших комбинированную терапию, включали увеличение уровня креатинина крови (4%), сыпь (1%), повышение уровня АЛТ (0,4%) и отслоение сетчатки (0,4%). Повышение уровня АЛТ и АСТ 4-й степени токсичности наблюдалось с одинаковой частотой (0,4%) для пациентов, получавших вемурафениб в монорежиме [28]. Большинство впервые выявленных НЯ регистрировались в начале лечения, медиана времени до их появления составила 0,53 месяца для комбинации кобиметиниб+вемурафениб и 0,79 – при терапии только вемурафенибом (рис. 10) [32]. Среднее время разрешения НЯ, наступивших в течение первых 28 дней лечения, составило 0,5 месяца в обеих группах лечения [32].
Специфические нежелательные явления, представляющие интерес
Новые первично выявленные кожные злокачественные опухоли (в т.ч. плоскоклеточный рак кожи, базальноклеточная карцинома, кератоакантома и меланома) были зарегистрированы значительно реже у пациентов, получающих комбинацию препаратов кобиметиниб+вемурафениб, по сравнению с монотерапией [28]. В исследовании co-BRIM о выявлении плоскоклеточного рака кожи 3-й степени тяжести сообщалось у 2% больных, получавших комбинацию препаратов и у 11% получавших только вемурафениб. О регистрации кератоакантомы 3-й степени тяжести сообщалось у 1% и 8% больных в соответствующих группах лечения [28]. Вемурафениб также может способствовать росту других злокачественных опухолей, в т.ч. плоскоклеточного рака головы и шеи и злокачественных образований, связанных с активацией пути RAS [26].
Осложнения MEK-ингибиторов, включая кобиметиниб, связаны с появлением серозной ретинопатии [22, 24, 33]. По данным исследования co-BRIM, явления серозной ретинопатии наблюдались у 26% пациентов, получавших комбинацию препаратов кобиметиниб, и у 3% получавших монотерапию [33]. Медиана времени до регистрации серозной ретинопатии составила 1 месяц. Большинство пациентов имели бессимптомные проявления ретинопатии или легкие симптомы, требовавшие тщательного наблюдения без редукции доз кобиметиниба или вемурафениба [33].
Терапия вемурафенибом может осложниться удлинением интервала QTc [23, 26], однако удлинение интервала QTc не было зарегистрировано при комбинированной терапии кобиметиниб+вемурафениб [32]. В исследовании co-BRIM удлинение QT-интервала 1-й, 2-й или 3 степеней тяжести имело место у 2%, 1 и 0,4% пациентов, получавших комбинацию препаратов, и в 3%, 1 и 1% случаев при монотерапии вемурафенибом соответственно [28]. В открытом международном исследовании, в первую очередь предназначенном для изучения безопасности вемурафениба, у больных (n=3222) МК IIIC или IV стадии и наличием мутации в гене BRAFV600 удлинение QT-интервала (500 мс) было зарегистрировано среди 54 (2%) пациентов; нарушения ритма сердца были отмечены у 2 из этих пациентов, оба из которых имели предрасполагающие кардиологические факторы риска (гипертоническая болезнь, ишемическая болезнь сердца) [34]. Кардиомиопатия с наличием 2-й или 3-й степени снижения фракции выброса левого желудочка была зарегистрирована у 26% больных, получавших комбинацию кобиметиниб+вемурафениб, и у 19% получавших только вемурафениб в рамках исследования co-BRIM [24].
В исследовании co-BRIM сообщено о наблюдаемых кровоизлияниях на фоне комбинированной терапии кобиметиниб+вемурафениб, частота любой степени тяжести составила 13 против 7% при монотерапии вемурафенибом. Кровотечения 3-й и 4-й степеней тяжести наблюдались у 1,2 и 0,8% больных соответствующих групп лечения [24].
Место комбинации кобиметиниб+вемурафениб в лечении больных мМК и наличием мутации в гене BRAFV600
Проведенные ранее исследования III фазы показали увеличение ОВ и времени до прогрессирования у пациентов МК IIIC или IV стадии и наличием мутации в гене BRAFV600E при терапии вемурафенибом по сравнению с дакарбазином (р<0,001) [35, 8]. Тем не менее прогрессирование заболевания, как правило, происходит в течение 5–7 месяцев от начала лечения BRAF-ингибиторами, что отражает приобретение вторичной резистентности [7]. С учетом этого существует обоснование для блокирования МАРК пути в двух различных точках (например, BRAF-ингибитором в сочетании с MEK-ингибитором) [7]. Частота объективного ответа при комбинированной терапии значительно выше, чем при монотерапии вемурафенибом: большинство ответов наблюдалось на момент оценки опухоли на 8-й неделе, а средняя продолжительность ответа составила 13 месяцев.
С точки зрения стратегии борьбы с возникновением резистентности результаты доклинических исследований позволяют предположить, что интермиттирующее введение может задерживать начало появления резистентности к вемурафенибу [35].
В настоящее время проводятся исследования II фазы интермиттирующих режимов комбинации кобиметиниба с вемурафенибом, траметиниба с дабрафенибом. Кроме того, существует мнение, что добавление третьего ингибитора к комбинированной терапии (например ингибитора PI3K/Akt/МРМ-пути) может иметь дополнительную выгоду [36, 37]. Известно, что к основным факторам прогноза мМК относятся следующие показатели: уровень лактатдегидрогеназы, наличие метастатического поражения головного мозга, общий статус пациента по шкале ECOG.
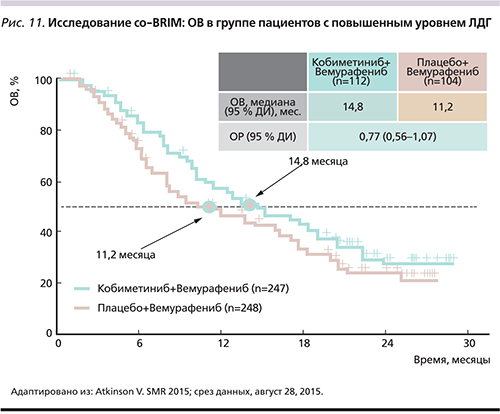
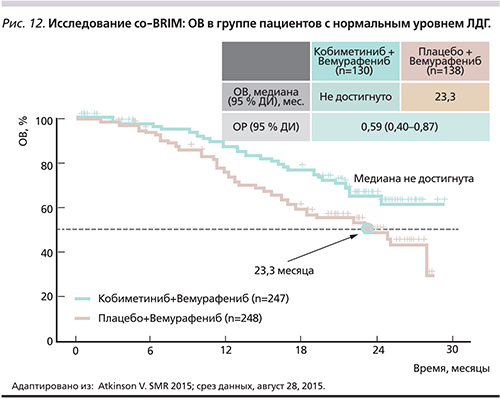
Вемурафениб обладает противоопухолевой активностью и приемлемым профилем токсичности у пациентов с мМК и наличием мутаций в гене BRAFV600 с метастатическим поражением головного мозга [38]. В рамках II фазы исследования (co-BRIM-В) изучается эффективность комбинированной терапии кобиметинибом с вемурафенибом для больных с метастазами меланомы в головном мозге [39]. Преимущество комбинации кобиметиниб+вемурафениб в отношении ОВ доказано в исследовании co-BRIM во всех подгруппах пациентов, включая пациентов с высоким и нормальным уровнями лактатдегидрогеназы, общим статусом ECOG 0 и 1 [19].
У пациентов с высоким уровнем ЛДГ при комбинированной терапии кобиметиниб+вемурафениб ОВ составила 14,8 месяца по сравнению с 11,2 – в группе терапии плацебо+вемурафениб ОР: 0,77) (рис. 11). При нормальном уровне ЛДГ медиана ОВ в группе пациентов, получавших комбинированную терапию, не была достигнута, в группе получавших вемурафениб в монотерапии составила 23,3 месяца (ОР: 0,59). Через 12 месяцев ОВ составила 74,5% для группы комбинированной терапии по сравнению с 63,8% для группы больных, получавших монотерапию, а через 24 месяца – 48,3 против 38,0% соответственно [19].
Комбинация кобиметиниб+вемура-фениб обладает управляемым профилем токсичности. Некоторые НЯ наблюдались с более высокой частотой при проведении комбинированной терапии по сравнению с монотерапией вемурафенибом, но большинство из них были 1-й или 2-й степени тяжести, а доля пациентов, прекративших лечение из-за токсичности, была одинаковой в обеих группах. Такие специфические НЯ, как плоскоклеточный рак кожи, кератоакантома, отмечались с меньшей частотой у пациентов, получавших комбинацию кобиметиниб+вемурафениб. Осложнения терапии BRAF-ингибиторами в виде появления второй опухоли: плоскоклеточного рака кожи или кератоакантомы, связаны с парадоксальной активацией пути MAPK в кератиноцитах [40]. Добавление MEK- ингибиторов способствует снижению частоты развития вторичных кожных новообразований путем блокирования парадоксальной активации пути MAPK в результате ингибирования киназы RAF. Пациенты, получавшие терапию кобиметинибом и вемурафенибом, должны регулярно наблюдаться на предмет возможного появления новых кожных опухолей [23, 24, 26]. Другие кожные НЯ в виде угревых высыпаний, подошвенного гиперкератоза, реакции светочувствительности могут отмечаться при терапии комбинацией кобиметиниба и вемурафениба с различной длительностью лечения. Это свидетельствует о необходимости наблюдения за пациентом независимо от продолжительности терапии [41].
Европейское общество медицинской онкологии (European Society for Medical Oncology, ESMO) рекомендует комбинированную терапию MEK- и BRAF-ингибиторами для терапии пациентов с мМК и положительной мутацией BRAFV600 в качестве терапии первой линии [42]. Рекомендации NCCN (National Comprehensive Cancer Network) включают несколько вариантов таргетной терапии ингибиторами тирозинкиназы в качестве первой линии при BRAFV600 положительной неоперабельной или мМК, в т.ч. кобиметиниб+вемурафениб, траметиниб+дабрафениб, вемурафениб, дабрафениб [43]. Оптимальная последовательность и сроки лечения остаются вариабельными [7]. Поскольку комбинированная терапия MEK- и BRAF-ингибиторами показала большую эффективность, предполагается, что монотерапия BRAF-ингибиторами может быть целесообразной для пациентов, которые не могут получать МЕК-ингибиторы из-за наличия выраженных явлений ретинопатии или нарушений функции сердца [7]. Последовательное лечение MEK-ингибиторами после отмены терапии BRAF-ингибиторами не показало преимуществ [7].
Выводы
- Комбинация кобиметиниб+вему-рафениб демонстрирует максимальную эффективность терапии (улучшение результатов ВБП, ОВ, увеличение частоты объективных ответов) и принципиально меняет прогноз для больных неоперабельной или мМК и наличием мутации в гене BRAFV600.
- Комбинированная терапия вемурафенибом и кобиметинибом демонстрирует управляемый профиль токсичности, благодаря чему хорошо переносится пациентами. Профиль НЯ согласуется с данными предыдущих исследований комбинированной терапии.
- Преимущество комбинации кобиметиниб+вемурафениб в отношении ОВ доказано во всех подгруппах пациентов независимо от молекулярно-генетического профиля опухоли, общего состояния больного по шкале ECOG, уровня ЛДГ.



