Введение
Аллотрансплантация почки (АТП) прочно вошла в рутинную медицинскую практику в качестве оптимального метода заместительной почечной терапии [1–4]. Результаты АТП последних лет достаточно успешны, но далеки от совершенства [5, 6]. Значительная часть пациентов после трансплантации почки демонстрирует дисфункцию ренальных аллотрансплантатов (РАТ), которая прогрессирует и ведет к его потере [7]. В связи с этим актуальным остается выявление факторов, влияющих на отдаленную выживаемость больных и РАТ, а также управление данными факторами с целью улучшения исходов АТП.
Одним из важных факторов, определяющих исходы АТП, является комплаентность пациентов [7, 8]. На сегодняшний день комплаентность (приверженность к лечению) определяют как способность к осознанному сотрудничеству с врачами с целью сохранения и улучшения уровня собственного здоровья [9]. Некомплаентность (noncompliance) пациента служит одной из ведущих причин потери почечного трансплантата [10–13].
В отечественной научной литературе по трансплантационной нефрологии работ, посвященных данному вопросу, мало [14], в связи с чем и было предпринято наше исследование.
Цель исследования – изучить комплаентность пациентов, перенесших аллотрансплантацию почки, как важнейший исход результатов операции.
Материал и методы
Проведено ретроспективное исследование когорты реципиентов почечного трансплантата из 260 человек. Возраст пациентов составил 36,2±0,6 года; от 12 лет до 61 года. Мужчин было 162 (62,3%), женщин – 98 (37,7%). Срок наблюдения составил 92,9±60,2, от 1,1 до 315 месяцев, медиана – 83,5 месяца.
Продолжительность диализа до АТП была 26,7±21,7, медиана – 20 месяцев. Трансплантаций с использованием трупного донора было выполнено 254 (97,7%), от живого родственного донора – 6 (2,3%). Первичных АТП было 251 (96,5%), повторных – 9 (3,5%).
Применялось три протокола иммуносупрессивной терапии (ИМСТ): 1 – циклоспорин, азатиоприн, преднизолон (67 АТП – 25,8%), 2 – циклоспорин, преднизолон, микофенолат (178 АТП – 68,5%), 3 – такролимус, преднизолон, микофенолат (14 АТП – 5,4%). Часть (135 человек – 51,9%) пациентов получали на этапе индукции блокаторы рецепторов интерлейкина-2 (базиликсимаб – %, либо даклизумаб – %).

Профилактическая противовирусная терапия (ППВТ) препаратом валганцикловир была назначена121 (38,1%) реципиенту.
Изучены следующие исходы АТП: выживаемость пациентов и трансплантатов, развитие ХДТ. Потерю трансплантата рассматривали либо как возвращение пациента на диализ вследствие утраты его функции, либо как следствие потери самого пациента (смерть с функционирующим трансплантатом).
Под отсроченной функцией трансплантата понимали необходимость проведения гемодиализа (ГД) после АТП.
Под ХДТ понимали повышение креатинина сыворотки крови (Кр) >0,135 ммол/л в течение 3 месяцев и более.
Под КОТ понимали внезапное повышение Кр в отсутствие подозрений на иные причины нарушения функции РАТ. В ряде случаев (31%) для диагностики КОТ проводили диагностическую биопсию трансплантата, оцениваемую по BANFF-критериям.
Были приняты следующие критерии комплаентности пациентов:
- пациент не пропускает без уважительной причины плановые визиты к нефрологу;
- при возникновении экстренной ситуации, связанной с его состоянием, немедленно консультируется с лечащим врачом по телефону;
- помнит наизусть названия препаратов, которые принимает (иммуносупрессанты, гипотензивные), знает их назначение, режим приема и безошибочно ориентируется в их дозировках.
Для проведения анализа кроме комплаентности исследовались такие параметры, как возраст и пол реципиентов, тип донора, индекс коморбидности по М. Чарлсон, курение до и после АТП, протокол ИМСТ, применение БРИ, КОТ, уровень креатинина (Кр) сыворотки и протеинурии через 1, 3 года и 5 лет после АТП, уровень в крови гемоглобина, альбумина холестерина, аланинаминотрансферазы (АЛТ) до и через 1, 3 года и 5 лет после операции, уровень артериальной гипертензии (АГ) через 1, 3 года и 5 лет после АТП, профилактическая противовирусная терапия (ППВТ), трудовая деятельность после АТП.
Статистическая обработка материала проведена с помощью пакета прикладных программ SPSS, версия 16. Использованы методы описательной статистики (среднее, ошибка среднего, стандартное отклонение, медиана), корреляционного анализа (корреляции Kendall), исследования функции выживаемости (Kaplan–Meier, Wilcoxon–Gehan), регрессионного анализа (логистический и Кокс-регресс). Проверка моделей логистического регресса (ЛР) проводилась с помощью теста Hosmer–Lemeshov, моделей Кокс-регресса – с помощью теста Omnibus. Значение статистической значимости было принято р<0,001.
Результаты
Пациенты были разделены на 2 группы: 1-я – комплаентные (172 человек) и 2-я группа – некомплаентные (88 человек). Распространенность некомплаентности в анализируемой группе таким образом составила 33,8%.
Однофакторный анализ
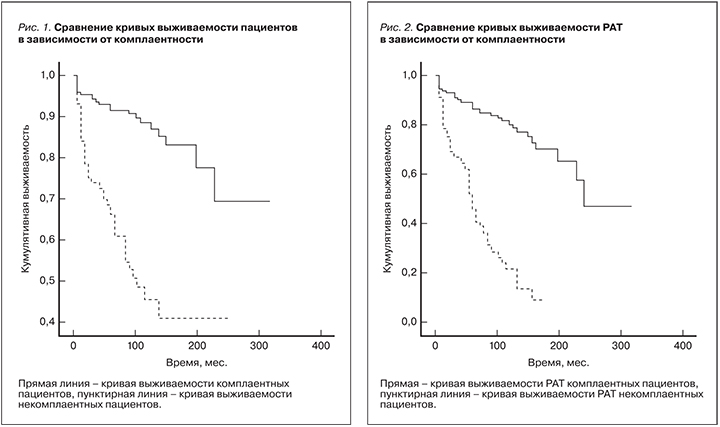
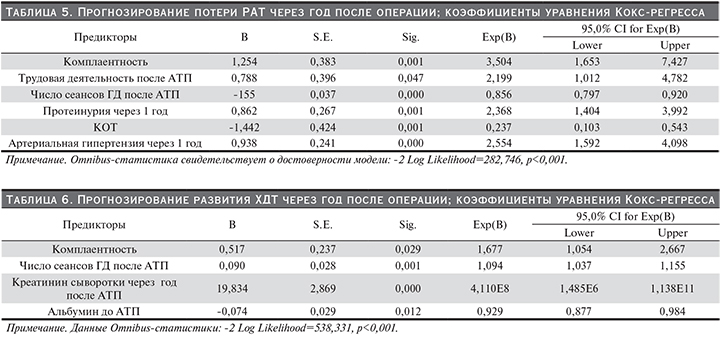
1-, 5-, 10-летняя выживаемость комплаентных пациентов составила 95, 93, 87%, некомплаентных – 81, 62, 46% соответственно. 1-, 5-, 10-летняя выживаемость РАТ комплаентных пациентов составила 94, 86, 78%, некомплаентных – 77, 40, 21% соответственно (р<0,001 для пациентов и трансплантатов; Wilcoxon–Gehan statistic, табл.1 и 2, рис. 1 и 2).

Данные корреляционного анализа (корреляции Kendall) выявили статистически достоверные связи комплаентности пациентов и ХДТ (k=-0,277, р<0,001), КОТ (k=-0,195, р=0,003) и их числа (k=-0,198, р=0,003). Данные коэффициенты корреляции отрицательные: чем ниже комплаентность пациентов, тем выше риск развития ХДТ и КОТ. Кроме того, выявлены статистически достоверные связи между комплаентностью и фактом курения после АТП (k=-0,324, р<0,001). Данный корреляционный коэффициент также имеет отрицательное значение: чем ниже степень комплаентности, тем выше вероятность курения пациента. Также выявлена достоверная связь между комплаентностью и фактом трудовой деятельности пациента после АТП (k=0,392, р<0,001). Последний коэффициент корреляции имеет положительное значение: чем выше комплаентность пациента, тем выше вероятность благоприятной трудовой реабилитации пациента с трансплантированной почкой.
Многофакторный анализ
1. Прогностические модели для срока 1 год после АТП
Прогнозирование для жизни пациента. Построена модель ЛР, данные по которой представлены в табл. 3.
Таким образом, выявлено 5 предикторов смерти пациента через год после операции: комплаентность (некомплаентность ассоциирована с повышением риска смерти), применение БРИ (применение снижает риск смерти), число сеансов ГД после АТП (чем больше, тем выше риск смерти), АГ через год (чем выше значения АД, тем выше риск смерти), холестерин до АТП (чем выше значение, тем выше риск смерти). Значение «р» в тесте Hosmer–Lemeshov (0,181) свидетельствует о том, что модель адекватно отражает наблюдаемые события.
Прогнозирование для ренального аллотрансплантата. Для прогнозирования риска потери РАТ также была построена модель ЛР, данные по которой представлены в табл. 4.
Таким образом, выявлено 5 предикторов потери РАТ через год после операции: трудовая деятельность после АТП (труд после АТП снижает риск потери трансплантата), комплаентность (комплаентные реципиенты имеют меньший риск потери РАТ), число сеансов ГД после АТП (чем большее число, тем выше риск потери трансплантата), АГ через год (чем выше значения АД, тем выше риск потери РАТ), холестерин через год после АТП (чем выше значение, тем выше риск потери РАТ), альбумин через год после АТП (чем ниже значение, тем выше риск потери РАТ). Значение «р» в тесте Hosmer–Lemeshov (0,286) свидетельствует о том, что модель соответствует наблюдаемым событиям.
Регрессионная модель Кокса для прогноза судьбы РАТ через год после АТП аналогичным образом выделила одним из предикторов исхода комплаентность (табл. 5).
Прогнозирование развития ХДТ. Регрессионная модель Кокса, построенная с целью прогнозирования развития ХДТ через год после АТП, также выделила одним из предикторов комплаентность (табл. 6).
2. Прогностические модели для срока 3 года после АТП
Ни в модели ЛР, ни в модели Кокс-регресса комплаентность не выделена как предиктор смерти пациента либо развития ХДТ, но модель ЛР и модель Кокс-регресса (табл. 7 и 8) выделяют комплаентность как предиктор потери РАТ.
Далее следует отметить, что для срока 5 лет после АТП ни с помощью построения моделей ЛР, ни Кокс-регресса комплаентность не была определена в качестве предиктора исходов АТП, что свидетельствует о низком числе некомплаентных пациентов, доживающих до данного срока после операции и еще более низком числе функционирующих РАТ.
Обсуждение
Некомплаентность пациентов после трансплантации почки, по признанию ряда исследователей, является распространенным явлением и приводит как к нежелательным клиническим последствиям, включающим смертность, потерю трансплантата и позднее отторжение, так и значительное повышение расходов на лечение [10, 15, 16]. K. Denhaerynck и соавт. в обзоре 2005 г. [8] приводят цифру распространенности данного явления от 2 до 67%, в среднем – 30%. В анализируемой группе мы также обнаружили распространенность некомплаентности на уровне около 34%. Некомплаентность ассоциируется с неблагоприятными клиническими исходами: снижение выживаемости как пациентов, так и РАТ (достигая 16% причин потерь трансплантатов). Мы получили данные, согласно которым 10-летняя выживаемость комплаентных пациентов после АТП составляет 87%, а некомплаентных – 41%. Еще большая разница получена для 10-летней выживаемости РАТ. Для трансплантатов комплаентных пациентов она составила 78%, некомплаентных – 21%.
Некоплаентность ассоциируется с 20% эпизодов позднего отторжения [8]. H. Vlaminck и соавт. [17] показывают, что в группе некомплаентных пациентов частота эпизодов позднего острого отторжения составила 21,2%, в группе комплаентных – 8%, что достигало уровня статистической значимости (р<0,05). Согласно нашим данным, некомплаентность также ассоциировалась как с кризами отторжения трансплантата, так и с их числом (р<0,01).
Проведенный нами многофакторный анализ продемонстрировал, что комплаентность пациента является достоверным предиктором через год после АТП как для жизни пациента, функционирования РАТ, так и для развития хронической дисфункции пересаженной почки.
Заключение
Комплаентность реципиентов ренального аллотрансплантата является независимым значимым предиктором исходов трансплантации почки, оказывающим влияние как на выживаемость реципиентов и ренальных аллотрансплантатов, так и на развитие хронической дисфункции трансплантата. Усилия клиницистов должны быть, таким образом, направлены на преодоление проблемы некомплаентности с целью улучшения результатов трансплантации почки.



