Анализ многочисленных исследований свидетельствует о поражении тканей пародонта при заболеваниях органов пищеварительного тракта. В свою очередь воспалительно-деструктивное поражение пародонта может приводить к сенсибилизации всего организма и усугублению течения заболеваний нестоматологического профиля. В ряде случаев тяжесть заболеваний гастродуоденальной зоны напрямую коррелирует с выраженностью очагов поражения в ротовой полости и эффективностью проводимого лечения воспалительной патологии пародонта и слизистой оболочки полости рта [1, 2].
Патология желудочного кислотообразования является причиной многих т.н. кислотозависимых заболеваний, среди которых патология желудка и двенадцатиперстной кишки – ДПК (язвенная болезнь, эрозивно-язвенное поражение, хронический гастрит, гастродуоденит, синдром функциональной диспепсии – ФД) занимают главенствующие роли [3, 4].
Симптомы диспепсии принадлежат к числу часто встречающихся гастроэнтерологических жалоб. Среди многих этиологических факторов ФД следует выделить инфицированность Helicobacter pylori и нарушение гастродуоденальной моторики [5–8]. По результатам рандомизированного контролируемого исследования R.F. Harvey и соавт. (2010) с периодом наблюдения от 2 до 7 лет, эрадикация Н. рylori ведет к снижению частоты обращений по поводу диспепсии на 25% [9].
Эрозивно-язвенные поражения гастродуоденальной зоны (ГДЗ) относятся к широко распространенным страданиям человечества. На сегодняшний день не подлежит сомнению ведущая роль инфекции H. pylori в патогенезе H. pylori-ассоциированной язвенной болезни [3, 10–12]. Достоверно известно, что воспалительно-деструктивные процессы в тканях пародонта напрямую коррелируют с развитием эрозивно-язвенных процессов в слизистой оболочке пищевода, желудка и ДПК [13–15].
Целью настоящего исследования явилось изучение клинических особенностей пародонтологического статуса пациентов с диспепсическим синдромом, а также оценка эффективности современных эрадикационных схем и антисекреторных препаратов в лечении H. pylori-ассоциированной патологии ГДЗ.
Материал и методы
Для решения поставленной задачи мы обследовали 158 пациентов с диспепсическим синдромом. В основную группу вошли 118 пациентов с синдромом диспепсии, первоначально обратившихся за медицинской помощью в гастроэнтерологическое отделение ГКГ МВД РФ. В дополнительную группу были включены 40 пациентов, которые первоначально обратились за помощью в пародонтологическое отделение МГМСУ (пациенты с пародонтитом средней степени тяжести, длительным диспепсическим статусом и неярко выраженным диспепсическим синдромом). Большинство пациентов основной группы составили мужчины (64), женщин было 54, что вероятно, можно связать с гендерной особенностью контингента пациентов ГКГ МВД РФ.
Группа пациентов с синдромом эпигастральной боли (СЭБ) составила 36 (20,3% мужчин и 10,2% женщин) человек; с постпрандиальным дистресс-синдромом (ПДС) – 44 (13,6% мужчин и 23,7% женщин), со смешанной формой – 38 (20,3% мужчин и 11,9% женщин) человек.
Для постановки диагноза использовались данные клинических, лабораторных и инструментальных методов исследования, ультразвуковая диагностика, эзофагогастродуоденоскопия (ЭГДС), 24-часовое мониторирование внутрижелудочного pH, рентгенологическое исследование органов желудочно-кишечного тракта. Для верификации инфекции H. pylori мы применяли гистологическое исследование, быстрый биопсийный уреазный тест гастробиоптата (ББУТ), быстрый уреазный дыхательный тест (БУДТ). Контроль эффективности эрадикации хеликобактериоза проводился через 4 недели после окончания терапевтической санации. Результат оценивался при совпадении данных двух из трех методик. Динамика купирования болевого синдрома и диспептических жалоб оценивалась на 3-е, 5, 7-е сутки и через месяц после лечения. Оценка интенсивности болевого синдрома (слабые, умеренные и выраженные боли) проводилась самим пациентом до лечения и через месяц после. Также нами оценивалась степень выраженности дискинетических жалоб.

Больным диспепсическим синдромом назначалась терапия прокинетическим препаратом домперидон в дозе 10 мг 3 раза в сутки, а при наличии интенсивного болевого синдрома (68 пациентов) – ингибиторы протонной помпы (ИПП): 32 человека принимали омепразол в дозе 20 мг 1 раз в сутки; 36 человек – рабепразол в дозе 20 мг 1 раз в сутки. Продолжительность терапии составила 3 недели. Пациентам, страдавшим H. pylori-ассоциированным поражением ГДЗ (52 человека), назначалась эрадикационная схема лечения (амоксициллин 1000 мг 2 раза в сутки, кларитромицин 500 мг 2 раза в сутки 7 дней+ИПП).
Пациенты с синдромом ФД предъявляли жалобы на болевые ощущения в эпигастральной области (59,3%), вздутие, чувство распирания в эпигастрии после еды, чувство быстрого насыщения при небольших порциях пищи, тошноту и отрыжку (20,3%), а также смешанные жалобы различной интенсивности. Умеренно выраженные боли наиболее часто регистрировались среди обследованных пациентов с болевым синдромом. Более того, наличие болевого абдоминального синдрома у обследованных больных достоверно коррелировало с повышением уровня кислотообразования в желудке (p<0,05), а нормацидные и гипоацидные состояния у пациентов часто сопровождались болями средней и слабой выраженности. Поражение ГДЗ-инфекцией H. pylori определялось у 52 (44,1%) пациентов. Следует отметить, что инфицированность H. pylori превалировала в группе пациентов с СЭБ (55,6%), среди которых H. pylori-инфицированных пациентов с болевым синдром сильной интенсивности было в 2 раза больше, чем H. pylori-негативных (17,1 и 8,6% соответственно).
Результаты исследования
Через 4 недели на фоне лечения диспепсические симптомы: тошнота, чувство распирания в эпигастрии сохранялись лишь у 5,8% пациентов, инфицированных H. pylori. Мы предполагаем, что у 58,5% больных из всех обследованных имела место собственно ФД, а у 41,5% пациентов – вторичная диспепия, ассоциированная с хеликобактерным поражением ГДЗ, что согласуется с данными Киотского консенсуса 2014 г. По результатам проведенного исследования следует отметить, что в отношении пациентов с СЭБ целесообразно комбинировать антисекре-торные препараты и прокинетики, а при ПДС и смешанной форме ФД назначать прокинетические препараты. В случае выявления гиперацидности терапия должна дополняться антисекреторными средствами.
Через 4 недели после окончания курса эрадикации на контрольный осмотр прошли 49 человек. Результаты эрадикационной терапии приведены в табл. 1.
Таким образом, более стабильные клинически эффективные результаты были достигнуты при включении в схему лечения рабепразола.
Стоматологическое лечение включало составление индивидуального плана стоматологического лечения с учетом пародонтологического статуса, характера течения и длительности патологии тканей пародонта. Интересен тот факт, что состояние слизистой оболочки рта у обследованных пациентов с синдромом ФД не отличалось от такового у пациентов без диспепсического синдрома в анамнезе. В исследуемую группу вошли 40 пациентов с длительным диспепсическим статусом со стоматологическим диагнозом «хронический генерализованный пародонтит средней степени» (ХГП СС). Была проведена оценка эффективности лечения пациентов с ХГП СС на всех этапах стандартной консервативной терапии (монотерапия) и комбинации стандартной методики с современным способом антисептического воздействия – фотодинамической терапией (ФДТ). В качестве фотосенсибилизатора использовался Фотодитазин 0,5%-ный гель-пенетратор. Для получения объективной информации был проведен анализ клинических данных 40 пациентов с ХГП СС (средний возраст – 49,33±1,02 года, средняя длительность заболевания – 19,73±1,01). Никто из обследованных пациентов не получал антибактериальной и антисептической терапии в течение последних 6 месяцев. До начала лечения объективные клинические данные соответствовали картине пародонтита средней степени тяжести. В результате однофакторного дисперсионного анализа не было выявлено статистически значимых отличий между пациентами всех групп по каждому из клинических показателей до лечения.

Проведенные исследования после лечения показали статистически значимое уменьшение клинических показателей в первой (стандартная терапия+ФДТ) и второй (стандартная монотерапии) группах по сравнению с исходным уровнем данных показателей в них. К 40-му дню на фоне лечения все обследованные больные отмечали исчезновение неприятного запаха изо рта, дискомфорта в десне при чистке зубов, уменьшение кровоточивости десны при применении зубных щеток и ершиков для межзубных промежутков. Через 90 и 180 суток десна большинства пациентов имела бледно-розовый цвет, нормальную увлажненность, признаки воспаления отсутствовали.
В первой и второй группах отмечена позитивная динамика показателей пародонтального индекса по Russel на фоне проведенного лечения. Однако лучшие результаты были достигнуты на сроке наблюдения 6 месяцев при комбинации ФДТ со стандартной методикой по сравнению с группой монотерапии (табл. 2).
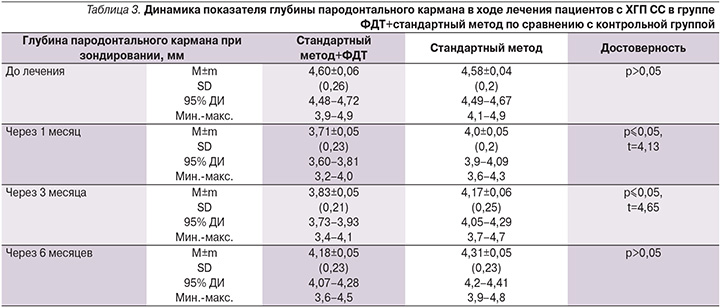
При зондировании регистрировалось уменьшение глубины пародонтальных карманов у пациентов обеих групп в течение всего срока наблюдения. Более значимые результаты были достигнуты при комбинации ФДТ со стандартной методикой на сроке наблюдения 40 и 90 суток по сравнению с показателями группы монотерапии (табл. 3).
Резюмируя, отметим, что в группе комбинированной терапии, включившей удаление назубных отложений с последующей полировкой корня и дальнейшим применением ФДТ, наблюдали улучшение показателей стоматологического статуса по основным контрольным параметрам на этапе наблюдения 1,5 месяца. В заключение отметим, что проведенное исследование демонстрирует один из многих путей повышения эффективности консервативного лечения пациентов с ХГП СС, сочетанным с диспепсическим синдромом, способствующий сохранению тканей пародонта.
Таким образом, ФДТ может претендовать в ближайшем будущем на реальную альтернативу традиционным методам антисептического воздействия, особенно в случаях противопоказаний к применению последних, и может быть рекомендована к регулярному применению на пародонтологическом приеме для антисептической обработки пародонтальных карманов у пациентов с сочетанной патологией пародонта и ГДЗ.
Материал и методы
Для оценки эффективности современных эрадикационных схем в лечении H. pylori-ассоциированной патологии ГДЗ нами был обследован 151 пациент с эрозивно-язвенными поражениями ГДЗ. Средний возраст пациентов составил 42,8 года (у мужчин – 41,9, у женщин – 43,5 года). Длительность заболевания по язвенной болезни ДПК составила 6,2 года, по эрозивному гастриту – 3,5, по язвенной болезни желудка – 5,8 года. Язвенная болезнь желудка была обнаружена у 11 (7,3%) пациентов, язвенная болезнь ДПК – у 64 (42,4%), эрозивный гастрит – у 76 (50,3%) пациентов.
Для решения поставленных задач все больные были разделены на 4 группы в зависимости от схемы эрадикационной терапии с учетом последних рекомендаций Маастрихт-V.
В 1-ю группу вошли 32 пациента, получавшие классическую тройную терапию (омепразол 20 мг 2 раза в сутки, амоксициллин 1000 мг 2 раза в сутки, кларитромицин 500 мг 2 раза в сутки в течение 7 дней), во 2-ю группу – 42 пациента, получавшие четырехкомпонентную терапию на основе висмута трикалия дицитрата (эзомепразол 20 мг 2 раза в сутки, кларитромицин 500 мг 2 раза в сутки, висмута трикалия дицитрат 240 мг 2 раза в сутки, амоксициллин 1000 мг 2 раза в сутки в течение 10 дней), в 3-ю группу – 33 пациента, получавших последовательную терапию (с 1-го по 10-й день омепразол 20 мг 2 раза в сутки, с 1-го по 5-й день к терапии омепразолом добавлялся амоксициллин 1000 мг 2 раза в сутки, с 6-го по 10-й день вместо амоксициллина пациенты получали 2 антибиотика – кларитромицин 500 мг и тинидазол 500 мг 2 раза в сутки), в 4-ю группу – 44 пациента, получавших модифицированную последовательную терапию с включением висмута трикалия дицитрата (к стандартным компонентам последовательного режима добавлялся висмут трикалия дицитрат в дозе 240 мг 2 раза в сутки на весь период терапии).
При появлении симптомов антибиотикоассоциированной диареи (ААД) пациенты принимали Энтерол (лиофилизированные Saccharomyces boulardii) в стандартной дозе 1 капсула 2 раза в сутки. Верификация инфекции H. pylori проведена при помощи быстрого уреазного теста и 13С-уреазного дыхательного теста (УДТ). В исследование были включены только пациенты, страдавшие эрозивно-язвенными поражениями желудка и ДПК, ассоциированными с H. рylori, поэтому у 100% пациентов всех групп инфицированность была подтверждена с помощью быстрого уреазного теста и УДТ. Контроль эффективности эрадикационной терапии проведен на 60-й день наблюдения при помощи уреазного дыхательного теста.
Результаты исследования
При анализе динамики купирования болевого синдрома обратили внимание на тот факт, что в 1-й группе на фоне проводимой терапии выраженные болевые ощущения по интенсивности снизились у 5 пациентов к 6-му дню лечения, однако были полностью купированы у 24 пациентов только к 8-му дню лечения, у остальных 8 пациентов болевой синдром сохранялся и на 10–12-й день наблюдения, несколько снижаясь по постоянству и интенсивности.
Рассматривая динамику субъективных болевых ощущений у пациентов 2-й группы следует подчеркнуть, что у больных, страдавших эрозивным гастритом, болевые ощущения были полностью купированы на 3–4-й день лечения, а у пациентов с язвенным дефектом ДПК к 3–4-му дню отмечалось значительное уменьшение интенсивности боли, которая полностью купировалась на 6-й день лечения, и лишь 1 пациент отметил сохраняющийся болевой синдром до 7-го дня терапии.
В 3-й группе пациентов динамика болевого синдрома выглядела следующим образом: 21 отмечал выраженное снижение болевого синдрома к 5-му дню лечения, полностью болевой синдром был купирован у всех пациентов к 7-му дню проводимой терапии.
Пятнадцать человек из 4-й группы не предъявляли жалоб на боли в животе на 3–4-й день проводимой терапии, еще 14 в тот день заметили значительное снижение интенсивности болевых ощущений, к 6–7-му дню от начала терапии болевые ощущения были полностью купированы.
Одновременно с болевым синдромом оценивался регресс пальпаторной болезненности в эпигастральной и пилородуоденальной областях, отсутствие мышечного дефанса. Как оказалось, данные симптомы купировались практически параллельно с исчезновением болевых ощущений во 2-й и 4-й группах, а в 1-й и 3-й группах данные симптомы регрессировали на 1–2 дня позже купирования боли. В целом к 21-му дню от начала лечении у всех пациентов при объективном обследовании отмечено отсутствие болевых ощущений.
Наблюдая за синдромом диспепсии, мы отметили, что такие симптомы, как ощущение тяжести в эпигастрии, тошнота, отрыжка кислым, у 46% пациентов 2-й и 4-й групп уменьшилась уже на 3-й день, а еще 30% пациентов данных групп отметили отсутствие обозначенных симптомов в эти сроки лечения. Полностью купирование синдрома желудочной диспепсии у 100% пациентов 2-й и 4-й групп произошло к 5-му дню лечения, тогда как 30% пациентов 1-й группы наблюдали уменьшение данных симптомов только к 5-му дню лечения, у 50% они были полностью купированы только к 7-му дню терапии.
У остальных же пациентов ощущение переполненности в эпигастрии сохранялось и на 8-й день наблюдения, в 3-й группе (последовательной терапии) пациентов болевые ощущения были купированы у 5% на 3–4-й, у 35% – на 5–6-й день терапии (у остальных снизилась интенсивность болевых ощущений), полностью симптомы желудочной диспепсии были купированы на 7-й день лечения.
У пациентов, отмечавших рвоту на высоте болевых ощущений, данный симптом во время лечения и наблюдения не рецидивировал.
Оценка изменений симптомокомплекса кишечной диспепсии показала, что у большинства пациентов всех групп стул нормализовался на 6–7-й день терапии; у 4 (12,5%) пациентов 1-й, 4 (9,5%) пациентов 2-й, 6 (18,1%) пациентов 3-й и 5 (15,1%) пациентов 4-й групп нормализация стула отмечена уже на 5-й день лечения.
При анализе частоты возникновения ААД у больных на фоне эрадикационной терапии мы отметили симптомы умеренной диареи у 20 (13,2%) пациентов; из всей группы обследованных у 9 – на 3-й день эрадикации и у 11 – на 6-й день терапии. Симптомы ААД удалось купировать при помощи пробиотика Энтерола на 2-й день приема пробиотического препарата. Также регистрировались слабовыраженные побочные эффекты эрадикационной терапии в виде сухости во рту, которые самостоятельно купировались после окончания курса лечения.
При контрольном исследовании анализа крови и мочи отклонений от нормальных показателей выявлено не было. Биохимический анализ крови также не претерпел каких-либо изменений. При контрольном ультразвуковом исследовании брюшной полости сохранялись прежние изменения.
По данным ЭГДС, к 21-му дню лечения положительная картина была отмечена у подавляющего числа пациентов всех групп, однако следует отметить некоторые особенности, а именно: в 1-й группе у 9 (28,1%) пациентов оставались явления перифокальной гиперемии вокруг послеязвенного рубца в ДПК, а рубцовые изменения выявлялись у 6 (18,7%) пациентов. Во 2-й и 4-й группах отмечена выраженная положительная эндоскопическая динамика в виде заживления язвенных дефектов и эрозий без образования рубца. В 3-й группе (последовательной терапии) было также отмечено заживление всех язвенных и эрозивных дефектов, однако у двух пациентов имела место небольшая деформация луковицы ДПК. Также у некоторых пациентов сохранялись признаки поверхностного гастродуоденита: 25 (78,1%) пациентов в 1-й группе, 15 (35,7%) – во 2-й, 15 (45,4%) – в 3-й и 14 (31,8%) человек в 4-й группе. Признаков резко выраженного гастродуоденита контрольное эндоскопическое исследование не выявило.
По данным 13С-уреазного дыхательного теста, примерно на 60-й день наблюдения уровень эрадикации H. pylori при использовании классической тройной (1-я группа) схемы антихеликобактерной терапии составил 71,8% (23 из 32 пациентов), при использовании четырехкомпонентной схемы уровень эрадикации – 95,2% (40 из 42 пациентов), классический последовательный режим эрадикации позволил уничтожить H. pylori у 84,8% (28 из 33 пациентов) пациентов, модифицированная последовательная терапия с включением висмута трикалия дицитрата показала 95,4% эрадикации (42 пациента из 44).
При поэтапном сравнении 2-й (четырехкомпонентная терапия на основе висмута трикалия дицитрата; 95,2% эрадикации) и 4-й (модифицированная последовательная терапия с включением висмута трикалия дицитрата; 95,4% эрадикации) групп с классической тройной схемой (71,8%) были получены статистически значимые отличия (р<0,047 и р<0,032 соответственно). При сравнении эффективности последовательной терапии, при которой уровень эрадикации составил 84,8%, с классической тройной схемой (71,8%) статистически значимых отличий получено не было (р<0,467).
Более высокий результат эрадикации, полученный нами в 3-й группе пациентов по сравнению с 1-й группой, может быть обусловлен способностью амоксициллина увеличивать антибактериальную эффективность комбинации антибиотиков, которые назначаются на втором этапе эрадикации, а включение в схему санации препарата висмута трикалия дицитрата позволяет достоверно улучшить результативность лечения.
Подводя итоги исследования, следует отметить, что поиск оптимальных препаратов для комплексного лечения и способов профилактики сочетанной кислотозависимой патологии ГДЗ и пародонта остается чрезвычайно интересной и актуальной задачей.



