Лимфангиома – редкий врожденный порок развития, характеризующийся пролиферацией лимфатических сосудов с образованием множества тонкостенных кист различного диаметра, выстланных эндотелием и заполненных хилусом. Развитие данной патологии происходит в результате полной или частичной обструкции лимфатических сосудов и отсутствия их сообщения с венозной системой, в результате чего происходит формирование кистозных полостей [1–4].
Согласно данным литературы, лимфангиома встречается в 1 случае на 6000 новорожденных и составляет 10–12% от числа всех доброкачественных новообразований у детей [1–6]. Однако если учитывать случаи прерывания беременности, популяционная частота составляет 1:750–875 [2, 7, 8].
Выделяют три типа лимфангиом: капиллярную (простую), кавернозную и кистозную. Простая лимфангиома формируется из лимфатических капилляров и локализуется на ограниченных участках кожи и подкожной клетчатки. Кавернозная лимфангиома сформирована из лимфатических сосудов более крупного диаметра. Она представлена неравномерно наполненными лимфой полостями, которые образованы из соединительнотканной губчатой основы, содержащей гладкие мышечные волокна, эластический каркас и мелкие лимфатические сосуды, выстланные эпителием. Кистозная лимфангиома представлена одной или множеством кист, величиной от нескольких миллиметров до нескольких сантиметров, которые могут сообщаться между собой. Их внутренняя поверхность выстлана эндотелием, а стенки содержат плотную соединительную ткань. Кавернозная и кистозная лимфангиомы встречаются наиболее часто, причем оба этих типа могут располагаться в одном образовании [2, 7–11].
Лимфангиома может иметь различную локализацию. Однако наиболее часто, в 75–80% случаев, она располагается в области шеи, в 20% – в подмышечной области, в 2% – в брюшной полости и ретроперитонеально, в 2% – в конечностях и костях и только в 1% – в средостении [2, 5, 6, 8–10].
Лимфангиома, локализующаяся в области шеи, известна также как шейная гигрома. Данное образование возникает в ранние сроки беременности и более чем в 50% наблюдений ассоциируется с хромосомными аберрациями и структурными аномалиями. Наиболее часто при шейной гигроме встречаются трисомия 21, синдром Тернера, трисомия 18, трисомия 13, триплоидия, синдром Нунана [2].
Неблагоприятный исход беременности при данной патологии отмечается в 77,8% наблюдений [2, 7]. Лишь у 16,7–22,2% пациентов происходит рассасывание образования и рождение ребенка без сопутствующих аномалий. Развитие водянки плода также свидетельствует о неблагоприятном исходе [2, 7].
При эхографии кистозная гигрома чаще всего представлена многокамерным двусторонним образованием с тонкими перегородками, локализующимся кзади и сбоку от шеи. При допплеровском картировании отмечается отсутствие кровотока. Размеры образования могут варьировать от нескольких миллиметров до нескольких сантиметров [8, 12]. Дифференциальный диагноз необходимо проводить с энцефалоцеле, тератомой шеи, эпидермальной кистой задней поверхности головы, кистозной гетеротопией головного мозга [8, 12].
Тактика ведения беременности при кистозной гигроме прежде всего заключается в проведении генетического исследования для исключения анэуплоидии. В процессе прогрессирования беременности также показано ультразвуковое исследование для оценки размеров образования, поскольку большой размер может явиться причиной дистоции в родах, сдавления дыхательных путей или сложностей с кормлением новорожденного.
Z. Mikovic et al. [13] сообщают об успешном внутриутробном лечении двух пациентов с лимфангиомой шеи плода, которое было проведено в сроке гестации 28 недель. Авторы проводили внутриматочную аспирацию жидкости из кистозной гигромы и последующее введение препарата OK-432 (Пицибанил). После рождения лечение не понадобилось.
При наличии риска обструкции дыхательных путей после рождения рекомендуется проведение процедуры ex utero intrapartum treatment [14].
Тактика ведения пациентов после рождения заключается в хирургическом удалении опухоли или пункции крупных полостей с введением склерозирующего препарата.
Лимфангиома подмышечной области встречается в 20% наблюдений. В отличие от лимфангиомы шеи, более редкие варианты локализации образований манифестируют в середине беременности. Ряд авторов полагают, что они не сочетаются с хромосомными аномалиями [4, 6, 11, 15]. Однако, учитывая небольшое количество наблюдений, некоторые исследователи [8, 16] рекомендуют проводить кариотипирование при данной патологии, поскольку риск хромосомной патологии точно не установлен. A. Reichler и M. Bronshtein [16] отмечают, что в 3 из 5 наблюдений лимфангиомы подмышечной области выявлен патологический кариотип.
В литературе приводятся единичные клинические наблюдения лимфангиом подмышечной области больших размеров от 6 до 14 см, причем некоторые из них распространялись также и на торакоабдоминальную область. Во всех наблюдениях кариотип плодов был не изменен [2–4, 15, 17]. В 6 из 9 случаев после рождения детей проведено успешное хирургическое лечение, в 2 – беременность закончилась прерыванием по желанию родителей, в 1 – внутриутробной гибелью плода.
Пренатальная диагностика лимфангиомы подмышечной области возможна во II–III триместре беременности. Она основана на выявлении в подмышечной области гипоэхогенного кистозного многокамерного образования с тонкими перегородками и отсутствием зон кровотока при допплеровском картировании. Размеры образования могут варьировать от нескольких миллиметров до гигантских размеров. Дифференциальный диагноз необходимо проводить с гемангиомой, тератомой, синдромом Клиппеля–Треноне [2, 6, 11, 18].
Тактика родоразрешения зависит от размера образования. Так, если небольшие лимфангиомы не влияют на метод родоразрешения, то образования больших размеров могут явиться причиной осложнений в родах, таких как дистоция, травматизация и инфицирование. Поэтому это может явиться показанием для родоразрешения путем операции кесарева сечения. Необходимо так же отметить и то, что родоразрешение должно проводиться в центрах с возможностью оказания реанимационной помощи новорожденным [3, 4, 6, 15].
Прогноз при данной локализации лимфангиом зависит прежде всего от наличия сочетанных пороков развития и хромосомной патологии. При их отсутствии он в целом благоприятный. При лимфангиоме подмышечной области важное прогностическое значение имеет глубина инвазии [3, 6, 11]. После рождения показано оперативное удаление образования. Как правило, подмышечные лимфангиомы хорошо выделяются из окружающих тканей хирургическим путем по сравнению с шейной локализацией, и при вмешательстве меньше рисков повреждения важных анатомических структур. Рецидивы встречаются в 10–15% и связаны с технической возможностью полного удаления патологической ткани.
Абдоминальная лимфангиома наблюдается в 2% случаев. Диагностика ее становится возможной в конце II – начале III триместра беременности. При эхографии она обычно представлена многокамерным кистозным образованием, не связанным с органами брюшной полости. Наиболее часто абдоминальные лимфангиомы исходят из брыжейки тонкой кишки и забрюшинного пространства. Прогноз при абдоминальной лимфангиоме в большинстве случаев благоприятный. Однако в случаях сочетания лимфангиомы с асцитом или при распространении ее на другие части тела прогноз резко ухудшается. Поэтому в случаях абдоминальной лимфангиомы необходимо тщательное обследование плода для исключения сочетанных заболеваний и пороков развития [12, 19, 20].
P. Deshpande et al. [20] при анализе опубликованных наблюдений пришли к заключению, что наиболее часто отмечается левостороннее расположение абдоминальной лимфангиомы. К возможным осложнениям в пренатальном периоде при данной патологии относятся развитие водянки плода, асцита и многоводия.
Единичные лимфангиомы даже больших размеров могут быть полностью удалены оперативно. Хирургическое лечение множественных образований достаточно сложное и ассоциируется с высоким уровнем летальности [20].
В связи с редкостью данной патологии в настоящее время в литературе приводится описание только отдельных случаев лимфангиом.
Приведенные в литературе наблюдения свидетельствуют, что возможны три варианта исхода при абдоминальной лифангиоме у плода. При первом проводится хирургическое удаление образования после рождения, даже при больших размерах (до 9,0 см), в большинстве случаев с благоприятным исходом [21]; при втором – в пренатальном периоде возможно резкое увеличение лимфангиомы и распространение ее на другие части тела, а также появление множественных образований [20, 22]. Прогноз беременности при подобном течении заболевания сомнительный.
В крайне редких случаях возможно внутриутробное спонтанное исчезновение лимфангиомы [23, 24].
Ряд авторов полагают, что развитие абдоминальной лимфангиомы является следствием лимфатической обструкции в результате заворота кишечника. Другие же, напротив, считают, что заворот кишечника, нарушение его васкуляризации и асцит развиваются вследствие смещения кишечника объемным образованием [25].
Лимфангиома конечностей встречается крайне редко и составляет 2% всех лимфангиом. В литературе приведены лишь единичные наблюдения данной локализации лимфангиомы. E.R. Sung [26] представил наблюдение лимфангиомы, которая была выявлена в 28 недель беременности и локализовалась в правой половине брюшной полости с переходом на правое бедро и голень. Беременность была прервана в связи с неблагоприятным прогнозом.
Изолированная лимфангиома средостения – крайне редкая патология, частота ее встречаемости составляет 0,7–4,5% всех опухолевидных образований средостения и 1% – всех лимфангиом [27]. В 75% случаев данная патология диагностируется в зрелом возрасте. Течение заболевания может протекать бессимптомно многие годы и проявиться только в случае сдавления витальных структур [5, 27, 28].
Случаи пренатальной диагностики изолированной лимфангиомы средостения крайне редки. В настоящее время в англоязычной литературе представлены только 12 наблюдений данной патологии у плода [5, 27–29]. Срок их диагностики составил 20–31 неделю беременности. В 10 случаях лимфангиома локализовалась в переднем средостении и в 2 – в заднем. Размеры варьировали в среднем от 2,0 до 4,5 см. В процессе динамического наблюдения в 1 случае отмечено спонтанное исчезновение образования, в 5 – размеры в течение беременности не изменились, в 6 – отмечен рост, из них в 3 случаях присоединилась водянка плода и в 1 – зарегистрирован летальный исход после рождения ребенка. У 10 детей проведено полное или частичное хирургическое удаление опухоли в возрасте до 1 года жизни с благоприятным исходом и у 1 – при отсутствии клинических симптомов проводится динамическое наблюдение.
Сочетание генетической патологии с лимфангиомой средостения не отмечено [7].
Дифференциальную диагностику лимфангиомы средостения следует проводить с врожденной диафрагмальной грыжей, тератомой, тимомой, нейрогенной опухолью, гемангиомой, легочной секвестрацией, бронхогенными кистами, кистозно-аденоматозным пороком развития легких [5, 27–29].
Установлено, что пренатальная диагностика лимфангиом средостения становится возможной во II триместре беременности. К основным эхографическим признакам этой патологии относят выявление в грудной клетке асимметрично расположенного тонкостенного образования, состоящего из множества различного диаметра кист, заполненных однородным анэхогенным содержимым и разделенных тонкими перегородками с отсутствием в них кровотока [5, 10, 27–29].
В зависимости от локализации выделяют лимфангиомы переднего и заднего средостения, из них наиболее часто встречаются лимфангиомы переднего средостения [5, 28].
Размеры данного образования крайне вариабельны и составляют от нескольких миллиметров до нескольких сантиметров. В большинстве случаев рост лимфангиомы медленный, выраженное увеличение ее размеров может быть следствием кровоизлияния или инфекции [5].
Большие размеры образования могут приводить к легочной гипоплазии, смещению сердца и средостения, сдавлению крупных сосудов, это является причиной развития асцита и водянки плода [5, 27].
В постнатальном периоде производится хирургическое удаление лимфангиомы после дополнительного обследования, однако в некоторых случаях при этом могут возникать технические сложности, поскольку лимфангиома средостения часто окружает крупные сосуды и дыхательные пути [5, 7, 27, 28].
Прогноз при данном заболевании зависит от локализации, размеров образования и наличия сочетанных аномалий [28].
Учитывая то, что в литературе приведены лишь единичные сообщения о лимфангиомах различной локализации, мы решили представить собственные данные.
Материалы и методы
Нами проведен анализ 54 наблюдений лимфангиомы плода различной локализации, выявленных на базе отделения функциональной диагностики Центра за период с 2006 по 2019 гг. За указанный период нами были опубликованы 4 работы, посвященные различной локализации лимфангиом [30–33].
При выполнении настоящей работы мы первоначально для установления срока беременности, массы и роста плода измеряли бипариетальный и лобно-затылочный размеры его головы, межполушарный размер мозжечка, средний размер живота, средний поперечный размер сердца, длину плеча, бедра, большеберцовой кости и стопы. Затем определяли локализацию и размер плаценты. Особое внимание обращали на состояние внутренних органов и других анатомических образований плода.
При обнаружении объемного образования у плода определяли его локализацию и размеры, оценивали внутреннюю структуру.
Проводили также динамическое ультразвуковое наблюдение за состоянием плода и изменениями размеров и структуры образования в течение всего оставшегося периода гестации и после рождения ребенка.
Ультразвуковое исследование осуществляли при помощи прибора Siemens SONOLINE Elegra (Германия) и Alfa 10, Aloka (Япония) с использованием трансабдоминального конвексного датчика частотой 3,5 МГц и линейного датчика с частотой 7,5 МГц. Наряду с этим у всех пациенток проводились допплерография и кардиотокография с использованием полностью автоматизированного кардиомонитора («Анализатора состояния плода») фирмы «Уникос» (Москва).
Результаты
Под нашим наблюдением находились 54 плода с лимфангиомой различной локализации.
После рождения 49 новорожденных для дальнейшего обследования и лечения поступили в отделение хирургии новорожденных. Оперативное лечение проведено у 33 детей (67%), из них у 3 – методом склеротерапии, комбинированное лечение: операция и склеротерапия – у 1.
Прерывание беременности по медицинским показаниям проведено в 3 наблюдениях, интранатальная гибель плода произошла в 1, полное исчезновение выявляемого ранее образования отмечено также в 1 наблюдении.
Диагноз «лимфангиома плода» был правильно поставлен всем женщинам в сроках 18–37 недель при первом же обращении в Центр за консультативной помощью.
При эхографии лимфангиома выявлялась как объемное жидкостное образование с множественными различной толщины перегородками без зон васкуляризации.
По локализации наиболее часто встречались лимфангиома шеи – в 28 наблюдениях (51,8%), абдоминальная – в 6 (11,1%), средостения – в 6 (11,1%), подмышечной области – в 5 (9,3%), бедра и голени – в 5 (9,3%), грудной клетки и передней брюшной стенки – в 3 (5,6%), множественные гемлимфангиомы (синдром Протея) – в 1 (1,9%).
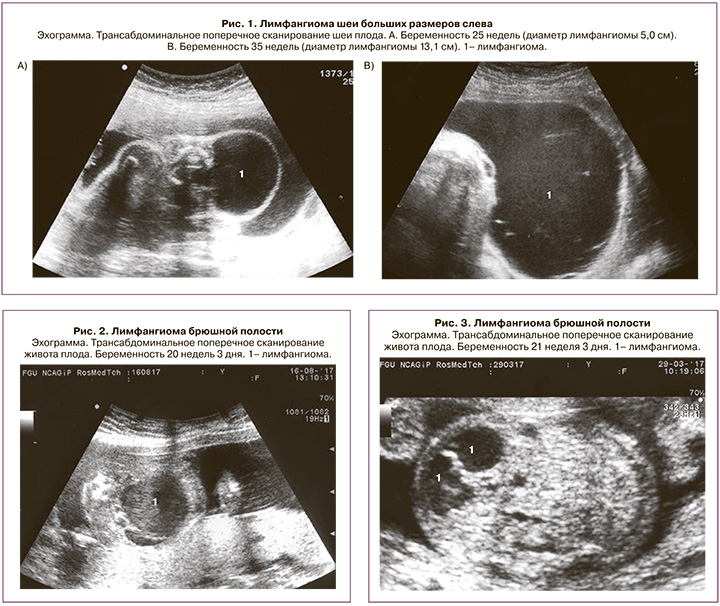
Как отмечено выше, лимфангиома шеи составила около половины всех наблюдений – 28 (51,8%). Из них в 2 (7,1%) наблюдениях образования распространялись также на подчелюстную область, в 3 (10,7%) – на голову, в 1 (3,6%) – в подмышечную область, в 3 (10,7%) – на грудную стенку и в 1 (3,6%) – в средостение. У 2 новорожденных лимфангиома шеи была гигантского размера и достигала в диаметре более 10 см (рис. 1). В одном из этих наблюдений у ребенка диагностирована также врожденная анемия вследствие пренатального массивного кровоизлияния в кистозные полости. Все новорожденные поступили в отделение хирургии новорожденных, где было проведено дополнительное обследование.
Хирургическое вмешательство выполняли при гигантских и больших размерах лимфангиомы шеи – 23 случая (82%); среди них у 2 пациентов – методом склеротерапии, в одном наблюдении – комбинированным способом. Косметические и функциональные результаты лечения – благоприятные по данным катамнестического наблюдения. Небольшие размеры образований у 5 новорожденных позволили избежать хирургического вмешательства в раннем возрасте, дети направлены на плановые осмотры в профильные учреждения.
Под нашим наблюдением находились 6 пациентов с абдоминальной лимфангиомой (11,1%). Срок беременности на момент выявления варьировал от 20 до 37 недель. Из них в 4 наблюдениях произошли срочные роды, дети поступили в отделение хирургии новорожденных, где всем было проведено оперативное лечение с благоприятным исходом; при этом в одном из наблюдений лечение проведено лапароскопическим доступом. Прерывание беременности по медицинским показаниям проведено в сроке 20 недель беременности у одной пациентки (диаметр абдоминальной лимфангиомы составил 3,7 см; также у плода была диагностирована кистозная дисплазия левой почки) (рис. 2). В одном случае в сроке 25 недель произошло спонтанное исчезновение ранее выявляемого образования (в сроке 21 неделя диаметр составлял 2,4 см) (рис. 3).
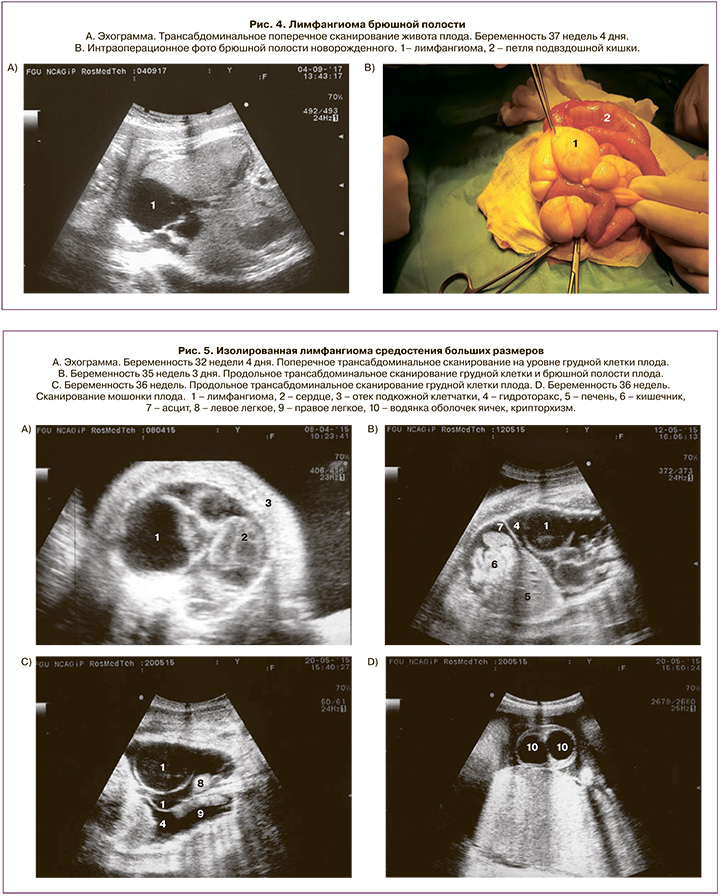
Абдоминальная лимфангиома больших размеров выявлена у плода в сроке 37 недель беременности. Опухоль определялась в нижних отделах брюшной полости плода, ее средний диаметр составил 6 см (рис. 4). Беременность закончилась самопроизвольными срочными родами. На 13-е сутки жизни новорожденному было выполнено хирургическое лечение. Интраоперационно установлено, что опухоль располагалась в основании брыжейки подвздошной кишки, диаметр образования составил 8,5 см, подвздошная кишка находилась в состоянии заворота. Выполнена резекция лимфангиомы с несущей петлей подвздошной кишки, наложен прямой илео-илеоанастомоз. Ребенок выписан домой в удовлетворительном состоянии на 16-е послеоперационные сутки.
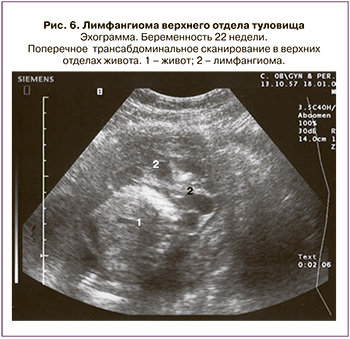
Лимфангиома средостения выявлена у 6 плодов (11,1%). Из них в 5 наблюдениях роды закончились своевременно, дети поступили в отделение детской хирургии. Из них у 2 новорожденных проведено оперативное вмешательство, в обоих этих случаях оно выполнено торакоскопическим доступом, с благоприятным исходом.
В одном наблюдении при лимфангиоме больших размеров произошла интранатальная гибель плода. В этом случае диагноз был установлен при сроке 32 недели беременности. На сканограммах плода в грудной клетке слева определялось многокамерное жидкостное анэхогенное образование с тонкими стенками без кровотока, размеры наибольших камер составляли 6,0×4,9×5,7 см и 2,4×2,7×2,8 см. Сердце было смещено вправо. Легкие резко гипоплазированы, размеры правого легкого составили 2,0×1,2×1,5 см, левого – 3,1×1,4×1,9 см. У плода также отмечались гидроторакс, незначительно выраженный асцит, отек подкожножировой клетчатки туловища, уменьшение размеров желудка (рис. 5). Данной пациентке осуществлялось динамическое ультразвуковое исследование в сроках 34, 35 и 36 недель беременности. Эхографическая картина и размеры лимфангиомы оставались без изменений. Начиная с 35 недель беременности, наряду с вышеуказанными изменениями, выявлены кардиомегалия, отек головы, подкожножировой клетчатки туловища и конечностей, водянка оболочек яичек, крипторхизм. По данным допплерографии, начиная с 36 недель беременности отмечалось нарушение фето-плацентарного кровотока, маточно-плацентарный кровоток был не изменен. По данным автоматизированной антенатальной кардиотокографии, проведенной в сроке 36 недель 2 дня беременности, показатель состояния плода составил 4,0, что соответствовало критическому состоянию. Сразу после проведения кардиотокографии произведено родоразрешение путем операции кесарева сечения. Родился мертвый недоношенный мальчик массой 5094 г и ростом 53 см. Результаты ультразвукового исследования полностью совпали с патологоанатомическим диагнозом.
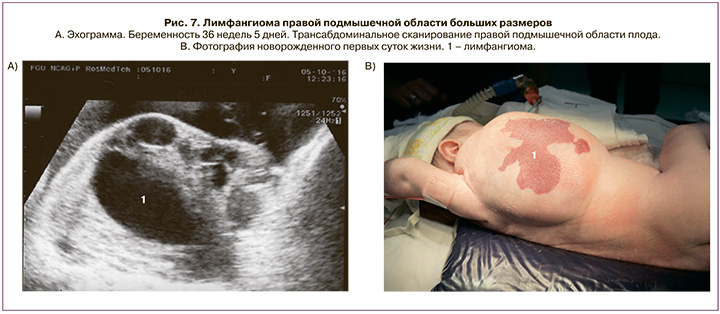
 Лимфангиома подмышечной области диагностирована у 5 плодов (9,3%) в сроках от 22 до 37 недель беременности. Беременность завершилась срочными родами в 4 случаях, дети поступили в отделение хирургии новорожденных, где было проведено хирургическое лечение с благоприятным исходом. В 1 наблюдении в сроке 22 недели было проведено прерывание беременности (лимфангиома располагалась в верхнем отделе грудной клетки и распространялась на правую руку и живот плода; ее диаметр составил 6,1 см, также была выявлена лимфангиома брюшной полости диаметром 2,0 см) (рис. 6).
Лимфангиома подмышечной области диагностирована у 5 плодов (9,3%) в сроках от 22 до 37 недель беременности. Беременность завершилась срочными родами в 4 случаях, дети поступили в отделение хирургии новорожденных, где было проведено хирургическое лечение с благоприятным исходом. В 1 наблюдении в сроке 22 недели было проведено прерывание беременности (лимфангиома располагалась в верхнем отделе грудной клетки и распространялась на правую руку и живот плода; ее диаметр составил 6,1 см, также была выявлена лимфангиома брюшной полости диаметром 2,0 см) (рис. 6).
Под нашим наблюдением находились две пациентки с лимфангиомой плода подмышечной области гигантских размеров при сроке беременности 37 и 31 недели. При эхографии в первом случае из правой подмышечной области плода исходило объемное жидкостное образование с множественными перегородками различной толщины. Его верхний полюс располагался под шеей, нижний доходил до поясничной области. Размеры образования составили 10,1×8,3×8,4 см (объем 368,3 см3) (рис. 7). Во втором случае лимфангиома определялась как анэхогенное образование с единичными и тонкими перегородками размерами 6,0×6,0×3,3 см (объем 62,1 см3) и располагалась справа от начала шейного отдела до нижнего края грудной клетки (рис. 8). В сроке 39 недель было отмечено резкое увеличение размеров образования, они составили 11,4×9,4×9,4 см (объем 526,8 см3).
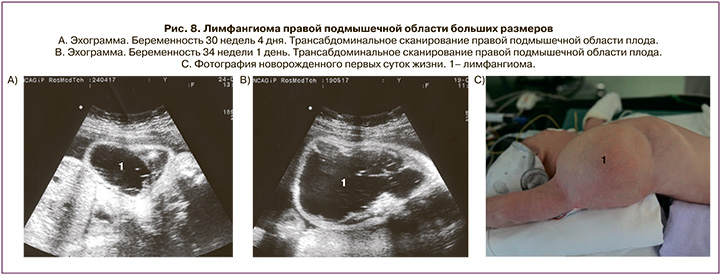
Беременность в обоих случаях закончилась срочными оперативными родами путем операции кесарева сечения. После рождения для дальнейшего обследования и лечения новорожденные поступили в отделение хирургии и реанимации новорожденных.
Радикальное удаление лимфангиомы правой подмышечной области новорожденным было проведено соответственно на 18-е и 11-е сутки их жизни.
Послеоперационный период в обоих случаях протекал без осложнений. Дети на 15-е послеоперационные сутки (33-и сутки жизни) и 13-е послеоперационные сутки (24-е сутки жизни) соответственно выписаны домой в удовлетворительном состоянии.
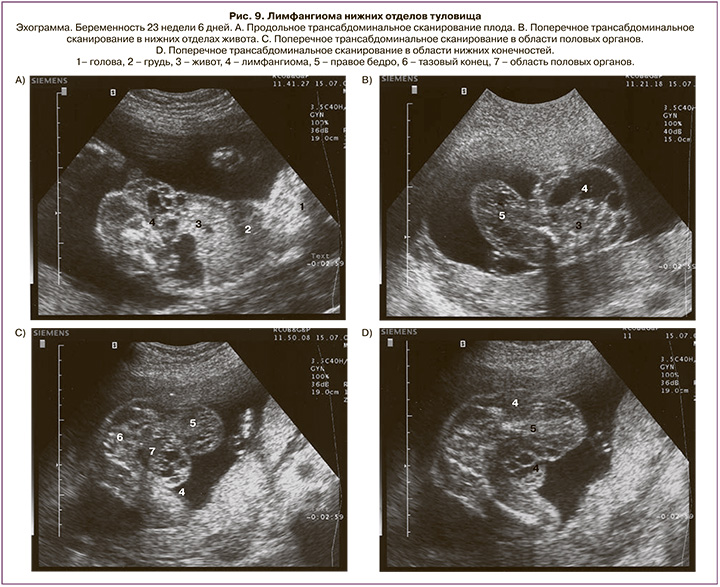
Лимфангиома бедра и голени выявлена у 5 плодов (9,3%) в сроках от 21 до 34 недель. Беременность завершилась срочными родами в 4 наблюдениях. Прерывание беременности выполнено в одном случае при сроке 22 недели беременности (лимфангиома занимала нижние отделы живота и малого таза, распространялась на промежность, половые органы и правое бедро, ее диаметр составил 6,3 см) (рис. 9).
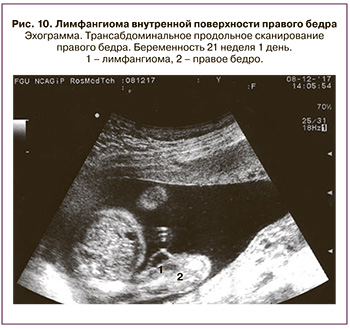 Лимфангиома бедра малых размеров выявлена нами в одном наблюдении в сроке 21 неделя. В области внутренней поверхности правого бедра определялось жидкостное однокамерное образование диаметром 1,2 см. К концу беременности диаметр лимфангиомы составил 4,0 см. Беременность завершилась срочными родами с благоприятным исходом лечения (рис. 10).
Лимфангиома бедра малых размеров выявлена нами в одном наблюдении в сроке 21 неделя. В области внутренней поверхности правого бедра определялось жидкостное однокамерное образование диаметром 1,2 см. К концу беременности диаметр лимфангиомы составил 4,0 см. Беременность завершилась срочными родами с благоприятным исходом лечения (рис. 10).
Обсуждение
Лимфангиома – редкий врожденный порок развития, характеризующийся разрастанием лимфатических сосудов, заполненных хилусом; вследствие их полной или частичной обструкции происходит формирование кистозных полостей. Согласно данным литературы, лимфангиома встречается в 1 случае на 6000 новорожденных [1–6].
В основу данного исследования легли результаты исследования 54 плодов с лимфангиомой различной локализации за 14-летний период.
При эхографии в пренатальном периоде диагностика лимфангиомы основана на выявлении гипоэхогенного кистозного многокамерного образования с тонкими перегородками и отсутствием кровотока при допплеровском картировании. Размеры конгломерата кист могут варьировать от нескольких миллиметров до гигантских.
Согласно данным литературных источников, наиболее часто лимфангиома локализуется в области шеи – 75%, подмышечной области – 20%, в редких случаях в брюшной полости и ретроперитонеально, в конечностях и костях, в средостении – по 1–2%.
Расположение лимфангиомы в наших наблюдениях несколько отличалось; так, наиболее часто встречались лимфангиомы шеи – 51,8%, абдоминальные – 11,1%, средостения – 11,1%, подмышечной области – 9,3%, бедра и голени – 9,3%, грудной клетки и передней брюшной стенки – 5,6%, множественные гемлимфангиомы (синдром Протея) – 1,9%.
Беременность завершилась срочными родами в 50 наблюдениях, из них 49 детей для дальнейшего обследования и лечения поступили в отделение хирургии новорожденных, у 1 плода внутриутробно произошло полное исчезновение определяемого ранее образования. Прерывание беременности по медицинским показаниям проведено в 3 наблюдениях. Интранатальная гибель плода отмечена лишь в 1 случае.
Оперативное лечение проведено у 33 детей (67%), во всех наблюдениях с благоприятным исходом.
Ряд авторов полагают, что в большинстве случаев лимфангиомы плода, которые впервые диагностируют во II триместре беременности, не сочетаются с хромосомными аномалиями, однако небольшое количество наблюдений не позволяет полностью исключить такой возможности. Во всех наших наблюдениях патология была диагностирована после 18 недель беременности, и ни в одном из этих случаев хромосомной патологии отмечено не было.
Заключение
Проведенные нами исследования свидетельствуют, что прогноз при лимфангиоме зависит от наличия сочетанных пороков развития и сопутствующей хромосомной патологии. При их отсутствии исход заболевания в целом благоприятный.



