Введение
Преэклампсия (ПЭ) – одна из основных причин материнской смертности. Осложнениями ПЭ могут быть эклампсия, отек легких, неврологические нарушения, антенатальная гибель плода, преждевременная отслойка нормально расположенной плаценты, острое повреждение почек, HELLP-синдром. Ошибки при постановке диагноза довольно распространены. И хотя ПЭ рассматривается как заболевание, «ассоциированное с плацентой», диагноз нередко ставится и женщинам, у которых заболевание проявляется после родов или их состояние значительно ухудшается после родоразрешения. Хотя, по логике, мы вправе ожидать положительную динамику и регресс симптоматики после родоразрешения. Конечно же, легко избавиться от сомнений заключением об «атипичном течении преэклампсии», «несвоевременном родоразрешении», или «ошибках на этапе наблюдения в женской консультации», хотя эти моменты также имеют место быть. Коварной беспечностью считаем оценку HELLP-синдрома как «неуточненной ПЭ». Гетерогенность клинических проявлений ПЭ позволяет предположить, что это не одно заболевание [1]. Высказываются вполне, на наш взгляд, обоснованные предположения, будто все эти осложнения беременности и родов являются звеньями одной цепи, объединенными в смертельное ожерелье тромботической микроангиопатии.
Типичный набор признаков тромботической микроангиопатии (ТМА): тромбоцитопения, микроангиопатическая гемолитическая анемия (МАГА) и полиорганная недостаточность (церебральная, почечная и т.д.), может быть обусловлен комплексом причин, как первичных (генетически обусловленных), так и вторичных (сепсис, инфекция, ПЭ, кровопотеря, отслойка плаценты, травма) [2–8].
Для правильной постановки диагноза и назначения корректного лечения при подозрении на развитие у пациентки с ПЭ клинической и лабораторной картины HELLP-синдрома следует включать в круг дифференциально-диагностического поиска ТМА, под которой помимо собственно морфологических признаков в сосудах микроциркуляторного русла (отек эндотелия, мезангиолизис, повреждение гликокаликса, наличие тромбов) понимают наличие следующего симптомокомплекса: тромбоцитопения, микроангиопатическая гемолитическая анемия и поражение органа или системы органов, преимущественно острого повреждения почек (ОПП). Не случайно в последних клинических рекомендациях МЗ РФ «Гипертензивные расстройства во время беременности, в родах и послеродовом периоде. Преэклампсия. Эклампсия. Клинические рекомендации (Протокол лечения)» HELLP-синдром относят к ТМА [9].
Одной из наиболее вероятной формой ТМА у женщин с тяжелой ПЭ может быть атипичный гемолитико-уремический синдром (аГУС), который является результатом повреждения эндотелия из-за неконтролируемой активации комплемента и чрезмерного выделения ангиогенных факторов, что также составляет важнейшее звено патогенеза при ПЭ [10]. В наших работах, опубликованный ранее, мы сообщали об увеличении ангиогенных факторов у беременных с ПЭ, хотя и не связывали с неконтролируемой активацией комплемента [11, 12].
В структуре акушерского ОПП ПЭ и ее осложнения (HELLP-синдром) занимают ведущее положение [7, 13].
В противоположность этому при некоторых формах ТМА в акушерстве, например при аГУС, беременность и ее осложнения могут служить лишь пусковым механизмом для развития ОПП [5–8].
Для развития аГУС необходимо взаимодействие генетических аномалий в системе комплемента [14] с факторами внешней среды, одним из таких факторов могут служить беременность и ее осложнения [10]. Не следует также забывать, что аГУС может быть спровоцирован приемом различных медикаментов и список их растет [15].
Важно отметить, что, согласно данным французского регистра, каждая пятая пациентка с аГУС – акушерская, при этом развитие аГУС в большинстве случаев пришлось на послеродовый период (79% случаев) и сопровождалось повреждением почек: в 81% случаев пациенты нуждались в диализе в острой фазе болезни и в 62% случаев у пациенток развивалась терминальная почечная недостаточность менее чем за месяц после перенесенного эпизода аГУС [16, 17].
По данным российских авторов, акушерский аГУС развивается в послеродовый период лишь в 35% случаев, оставшиеся 65% приходились на второй и третий триместры. Особенностью акушерского аГУС является высокая частота полиорганной недостаточности вследствие быстрой генерализации микроангиопатического процесса (76% случаев по сравнению с 6% в общей популяции) [18].
Объяснить причину более частой манифестации аГУСу акушерских пациенток помогает тот факт, что система комплемента активируется во время беременности в норме, у пациенток с дефектами системы регулирования альтернативного пути комплемента беременность может приводить к непрекращающейся активации комплемента, поэтому аГУС может манифестировать у пациенток с дефектами регуляции во время беременности даже при умеренном дефекте [19–21].
При ранней манифестации акушерского аГУС (во втором триместре), по мнению российских специалистов, важную роль помимо собственно беременности играют дополнительные провоцирующие факторы – комплемент-активирующие состояния (например, диарея, инфекция). При этом неспецифичность клинической картины и «маскировка» аГУС затрудняют проведение дифференциальной диагностики.
Основой для постановки диагноза аГУС служит исключение других форм ТМА, подтвержденных лабораторными данными [22, 23]. К таким формам относятся тромботическая тромбоцитопеническая пурпура (ТТП) – исключается при уровне ADAMTS-13 более 10%, а также такие состояния, как сепсис, STEC-ГУС, СКВ, АФС.
Единственным препаратом, ингибирующим систему комплемента, является экулизумаб – человеческие моноклональные антитела к С5-фракции комплемента. Аналоговых замен и альтернатив препарат не имеет, т.к. это единственный в мире представитель терапевтической группы ингибиторов комплемента, предназначенный для патогенетической терапии аГУС [24–26].
Несвоевременная постановка диагноза аГУС и как следствие – отсроченное начало лечения, направленного на блокирование активности терминального компонента альтернативного пути комплемента, приводит к смерти 30% пациенток [18].
Трансфузия тромбоцитов противопоказана, т.к. может усилить проявления ТМА, провоцируя новые эпизоды микротромбообразования [27].
Клинический случай
Представляем описание клинического случая аГУС. Беременная П. 22 лет 18.10.2016 на машине скорой помощи доставлена в родильный дом г. Норильска с кровянистыми выделениями из половых путей на фоне повышенного АД до 160/100 мм рт.ст.
Из анамнеза известно, что это третья беременность, первая в 17, вторая в 18 лет, во время второй беременности зафиксирован подъем АД до 180/100 мм рт.ст.; больная получала гипотензивную терапию. Обе беременности закончились консервативными родами в доношенный срок. Во время наблюдения настоящей беременности в женской консультации пациентка с 29 недель получала гипотензивную терапию нифедипином по поводу гестационной артериальной гипертензии. Также принимала пероральные препараты железа в связи с железодефицитной анемией.
При поступлении больная осмотрена и обследована, выставлен диагноз: беременность III в 32 недели, тяжелая ПЭ, преждевременная отслойка нормально расположенной плаценты. Лабораторно гемоглобин 105 г/л, тромбоциты 118×10/9, АСТ 40 ЕД/л, АЛТ 65 ЕД/л, протеинурия 3,58 г/сут. По жизненным показаниям, больная экстренно взята в операционную, где под общей анестезией выполнена операция: кесарево сечение, перевязка маточных сосудов с обеих сторон, компрессионные швы на матку. Околоплодные воды были зелеными с примесью крови, плацента располагалась по задней стенке с переходом на дно, гиперплазирована с участками отслойки. Общая кровопотеря составила 900 мл: 300 мл до операции, 600 мл после.
В раннем послеоперационном периоде, через 5 часов после операции, у больной отмечена отрицательная динамика в виде тромбоцитопении до 74×109/л, при этом гемоглобин – 75 г/л, повышение уровня трансаминаз – АСТ 115 ЕД/л, АЛТ 105 ЕД/л, ЛДГ до 4000 ЕД/л, белок в моче 3,58 г/сут. Сохранялась артериальная гипертензия до 160/90 мм рт.ст. Ситуация была расценена как развитие HELLP-синдрома. В качестве терапии были назначены дискретный плазмаферез в объеме 900 мл, метилпреднизолон 500 мг в сутки, гипотензивная терапия.
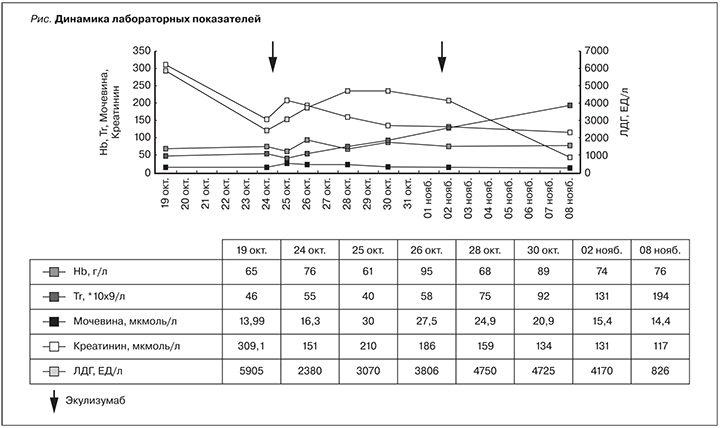
На следующие сутки состояние оставалось тяжелым с отрицательной лабораторной динамикой. На фоне внутрисосудистого гемолиза, ЛДГ – 5905 ЕД/л, сохраняющейся тромбоцитопении 46×109/л присоединилось острое повреждение почек (ОПП) с нарастанием азотемии – мочевина 13,99 мкмоль/л, креатинин 309,1 мкмоль/л, темп диуреза составил 0,5–0,75 мл/кг/ч. Усугубилась анемия до 65 г/л без признаков кровотечения. Больной по жизненным показаниям проведена трансфузия эритроцитарной массы в объеме 600 мл, СЗП 600 мл, тромбоцитарной массы 6 доз. Проведенная терапия несколько стабилизировала состояние пациентки: концентрация гемоглобин возросла до 88 г/л, тромбоциты – до 76×109/л, ЛДГ снизился до 2622 ЕД/л. Положительная динамика оказалась кратковременной. В течение суток тромбоциты снизились до 62×109/л, наросла азотемия – креатинин 409 мкмоль/л, мочевина 15,1 мкмоль/л; темп диуреза составил 0,5 мл/кг/ч, что соответствует 3-й стадии по международной классификации AKIN (Acute Kidney Injury Network). В дальнейшем отмечено нарастание дыхательной недостаточности в виде одышки и тахипноэ – 25/мин, снижение сатурации до 90% на фоне инсуфляции увлажненного кислорода. Было принято решение о переводе больной на ИВЛ. Принимая во внимание отрицательную динамику и возможную необходимость проведения заместительной почечной терапии, принято решение о транспортировке больной в учреждение 3-го уровня «Красноярский краевой клинический центр охраны материнства и детства» (КККЦОМД).
22.10.2016 в 03.35 больная в тяжелом состоянии была доставлена в КККЦОМД с диагнозом: 4-е сутки после экстренной операции, кесарево сечение в сроке 32 недели, по поводу преждевременной отслойки нормально расположенной плаценты. Тяжелая преэклампсия, HELLP-синдром, синдром полиорганной недостаточности. Анемия II степени. Лабораторно: гемоглобин 87 г/л, тромбоциты 66×109/л, общий белок 47 г/л, альбумин 28 г/л, ЛДГ 3170 ЕД/л, мочевина 28,8 мкмоль/л, креатинин 410 мкмоль/л, свободный гемоглобин 0,2 Г/л (норма до 0,1), шизоциты 2%. Впервые фиксировано увеличение амилазы до 202 ЕД/л, нормальные показатели коагулограммы.
Экстренно был созван консилиум, на котором было определено, что у пациентки системная ТМА, проявившаяся гемолитической анемией, выраженной тромбоцитопенией, с признаками поражения почек, легких, печени, поджелудочной железы, генерализованного отечного синдрома (гидроторакс, полостные отеки), артериальной гипертонии. Принимая во внимание развитие критической ситуации, практически сразу после оперативного родороазрешения по поводу тяжелой ПЭ, ПОНРП наиболее вероятным диагнозом представлялась ТМА. Дифференциальная диагностика между аГУС, КАФС и ТТП была начата с определения уровня ADAMTS-13; антитела к В2-глипопротеиду, волчаночного антикоагулянта, гомоцистеина; пробы Кумбса (для уточнения характера анемии). С учетом развития тяжелой полиорганной недостаточности в качестве патогенетической терапии был назначен сеанс плазмообмена (ПО) с объемом эксфузии и возмещения плазмы 40 мл/кг. Сразу после ПО в качестве заместительной почечной терапии начат сеанс продленной веновенозной гемофильтрации (ВВГФ) с конвективной дозой 35 мл/кг/ч. Продолжена пульс-терапия гормонами в дозе 1000 мг метилпреднизолона в сутки в течение трех дней, добавлены низкомолекулярные гепарины.
После получения отрицательных результатов анализа на АФС был исключен КАФС, ADAMTS-13–53% исключал ТТП, реакция Кумбса была отрицательной. Путем исключения других форм ТМА был выставлен диагноз аГУС. Продолжена плазмотерапия в виде 2 сеансов ПО, в течение 3 суток проводилась веновенозная гемофильтрация. 25.10.2016 выполнены релапаротомия, эвакуация и дренирование подапоневротической гематомы в объеме 600 мл. На этом фоне отмечена отрицательная динамика в виде прогрессирования МАГА, СПОН, особенно ОРДСВ. Динамика клинико-лабораторных данных представлена на рисунке.
С учетом неэффективности плазмотерапии, критического состояния пациентки 26.10.2016 было принято решение начать терапию экулизумабом по схеме: в режиме индукции в виде в/в инфузии 900 мг 1 раз в неделю в течение 4 недель, далее – 1200 мг на 5-й неделе и затем поддерживающая терапия 1200 мг 1 раз каждые последующие две недели. Для профилактики менингококковой инфекции начата терапия антибиотиком широкого спектра действия – Цефтриаксон 2,0 в сутки, т.к. на тот момент не было противоменингококковой вакцины. На 2-е сутки от начала терапии экулизумабом больная переведена на спонтанное дыхание, медленно регрессировали признаки МАГА, длительно купировались проявления ПОН – острого панкреатита, ОПП – при сохраненном темпе диуреза 0,75–1,0 мл/кг/ч (см. рисунок).
На 18-е сутки по решению консилиума пациентка в удовлетворительном состоянии была переведена в Краевую клиническую больницу г. Красноярска в отделение нефрологии с положительной динамикой: уменьшение внутрисосудистого гемолиза – ЛДГ 688 ЕД/л, свободный гемоглобин 0,1 Г/л, шизоциты 0,5%, восстановление количества тромбоцитов до 218×109/л, ОПП в стадии разрешения. Всего в КККЦОМД введено 2 дозы экулизумаба по 900 мг, после чего пациентке проведения сеансов ПО и гемофильтрации более не потребовалось.
Обсуждение
Представленный клинический случай указывает на сложность диагностики аГУС и тяжесть течения этого заболевания у беременных. Пусковым фактором развития заболевания послужила тяжелая ПЭ. Клиническая картина заболевания полностью напоминала развитие HELLP-синдрома. Вместе с тем сразу после родоразрешения появились нехарактерные симптомы: увеличились показатели МАГА, появились и прогрессировали симптомы ПОН, прежде всего ОПП до 3-й стадии по Международной классификации AKIN, что потребовало проведения заместительной почечной терапии. Диагноз аГУС был установлен путем исключения неимунного характера гемолиза, КАФСа и ТТП.
Вместе с тем состояние больной прогрессивно ухудшалось и приблизилось к критическому, было принято решение о транспортировке в ЛПУ 3-го уровня. Ожидаемого эффекта от заместительной почечной терапии и плазмообмена не получено, сохранялась и усугублялась гемолитическая анемия, нарастала полиорганная недостаточность в виде острого повреждения почек, острого панкретита, развился репираторный дистресс-синдром взрослых (РДСВ). После окончания сеансов гемофильтрации вновь нарастала азотемия. Это указывало на тяжесть течения и возможного неблагоприятного исхода заболевания. Отсутствие стойкого эффекта от проводимой плазмотерапии и гемофильтрации, развитие РДСВ стали абсолютным показанием к назначению экулизумаба, что позволило избежать летального исхода, сохранить функцию почек, уменьшить проявления органной дисфункции.
Атипичный гемолитико-уремический синдром – весьма редкое заболевание, в Красноярском крае зафиксирован первый случай у беременной.
Представленный клинический случай знакомит врачей, занимающихся лечением беременных женщин в критическом состоянии, еще с одним тяжелым заболеванием, сложностями его диагностики, тяжестью течения и исходом. Осведомленность врачей о симптомах заболевания, быстрая и своевременная диагностика позволят вовремя начать патогенетическую терапию и избежать тяжелых последствий для матери и плода.
В заключение хотим привести основные выводы, сделанные на Форуме экспертов, прошедшем в Санкт-Петербурге [28]:
- Преэклампсия и HELLP-синдром являются специфическими, ассоциированными с беременностью формами ТМА. Всем пациенткам, госпитализированным с диагнозом ПЭ и/или HELLP-синдром, необходимо до родоразрешения исследовать лабораторные маркеры ТМА в полном объеме (шизоциты, ЛДГ, гаптоглобин, число тромбоцитов), а также определять уровень креатинина сыворотки.
- Подозрение на акушерскую ТМА требует дифференциальной диагностики между аГУС, ТТП, ПЭ, HELLP-синдромом, КАФС, острой жировой печенью беременных для выбора тактики лечения. Акушерская ТМА – важная причина ОПП/ синдрома полиорганной недостаточности при беременности и после родов.
- Если у пациентки с установленным диагнозом HELLP-синдрома своевременно начатая адекватная терапия не приводит к его регрессу в течение 48–72 часов, следует трансформировать диагноз в аГУС.
- Женщинам, перенесшим акушерскую ТМА (ПЭ, HELLP-синдром), следует устанавливать диагноз аГУС и начинать терапию экулизумабом, если после родоразрешения ТМА персистирует, вследствие чего их состояние не улучшается или ухудшается.
- Возможна манифестация акушерского аГУС развернутыми признаками HELLP-синдрома. Напротив, ранний дебют аГУС может приводить к развитию ПЭ.
- Акушерский аГУС ассоциирован с высоким риском материнской и перинатальной смертности, неблагоприятным общим и почечным прогнозом.
- Акушерский аГУС – сложный диагноз и для его постановки и выработки тактики лечения необходимы междисциплинарный подход и содружественная работа акушеров-гинекологов, реаниматологов, нефрологов, гематологов.



