Введение
Высокодозная химиотерапия (ХТ) с последующей трансплантацией аутологичных гемопоэтических стволовых клеток (ауто-ТГСК) является одним из ключевых этапов лечения больных агрессивными лимфопролиферативными заболеваниями (ЛПЗ) из группы высокого риска в первой линии терапии, а также при рецидиве и рефрактерном течении заболевания [1–3].
По данным Европейского регистра трасплантации клеток крови и костного мозга (КМ), число трансплантаций на 2023 г. насчитывает более 700 тыс., что превышает число выполненных трансплантаций за 2021 и 2022 гг. Основным источником для ауто-ТГСК служили гемопоэтические стволовые клетки (ГСК) крови [4]. Наиболее частое использование ГСК крови в отличие от ГСК КМ обусловлено тем, что метод является неинвазивным и позволяет проводить мобилизацию ГСК в амбулаторных условиях. Помимо всего трансплантация ГСК крови, полученных путем лейкафереза, приводит к более быстрому их приживлению, восстановлению числа лейкоцитов и тромбоцитов [5, 6].
В широкой клинической практике для мобилизации ГСК применяют 2 разные стратегии: применение гранулоцитарных колониестимулирующих факторов (Г-КСФ) на «стабильном состоянии кроветворения» без ПХТ или применение Г-КСФ после ПХТ (ПХТ+Г-КСФ).
Согласно данным литературы, сочетанное применение цитостатиков и Г-КСФ повышает вероятность достижения целевого числа CD34+ клеток в крови. Однако при этом существует высокая вероятность длительной госпитализации из-за осложнений после ПХТ, необходимость частого клинико-лабораторного мониторинга, четко неопределенные сроки выполнения лейкаферезов и высокие риски развития инфекционных осложнений [7, 8]. Современной тенденцией является мобилизация ГСК на «стабильном состоянии кроветворения», преимуществом которой считается возможность проведения мобилизации ГСК в амбулаторных условиях, четко планируемые сроки выполнения лейкаферезов и низкие риски внутрибольничной инфекции.
Для мобилизации ГСК используют непегилированные (филграстим, ленограстим) и пегелированные формы Г-КСФ (пэгфилграстим). Непегелированные формы вызывают миелоидную гиперплазию и высвобождение CD34+ клеток в кровоток путем протеолитического расщепления молекул адгезии. Рекомендуемые дозы филграстима и ленограстима для мобилизации после ПХТ и на «стабильном состоянии кроветворения» составляют 10 мкг/кг/сут. подкожно в течение 5–7 дней [9, 10].
Особенностью пэгфилграстима (ПэгФ) является включение в состав молекулы филграстима полиэтиленгликоля с молекулярной массой 20 кДа, из-за чего время достижения максимальной концентрации увеличивается до 16–20 часов. В отличие от филграстима ПэгФ вводится однократно подкожно в стандартной дозе 6 мг, которая не перерасчитывается на массу тела больного [11–18].
В 2015 г. было опубликовано рандомизированное исследование J. Kuan, включившее 134 больных. Оценивали влияние времени введения ПэгФ и Г-КСФ на результаты мобилизации ГСК. Число CD34+ клеток в крови проводили на 8-й, 11-й день и далее при необходимости. Самая успешная мобилизация ГСК была при использовании ПэгФ в дозе 6 мг на 7-й день после циклофосфамида: 34 (70,8%) из 48 пациентов, введение филграстима на 3-й день: 28 (63,6%) из 44, ПэгФ на 3-й день: 20 (47,6%) из 42 (р=0,075) [19].
В исследовании N. Russell et al., включившем 90 больных лимфомами, по оценке эффективности и безопасности применения филграстима в дозе 5 мкг/кг/сут. и ПэгФ в дозе 6–12 мг/сут. для мобилизации ГСК продемонстрировано, что введение ПэгФ в дозе 12 мг (59%) не привело к увеличению эффективности мобилизации ГСК по сравнению с фиксированной дозой 6 мг (69%) [20].
Для улучшения результатов мобилизации CD34+ клеток в дополнение к Г-КСФ используется плериксафор – ингибитор рецептора CXCR4. Механизм действия основан на блокировании связи рецептора с его специ-фическим лигандом, фактором стромальных клеток SDF-1α, также известным как CXCL12. В результате разрыва этой связи возрастает лейкоцитоз и увеличивается число циркулирующих CD34+ клеток [21, 22]. Основным показанием к применению плериксафора в сочетании с Г-КСФ является повторная мобилизация после первой неудачной попытки сбора ГСК, однако высокая стоимость препарата ограничивает его широкое применение в реальной клинической практике.
Кроме известных ПэгФ в рутинную практику входят новые формы. Так, препарат эмпэгфилграстим (Экстимия®, БИОКАД), который является ковалентным конъюгатом филграстима с одной молекулой полиэтиленгликоля с молекулярной массой 30 кДа, с пролонгированным действием в результате снижения почечного клиренса, стимулирует продукцию нейтрофилов и их предшественников, которые выводят препарат из кровотока по мере достижения оптимальной концентрации абсолютного числа нейтрофилов в крови. Концентрация препарата уменьшается по мере увеличения концентрации нейтрофилов. Имеющиеся отечественные данные показывают его высокую эффективность и безопасность в качестве препарата для сокращения периода нейтропении [23]. Однако к настоящему времени нет данных, оценивающих эффективность и безопасность эмпэгфилгратима (Экстимия®, БИОКАД) для мобилизации ГСК, что и оказалось целью нашей работы.
Материал и методы
В исследование были включены 32 больных ЛПЗ, проходивших лечение в ФГБУ «НМИЦ гематологии» Минздрава РФ в период с октября 2022 по апрель 2023 г. Медиана возраста больных составила 40 (18–62) лет: 17 мужчин и 15 женщин. Характеристика пациентов представлена в табл. 1.
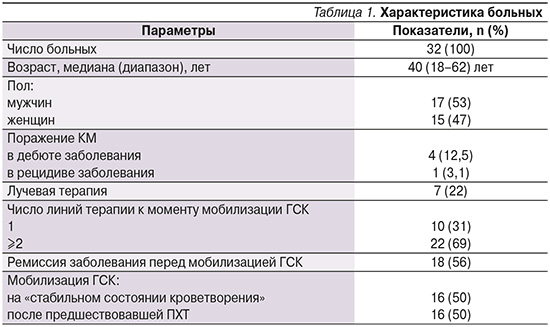
Предшествовавшая ПХТ перед мобилизацией ГСК была у 16 пациентов, у такого же числа больных мобилизация ГСК проводилась на «стабильном состоянии кроветворения» с применением только эмпэгфилграстима (Экстимия®, БИОКАД). Эмпэгфилграстим в дозе 7,5 мг однократно подкожно вводился в 2 режима: через 24 часа после окончания ПХТ и на «стабильном состоянии кроветворения».
Число лейкоцитов и CD34+ клеток после стимуляции эмпэгфилграстимом на «стабильном состоянии кроветворения» определяли в 4-й и 5-й дни, после предшествовавшей ПХТ – в 8-й и 9-й дни.
Мобилизация ГСК считалась эффективной при числе CD34+ клеток в лейкоконцентрате ≥2 млн×106/кг массы тела. Лейкаферез начинали, если число CD34+ превышало 10 клеток/мкл, а число лейкоцитов в ПК превышало 5×10⁹/л. Лейкаферез проводился на сепараторах непрерывного и прерывного тока крови, таких как Spectra Optia, MCS+ и Amicus Fresenius Kabi.
Исследование числа CD34+ в крови и в лейкоконцентрате выполнялось в лаборатории проточной цитометрии ФГБУ «НМИЦ гематологии» на проточном цитометре BD FACS Canto II.
Для анализа полученных данных использовали стандартные методы описательной статистики и частотного анализа. Для проверки гипотез о различиях распределений категориальных признаков в группах сравнения использовался анализ таблиц сопряженности. Для оценки значимости применяли двусторонний или левосторонний критерий Фишера.
Результаты
Эффективная мобилизация ГСК была у 20 (62,5%) из 32 больных: из них на «стабильном состоянии кроветворения» у 11 (68,75%) из 16, после предшествовавшей ПХТ у 9 (56,25%) из 16, (р=0,76).
В последующем для выявления факторов, оказывающих влияние на неудачную мобилизацию ГСК, больные были разделены на 2 группы: 1-я группа – пациенты с неэффективной мобилизацией ГСК, 2-я группа – пациенты с эффективной мобилизацией ГСК.
Группа пациентов с неэффективной мобилизацией ГСК была представлена 12 больными: 7 женщин и 5 мужчин. Медиана возраста составила 36,5 (24–62) лет. Из 12 больных терапию 1-й и 2-й линий получили 5 (42%) и 7 (58%) пациентов соответственно. Лучевая терапия (ЛТ) была проведена только одной пациентке с лимфомой Ходжкина (ЛХ). Распределение больных по диагнозам и режимам ПХТ представлены в табл. 2.
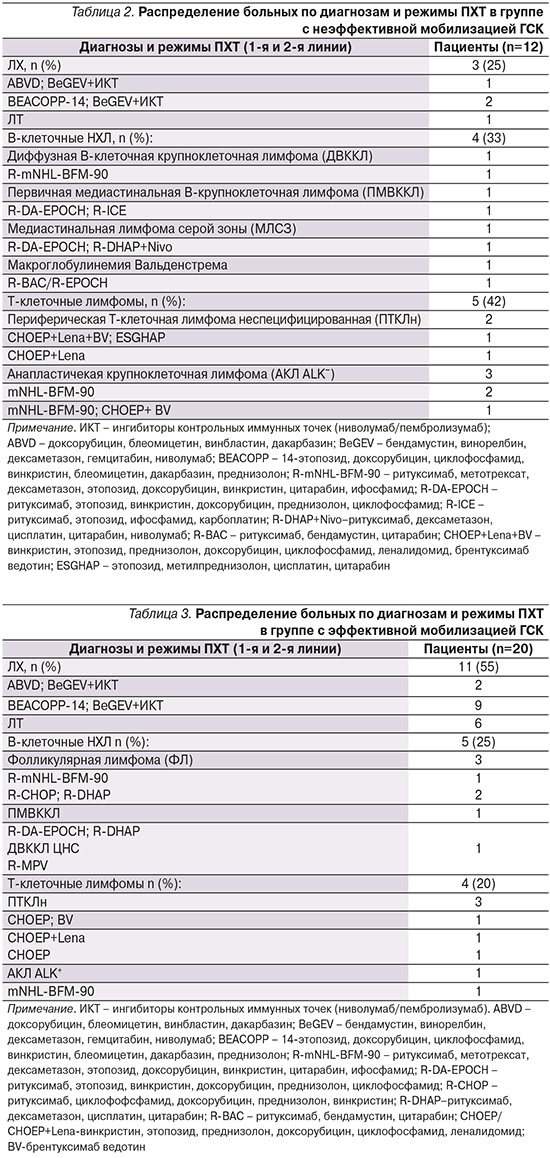
После первой неэффективной мобилизации ГСК 2 (17%) из 12 больных проводились дополнительные попытки с использованием Г-КСФ и плериксафора, однако это не привело к желаемому результату.
Группа пациентов с эффективной мобилизацией ГСК представлена 20 больными: 8 женщин и 12 мужчин. Медиана возраста составила 38 (18–62) лет. Терапию 1-й и 2-й линий получили 5 (25%) и 15 (75%) пациентов. Распределение больных по диагнозам и режимы ПХТ представлены в табл. 3.
В последующем мы исследовали различные факторы, которые могли быть ассоциированы с неэффективной мобилизацией ГСК (табл. 4).
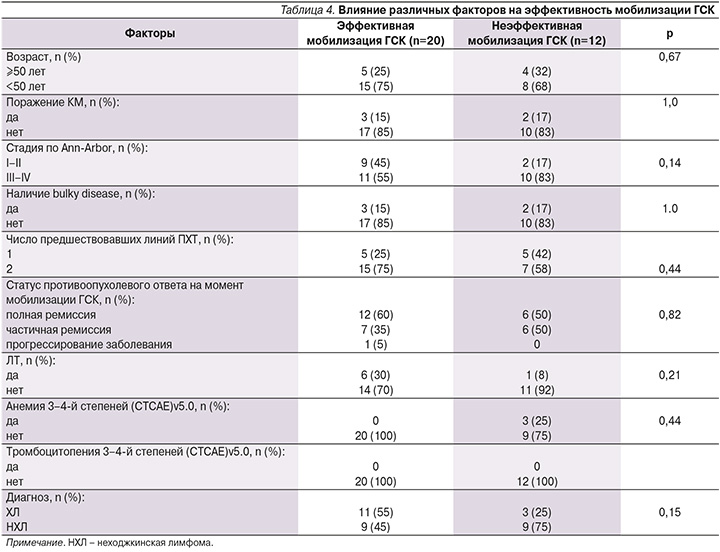
Ни один из анализируемых факторов не коррелировал с неэффективной мобилизацией ГСК. В группе с эффективной мобилизацией ГСК доля больных ЛХ оказалась выше (55%), чем у пациентов с неэффективной мобилизацией (25%) (p=0,15), несмотря на то что всем пациентам с ЛХ проводилась терапия 2-й линии, а у 7 (22%) пациентов использовали ЛТ. Можно предположить, что такая разница обусловлена более молодым возрастом пациентов в этой группе: медиана возраста – 29 (18–56) лет, и отсутствием индукционных миелосупрессивных режимов ПХТ.
В группе с неэффективной мобилизацией ГСК из-за отсутствия CD34+ клеток в крови лейкаферез не проводили. В группе с эффективной мобилизацией ГСК 1 лейкаферез выполнен 11 (55%) из 20 больных и 2 лейкафереза 9 (45%) из 20 больных (табл. 5).

Медиана мобилизированных ГСК составила 3,3×10⁶ млн/кг массы тела. У 19 (60%) из 32 больных все этапы мобилизации ГСК проводились в дневном стационаре. Ни у одного из больных побочных эффектов (оссалгия, миалгия, боли в спине, артралгия, лихорадка), связанных с введением препарата, не было отмечено.
Обсуждение
Мобилизация ГСК является не менее важным этапом, чем выполнение ауто-ТГСК больным лимфомами, ранним рецидивом и рефрактерным течением заболевания. На сегодняшний день продолжается поиск наиболее эффективных форм и режимов введения Г-КСФ с целью получения достаточного числа ГСК.
В нашем исследовании, в котором приняли участие 32 больных ЛПЗ, мы оценили эффективность и безопасность применения препарата эмпэгфилграстим для мобилизации ГСК как на «стабильном состоянии кроветворения», так и после ПХТ.
Такие факторы, как возраст, поражение КМ, стадия заболевания, наличие bulky disease, число предшествовавших линий ПХТ, статус противоопухолевого ответа, ЛТ, наличие анемии 3–4-й степеней, не оказали влияния на эффективность мобилизации ГСК.
Обращало на себя внимание, что у больных НХЛ мобилизация чаще была неэффективной, что может быть связано с использованием высокодозной ХТ и наличием леналидомида (5/42%). В группе пациентов с эффективной мобилизацией ГСК преобладали пациенты с ЛХ (55%).
Наши данные схожи с результатами, представленными в исследовании P. Wuchter, включившем 602 больных множественной миеломой и 238 пациентов с НХЛ, где было продемонстрировано, что такие факторы, как пол, возраст, масса тела и предшествовавшая ЛТ не оказали влияния на результаты мобилизации ГСК. Неудачная мобилизация ГСК была связана с числом предшествовавшей ПХТ и использованием в терапии мелфалана [24].
На сегодняшний день оценивается эффективность различных РМ и продемонстрировано, что использование комбинированного подхода циклофосфамид+Г-КСФ по сравнению с монотерапией Г-КСФ способствует получению большей концентрации CD34+ клеток в крови [5, 25]. Однако наряду с упомянутыми преимуществами при использовании комбинированного РМ повышается риск возникновения осложнений, что может потребовать госпитализации в круглосуточный стационар, постоянного наблюдения за пациентом и повышением риска внутрибольничной инфекции.
В нашей работе не было выявлено статистически достоверных различий в зависимости от РМ (на «стабильном состоянии кроветворения» или после предшествовавшей ПХТ). У всех пациентов на «стабильном состоянии кроветворения» мобилизация ГСК выполнена в условиях дневного стационара, без инфекционных осложнений и потребности госпитализации в круглосуточный стационар.
С целью увеличения эффективности мобилизации ГСК может быть использован плериксафор [11, 21]. Однако высокая стоимость последнего не позволяет широко применять его в реальной клинической практике. В нашей работе использование плериксафора в комбинации с Г-КСФ не привело к эффективной мобилизации ГСК у 2 (17%) из 12 больных.
Использование эмпэгфилграстима в качестве препарата для мобилизации ГСК показало одинаковую эффективность как на «стабильном состоянии кроветворения», так и после предшествовавшей ПХТ. Побочных эффектов (оссалгия, миалгия, боли в спине, артралгия, лихорадка), связанных с введением препарата, не отмечено.
Заключение
Проведенное исследование показало, что применение эмпэгфилграстима (Экстимия®, БИОКАД) в фиксированной дозе 7,5 мг привело к эффективной мобилизации ГСК у 62,5% больных ЛПЗ. Отмечено, что у больных ЛХ доля эффективных мобилизаций ГСК была выше, чем у больных НХЛ.
Финансирование. ФГБУ «НМИЦ гематологии» Минздрава РФ.
Вклад авторов. М.О. Багова, Я.К. Мангасарова – концепция и дизайн, написание текста. Все авторы – сбор и обработка материала. Ю.А. Чабаева, М.О. Багова – статистическая обработка данных. О.В. Марголин, Я.К. Мангасарова – редактирование.



