По определению Всемирной организации здравоохранения (ВОЗ), неблагоприятные лекарственные реакции (НЛР) представляют собой любой нежелательный ответ, наблюдаемый в организме человека, на препарат, принимаемый в обычно используемых дозах. Точные оценки истинных уровней распространенности НЛР в настоящее время отсутствуют. По данным, представленным в систематическом обзоре 2012 г., частота НЛР у детей, приводящих к госпитализации, колебалась от 0,4 до 10,3% [1]. Наиболее часто это были противоинфекционные и антиэпилептические препараты.
НРЛ принято классифицировать на типы, представленные в табл. 1: тип A (могут иметь место у любого пациента и, как правило, связаны с основным механизмом действия лекарств и их дозировкой), тип B (непредсказуемые эффекты), тип C (хронические эффекты), тип D (отсроченные эффекты) и тип E (эффект отмены) [2].
Большинство НЛР принадлежит к типу А (предсказуемы, связаны с механизмом действия лекарственных средств [ЛС]), они обычно клинически умеренно выражены и могут быть купированы на фоне снижения дозировки (табл. 1). Бóльшая часть этого типа НРЛ является или чрезмерным терапевтическим, или побочным эффектом препарата в связи с его воздействием на нецелевые мишени. Чрезмерный терапевтический ответ и побочные эффекты могут быть следствием взаимодействия лекарств, состояния пациента, включая генетику/этническую принадлежность, возраст или пол. Связанные с пациентом факторы могут определять фармакокинетику или фармакодинамику ЛС. Так, например, вполне очевидно, что передозировка антикоагулянта варфарин может привести к повышенной кровоточивости вследствие избыточной блокады факторов свертывающей системы [3]. Иммуносупрессия, достигаемая при использовании кортикостероидов, может одновременно быть как благоприятным (подавление аутоиммунитета), так и нежелательным (увеличение восприимчивости к инфекции) эффектом терапии [4].

Побочные эффекты могут наблюдаться в следующих случаях:
- когда лекарства действуют на тот же рецептор, но расположенный в другой ткани;
- когда препарат в состоянии оказать действие на аналогичные рецепторы, «не предназначенные» для терапевтического ответа.
Так, например, сальбутамол – бронхолитический препарат, агонист бета-2-адренорецепторов, разработан для расслабления гладкой мускулатуры дыхательных путей. Однако сальбутамол может также связываться с рецепторами сердечной мышцы, приводя к тахикардии, или с рецепторами скелетной мускулатуры, вызывая тремор [3]. Неселективные нестероидные противовоспалительные средства (НПВС), действующие на циклооксигеназу-2 (ЦОГ-2), оказывая желаемое действие – подавление воспаления, боли и отечности, могут одновременно блокировать циклооксигеназу-1 (ЦОГ-1), приводя к токсичности НПВС и множеству побочных эффектов, включая формирование язв в желудочно-кишечном тракте (ЖКТ) и удлинение времени кровотечения [3].
Непредсказуемый тип B (~20%) НЛР, как правило, малопредсказуем, не имеет четкой дозозависимости, данные реакции клинически могут быть очень серьезными и даже опасными для жизни [2].
Абсорбция лекарств через ЖКТ, кожу, дыхательные пути различны у детей и взрослых. Это может влиять на скорость поглощения препарата, степень его биодоступности и уровень его токсичности. Известно, что pH желудка при рождении почти нейтрален, снижается до pH=1–3 в течение первых суток жизни и затем медленно повышается до нейтральной реакции приблизительно к 8-му дню жизни. Затем вновь понижается до взрослых значений (2–3) к возрасту 2–3 лет [4]. Из-за различий в эвакуации желудочного содержимого, перистальтике кишечника, формировании ворсинок и созревании систем пассивного и активного транспорта через кишечник большинство лекарств поглощается новорожденными и маленькими детьми медленнее, чем детьми старшего возраста и взрослыми [4].
Активность метаболических ферментов I и II фаз биотрансоформации ЛС различна в каждый период детства. В результате этих различий метаболизм и элиминация многих важных лекарств могут быть неодинаковыми, что в свою очередь может потребовать изменения их дозы. Например, экспрессия генов CYP3A7 семейства цитохромов-Р450 достигает пика вскоре после рождения и практически нивелируется в зрелом возрасте. Активность цитохромов CYP3A4 и CYP3A5 резко увеличивается в течение первых 3 месяцев жизни, приводя к увеличению клиренса препаратов, метаболизируемых этими энзимами, включая, например, карбамазепин [5]. Фенитоин (противосудорожный препарат) в высокой степени метаболизируется печеночными цитохромами CYP2C9 и CYP2C19, его метаболизм изменяется в течение первых недель жизни [5].
Информации относительно метаболизма II фазы у детей раннего возраста недостаточно. Известно, что глюкоронидация ацетаминофена ниже у новорожденных и маленьких детей по сравнению с подростками и взрослыми [6]. Возраст-зависимое увеличение печеночного клиренса лекарств (в пересчете на массу тела) характерно в целом для периода детства, и это может требовать в некоторых случаях увеличения доз в расчете на 1 кг массы тела.
Нефрогенез является сложным и динамическим процессом, который начинается на ранних этапах внутриутробного развития и продолжается в раннем детстве. Скорость клубочковой фильтрации (СКФ) во многом определяет время элиминации многих ЛС и зависит от созревания почечных функций и почечного кровотока. Взрослые уровни СКФ достигаются в 8–12-месячном возрасте. Тубулярная секреция снижена у детей раннего возраста и достигает полного развития только к концу первого года жизни. Лекарства, элиминирующиеся главным образом клубочковой фильтрацией, такие как цефтазидим, фамотидин и тобрамицин, могут потребовать корректировки интервалов между введением в разных возрастных группах [4].
Пренатальное воздействие индаметацина, часто используемого для предотвращения преждевременного маточного сокращения, может приводить к значительному уменьшению СКФ (-0,17±0,03 мл/мин, адаптированное для гестационного возраста) на 2–3-й день после рождения [7].
Непредсказуемые НЛР типа B не имеют четкой зависимости от дозы. Большинство реакций типа B относятся к категории гиперчувствительных реакций на ЛС, данные реакции в основном иммуноопосредованные. Консенсус относительно точного определения реакции гиперчувствительности до настоящего времени не достигнут. Термин «лекарственная аллергия» используется в случаях, когда участие иммунной системы в реакции может быть ясно продемонстрировано. В случаях, когда иммунные механизмы не кажутся очевидными, используются термины «неиммунные гиперчувствительные реакции», или «псевдоаллергия» [4].
ЛС способны вызывать развитие всех типов иммунопатологических реакций, описанных P.G.N. Gell и R.R.A. Coombs [8]:
- тип I – иммуноглобулин Е (IgE)-опосредованные (крапивница, болезнь Квинке, анафилаксия);
- тип II – IgG-опосредованные (тромбоцитопения);
- тип III – опосредованные иммунными комплексами (васкулит, сывороточная болезнь);
- тип IV – опосредованные Т-лимфоцитами (лекарственная сыпь с эозинофилией и системными синдромами – DRESS, синдром Стивенса–Джонсона [SJS] и токсический эпидермальный некролиз [TEN]).
Следует отметить, что IgE-опосредованные и опосредованные Т-лимфоцитами гиперчувствительные реакции на ЛС встречаются наиболее часто. Точная патофизиология гиперчувствительных реакций на ЛС все еще изучена недостаточно, за исключением гиперчувствительности I типа.
Было показано, что у детей наиболее распространены кожные варианты НЛР типа В [9, 10]. Кожная сыпь является наиболее распространенным клиническим вариантом НЛР у детей при приеме антибиотиков, ароматических противосудорожных препаратов и НПВС [11].
Немедленные (IgE-опосредованные) аллергические лекарственные гиперчувствительные реакции имеют в основе гиперпродукцию IgE-антител антигенспецифическими В-лимфоцитами. Связывание специфических IgE-антител с высокоаффинными рецепторами на поверхности тучных клеток и базофилов, взаимодействие их с лекарственным антигеном приводят к высвобождению преформированных медиаторов (гистамина, триптазы), фактора некроза опухолей и вновь образуемых медиаторов (лейкотриенов, простагландинов, кининов, цитокинов) [12]. Данные медиаторы могут быть использованы в качестве диагностических биомаркеров лекарственной гиперчувствительности. Клинически данные реакции проявляются в форме крапивницы, ангиоотека, ринита, конъюнктивита, бронхоспазма, гастроинтестинальных нарушений или анафилаксии, анафилактического шока. Их развитие может наблюдаться при применении чужеродных сывороток, β-лактамных антибиотиков, сульфаниламидов, анальгезирующих средств, НПВС [12, 13].
Второй тип лекарственных гиперчувствительных реакций — цитотоксический [14]. В реакциях этого типа специфичные к ЛС антитела, преимущественно классов IgG или IgM, нацелены на специфические клетки, включая эритроциты, лейкоциты, тромбоциты и даже гемопоэтические клетки-предшественницы. Эти клетки, покрытые антителами, затем секвестрируются в печени и селезенке или разрушаются внутрисосудисто через опосредованный комплементом лизис [15]. Примером этих реакций служат гемолитическая анемия (пенициллины, цефалоспорины и некоторые противовоспалительные препараты) и тромбоцитопении (сульфаниламиды) [16].
Возникновение некоторых клинических форм лекарственной аллергии может быть обусловлено иммунокомплексными реакциями (III тип по Gell и Coombs). Эти реакции более отсрочены, чем IgЕ-опосредованные, поскольку образование растворимых IgG-антител происходит в течение 4–10 дней. В их основе лежит образование иммунных комплексов, их отложение в сосудистом русле на мембранах эндотелия сосудов мелкого калибра с последующим возникновением тканевых повреждений и нарушениями микроциркуляции [15]. Иммунокомплексные реакции протекают с вовлечением в патологический процесс комплемента. Образующиеся при этом анафилотоксины С3а и С5а вызывают высвобождение из тучных клеток и базофилов гистамина, протеолитических ферментов, вазоактивных аминов. Данный механизм считается ведущим в развитии сывороточной болезни, васкулитов, системной красной волчанки, гломерулонефрита, феномена Артюса, некоторых экзантем лекарственного происхождения [17]. Наиболее частой причиной возникновения иммунокомплексного варианта лекарственной аллергии служит применение антибиотиков, сывороток, вакцин, современных иммунобиологических препаратов (препаратов на основе моноклональных антител), включая ритуксимаб, инфликсимаб и натализумаб [15, 17–19].
Особое внимание приковано в последние годы к замедленным аллергическим реакциям на ЛС, которые опосредуются Т-лимфоцитами. Наиболее частой мишенью для реагирующих на ЛС Т-лимфоцитов является кожа, но в патологический процесс могут быть вовлечены и другие органы. Клеточно-опосредованные реакции могут быть серьезными НЛР, характеризующимися отсроченным началом и вовлечением многих органов. Номенклатура их была долго спорной, в частности, из-за вариабельности клинических проявлений и непредсказуемого прогноза. Они часто начинаются через 7–10 дней после начала терапии и проявляются как набор симптомов, зачастую начинающихся с кожной сыпи – отличительной черты этих синдромов [20]. Затем в патологический процесс может быть вовлечен практически любой орган, включая печень, почки, легкие, слизистые оболочки. Возможно развитие таких серьезных кожных реакций, как синдром Стивенса–Джонсона (SJS) и токсико-эпидермальный некролиз (TEN), что требует резкого прекращения лечения виновным препаратом и оказания симптоматической поддержки. Однако симптомы могут требовать несколько недель для разрешения с возможными осложнениями в течение всей жизни.
Основные механизмы замедленных реакций не совсем понятны. Сначала осуществляется процессинг лекарственного антигена дендритными клетками, затем антиген транспортируется в регионарные лимфоузлы, где презентируется Т-клеткам. В последующем антигенспецифические Т-лимоциты мигрируют в орган-мишень, после экспозиции антигена они активируются и секретируют провоспалительные цитокины, которые вызывают развитие воспаления и повреждение тканей [15]. «Реактивная метаболитная гипотеза» постулирует, что препараты (часто неактивные) подвергаются метаболизму в реактивные, которые накапливаются у восприимчивых пациентов из-за дисбаланса в процессах активации (А)/детоксикации (D). Накопленные реактивные метаболиты могут вызывать апоптоз и некроптоз в клетках-хозяевах, обеспечивая «сигналы опасности» (гипотеза опасности) [21]. Эти реакционноспособные метаболиты могут связываться как (1) с внеклеточными пептидами, которые будут поглощены антигенпрезентирующими клетками и представлены МНС класса II CD4+хелперным Т-клеткам, так и (2) с внутриклеточными пептидами, которые будут представлены МНС класса I цитотоксическим Т-клеткам CD8+. Также постулируется, что нереактивные ЛС могут непосредственно стимулировать иммунную систему путем активации ключевых рецепторов на Т-клетках (прямое фармакологическое взаимодействие с иммунными рецепторами, гипотеза P-I) [22].
Исследования реакций гиперчувствительности к абакавиру, аналогу нуклеозидов, используемому для подавления репликации ВИЧ, привели к открытию сильной генетической ассоциации между риском возникновения реакций гиперчувствительности на абакавир и MHC (основной комплекс гистосовместимости) аллелем (HLA – Human Leukocyte Antigens)-B*57:01). Последний далее был использован в качестве генетического теста для выявления групп риска по формированию НЛР на абакавир среди пациентов [23].
Современные исследования показали, что абакавир может связываться нековалентно с F-карманом пептидной связующей HLA-B*57:01, тем самым изменяя ее специфичность, что затем распознается иммунными клетками как чужеродный объект, вызывающий иммунный ответ [24].
Данная гипотеза предполагает, что ЛС (абакавир в этом случае) могут взаимодействовать непосредственно с пептидами, представленными на молекулах I класса HLA, вызывая активацию иммунной системы и приводя к проявлениям симптомов гиперчувствительности замедленного типа. Сопутствующие инфекции (вирусные или бактериальные) могут обеспечивать «сигналы опасности». Эти последние могут способствовать созреванию антигенпредставляющих клеток, активировать клетки врожденного иммунитета (например, макрофаги, естественные киллерные клетки, NK) через механизм распознавания сходных рецепторов (TLR – toll-like receptors) для высвобождения цитокинов (например, интерферонов-γ [ИФН-γ]), которые увеличивают экспрессию основного комплекса гистосовместимости (МНС) на поверхности антиген-представляющих клеток.
Антибиотики, и особенно β-лактамы, относятся к числу препаратов, наиболее часто назначаемых детям. Поэтому неудивительно, что этот класс лекарств наиболее связан с реакциями гиперчувствительности замедленного типа в этой возрастной группе. Наиболее известными отсроченными реакциями на β-лактамные антибиотики являются уртикарные и макулопапулезные/морбиллиформные экзантемы.
Псевдоаллергические реакции относятся к НЛР, которые клинически напоминают аллергию, но «истинные» иммунные механизмы в них не задействованы. Лучшим примером такого типа НЛР является респираторное заболевание, индуцированное НПВС, известное как аспириновая астма [25]. НПВС оказывают противовоспалительное действие, ингибируя ЦОГ-1 и ЦОГ-2. Считается, что это вмешательство в метаболизм арахидоновой кислоты (АК) приводит к шунтированию пути метаболизма АК через 5-липоксигеназу, что приводит к увеличению высвобождения цистеиниловых лейкотриенов (ЛТ) и снижению синтеза простагландина Е2 (ПГE2), сильного модулятора активности тучных клеток. ЛТC4, ЛТD4 и ЛТE4 вызывают бронхоспазм и повышают проницаемость сосудов, что приводит к развитию соответствующих кожных симптомов (гиперемия, отек, макуло-папулезная сыпь). Считается, что эти кожные симптомы опосредуются ингибированием фермента ЦОГ-1, что приводит к увеличению уровней ЛТE4 [26].
Многие препараты могут вызывать реакции, подобные анафилаксии (анафилактоидные реакции). Эти препараты активируют тучные клетки и базофилы, потенцируют высвобождение медиаторов воспаления через неиммунные механизмы. В их числе опиаты, ванкомицин (синдром красного человека), йодсодержащие рентгенконтрастные вещества, инфузионный амфотерицин и ингибиторы ангиотензинпревращающего фермента. Частота поздних анафилактоидных реакций у детей неизвестна. Однако кожные реакции, вызванные НПВС, встречались среди 0,3% здоровых детей и 7,8% детей с аллергией на пищевые продукты [27].
Одним из основных механизмов неиммунно-опосредованных гиперчувствительных реакций является митохондриальная токсичность. Известно, что вальпроевая кислота ассоциируется с реакциями такого типа. Особый интерес вызывает тот факт, что эпилепсия, болезнь, для лечения которой наиболее часто используется вальпроевая кислота, связана с митохондриальными расстройствами, включая синдром MELAS (митохондриальная энцефаломиопатия, лактат-ацидоз и инсультоподобные пароксизмы), синдром MERRF (миоклонус-эпилепсия с рваными красными волокнами), синдром Кернса–Сейра (птоз, офтальмоплегия, пигментный ретинит, атаксия, нарушение сердечного проведения), синдром NARP (невропатия, атаксия, пигментный ретинит), синдром Ли (подострая некротизирующая энцефаломиелопатия), болезнь Лебера (наследственная оптическая невропатия). Любой базовый дефект в функции митохондрий представляет собой основной фактор риска развития митохондриальной токсичности, и это необходимо учитывать при назначении вальпроевой кислоты [4].
Нами выполнено ретроспективное исследование по историям болезней пациентов, получавших лечение в условиях педиатрического отделения Детской городской клинической больницы № 1 Нижнего Новгорода в 2015–2016 гг. в связи с острыми гиперчувствительными реакциями на ЛС, потребовавшими госпитализации. Всего проанализировано историй болезни 76 детей в возрасте от 3 до 17 лет, средний возраст пациентов составил 7,6 года [7,0–8,2]: мальчиков – 34, девочек – 42. Шестнадцать детей и их родители связывали возникновение острых аллергических реакций с сочетанным применением лекарств и пищевых продуктов.
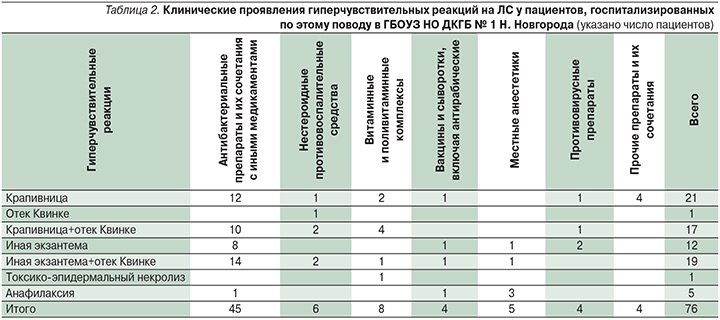
Среди клинических синдромов (табл. 2) у единичных пациентов 5/76 (6,8%) были отмечены случаи анафилаксии (на фоне применения местных анестетиков при стоматологических вмешательствах у 3 пациентов, на фоне введения антирабического иммуноглобулина у 1 ребенка, на фоне внутримышечного введения цефалоспоринов у 1 пациента). У пациентки 6 лет имел место отек Квинке, развившийся после перорального приема НПВС с целью купирования головной боли. Токсико-эпидермальный некролиз был диагностирован у девочки 5 лет, в анамнезе у нее имело место употребление поливитаминных препаратов. Cреди остальных детей 69/76 (90,8%) имели место различные варианты экзантем – уртикарные, пятнисто-папулезные, морбилиформные высыпания. Таким образом, у большинства детей с острыми лекарственными гиперчувствительными реакциями преобладали кожные проявления гиперчувствительности, что согласуется с последними литературными данными [9].
Гиперчувствительные реакции на ЛС по типу острой крапивницы были диагностированы у 21/76 (27,6%) пациента. У 17/76 (22,4%) детей отмечено сочетанное развитие уртикарной сыпи и ангиоотека. Таким образом, всего клинические проявления острой крапивницы имели место у 38/76 (50%) пациентов.
Различные варианты кожной сыпи, включая пятнисто-папулезную и «морбилиформную» экзантемы, имевшие достаточно ригидный к терапии характер, в части случаев склонные к образованию пигментации, имели место у 31/76 (40,8%) пациента, при этом у 19 из них отмечено сочетание данных высыпаний с симптомами ангиоотека.
Всего ангиоотек в сочетании с кожными проявлениями гиперчувствительности имел место у 36/76 (47,4%) пациентов, госпитализированных по поводу лекарственных гиперчувствительных реакций.
В качестве этиологических причин гиперчувствительных реакций на ЛС в рассматриваемой выборке детей преобладали антибактериальные препараты – у 45 из 76 пациентов, что соответствует имеющимся литературным данным [11, 13, 28]. При этом у 12 детей гиперчувствительная реакция развилась на фоне применения цефалоспоринов, у 25 – аминопеницилллинов или защищенных аминопенициллинов, у остальных детей – на фоне применения котримоксазола (Бисептол), метронидазола, нитрофуранов (энтерофурил, эрцефурил).
Согласно докладу педиатрической целевой группы EAACI «Drug Allergy Interest Group», до настоящего времени сохраняется значительный пробел в сведениях по эпидемиологии, спектру клинических проявлений, патогенезу побочных эффектов на ЛС у детей [1, 28]. Это затрудняет формирование оптимальных программ по определению групп риска детей, склонных к развитию побочных эффектов на ЛС, предупреждению, диагностике и лечению данных патологических состояний. Наиболее распространенными клиническими проявлениями являются крапивница и «морбилиформные» («кореподобные») экзантемы, что подтверждается нашими собственными исследованиями. Обращает на себя внимание высокая доля отеков Квинке у данной категории детей, что, по-мнению E. Gomes и соавт., может быть весьма специфичным для пациентов детского и подросткового возраста [28].
К данной проблеме в настоящее время приковано пристальное внимание исследователей. Это вселяет надежду на разработку в ближайшем будущем четких алгоритмов по предупреждению, диагностике и лечению данных патологических состояний у детей, что позволит минимизировать риски формирования побочных эффектов на ЛС у пациентов детского возраста.



