Введение
Несмотря на то что современная психиатрия располагает большим арсеналом средств антидепрессивной терапии, лечение депрессий в пожилом и старческом возрасте остается чрезвычайно актуальной социально-медицинской проблемой. Это объясняется как высокой распространенностью депрессивных расстройств в позднем возрасте, частота которых колеблется в диапазоне от 18 до 25% [1–3], так и нередкой низкой результативностью терапии депрессивных состояний. По оценке английских исследователей, исходы депрессий в популяции больных психогериатрического стационара вряд ли могут считаться удовлетворительными: только в 20% случаев наступает выздоровление, в 60% наблюдается рецидивирование, а еще в 20% – хронификация [2]. Для депрессий, развивающихся в пожилом возрасте, характерны риск повышенной смертности вследствие сопутствующих заболеваний или осложнений терапии и высокий суицидальный риск. По данным Всемирной организации здравоохранения (2006), бремя болезни, связанное с депрессией, занимает третье по значимости место среди всех других заболеваний. При этом на долю показателя DALYs (потерянные годы жизни, утраченные в связи с преждевременной смертью) у депрессивных больных приходится 6,2% от общего показателя DALYs вследствие всех других заболеваний [4].
Лечение депрессий у пожилых и старых людей сопровождается повышенным риском осложнений фармакотерапии, достигающих 60% [5, 6], которые нередко возникают уже на низких дозах антидепрессантов, не достигающих терапевтического ответа, что часто становится причиной развития псевдорезистентности. Осложнения характеризуются широким спектром клинических проявлений (гемодинамические, антихолинергические, когнитивные) и их особой по своим последствиям тяжестью (коллапс, падения, сопровождающиеся переломами, острая задержка мочи, острая спутанность сознания).
Причины плохой переносимости психофармакотерапии в пожилом и старческом возрасте обусловлены не только возрастными изменениями метаболизма и выведения лекарственных средств, нарушением их фармакокинетики и фармакодинамики, но и характерной для пожилых людей поликоморбидностью и связанной с ней полипрагмазией, сопровождающейся риском нежелательного лекарственного взаимодействия.
Частота сопутствующей соматической патологии у пожилых депрессивных больных составляет 50–68%, большая часть которых относится к заболеваниям факторов сосудистого риска (гипертоническая болезнь, церебро-сосудистая недостаточность, кардиальная патология, диабет). Соматическое заболевание в позднем возрасте часто является соматогенной провокацией депрессии. Однако еще более часто поздняя депрессия сама является провоцирующим фактором обострения хронических соматических заболеваний (до 40% случаев), что значительно затрудняет лечение, приводит к затягиванию депрессий и ухудшает качество выходов из них .
Еще одной важнейшей причиной плохой переносимости антидепрессивной терапии в позднем возрасте считается наличие у пожилых пациентов органических церебральных изменений сосудистого или нейродегеративного генеза, сопровождающих старение мозга. Прежде всего речь идет о подкорковых мелкоочаговых и диффузных изменениях белого вещества мозга, уменьшении размеров гиппокампа, обьема и толщины ростральной орбито- и префронтальной коры, базальных ганглиев [7–9]. Таким образом, наличие изменений в подкорковом белом веществе мозга, лимбической системе, базальных ганглиях и ростральных отделах коры могут объяснить не только аффективные, но и моторные, а также когнитивные расстройства при поздних депрессиях.
Известно, что депрессия и в молодом возрасте вызывает легкие когнитивные расстройства [10]. Однако в позднем возрасте на фоне вышеописанных структурных церебральных изменений развитие депрессии вызывает когнитивную дисфункцию разной степени выраженности – от легких нарушений концентрации внимания, удержания и воспроизведения новой информации до более выраженных состояний по типу «депрессивной псевдодеменции» с ухудшением текущей памяти, ориентировки и снижением исполнительных функций. При этом традиционная антидепрессивная терапия (особенно трициклические антидепрессанты) может вызывать у депрессивных пожилых больных усиление когнитивной дисфункции вплоть до развития эпизодов спутанности.
Исходя из современных представлений о патогенетических механизмах и клинических особенностях поздних депрессий, можно ожидать, что повышение эффективности лечения депрессивных расстройств может быть достигнуто путем включения в антидепрессивную терапию препаратов с нейропротективным и нейротрофическим действиями. Одним из таких нейропротективных препаратов является цитиколин (Цераксон®) – цитидин-5′-дифосфат холина (CDP-холин, ЦДФ-холин), эндогенное водорастворимое вещество, мононуклеотид, в состав которого входят рибоза, пирофосфат, цитозин и холин, имеющий лекарственный аналог с более чем 90%-ной биодоступностью. После введения в организм цитиколин подвергается гидролизу и дефосфорилированию до цитидина и холина, которые по отдельности проникают через гематоэнцефалический барьер и внутри нейронов ресинтезируются с помощью цитидинтрифосфатфосфохолин-(CTP)-цитидилилтрансферазы в CDP-холин [11–13].
Цитиколин и продукты его гидролиза активируют биосинтез структурных фосфолипидов мембран нейронов, преимущественно фосфатидилхолина (лецитина), способствуют повышению уровня тирозина в стриатуме, стимулируют активность тирозингидроксилазы, дофамина, биосинтез ацетилхолина, активируют мускариновые рецепторы в центральной нервной системе, оказывают нейропротективное действие в период гипоксии и/или церебральной ишемии за счет подавления глутаматиндуцированного апоптоза, вызванного церебрососудистыми нарушениями [14, 15]. Кроме того, терапевтическое действие цитиколина включает восстановление активности митохондриальной АТФазы и мембранной Na+/K+-АТФазы, ингибирование активности фосфолипазы А2. Нейропротективное и антигипоксическое действия цитиколина были экспериментально подтверждены в ряде исследований на моделях нейродегенерации in vivo в виде ускорения реабсорбции церебрального отека у экспериментальных моделей, а также улучшения внимания, обучаемости, памяти у животных моделей старения мозга [16–21].
По данным различных фармакокинетических исследований, цитиколин хорошо абсорбируется и остается биодоступным как при инфузионном, так и при пероральном пути введения [22]. Таким образом, цитиколин обладает широким терапевтическим диапазоном, хорошей переносимостью и применяется как при когнитивных нарушениях различного генеза (сосудистого, атрофического, сосудисто-атрофического) разной степени выраженности, так и при болезни Паркинсона, черепно-мозговых травмах, острых нарушениях мозгового кровообращения, офтальмологических заболеваниях (амблиопия, глаукома) [12, 23, 24]. Помимо этого в настоящее время рассматривается целесообразность применения цитиколина в комплексной терапии демиелинизирующих заболеваний, в частности рассеянного склероза, а также в наркологической практике.
В связи с вышеизложенным в данной работе была изучена возможность повышения эффективности и безопасности антидепрессивной монотерапии больных пожилого и старческого возраста в условиях геронтопсихиатрического стационара и посредством мультимодальной терапии с включением в схему лечения препарата цитиколин (Цераксон®). Настоящая работа служит продолжением серии исследований, выполненных в отделении психозов позднего возраста отдела гериатрической психиатрии ФГБНУ НЦПЗ и посвященных поиску новых препаратов с нейропротективной активностью для применения в комплексной терапии депрессий у больных пожилого и старческого возраста [25, 26].
Целью настоящего исследования стала сравнительная оценка эффективности и безопасности монотерапии одним из антидепрессантов новых поколений (венлафаксина, агомелатина или феварина) и комплексной антидепрессивной терапии с применением аналогичных антидепрессантов в сочетании с цитиколином для лечения депрессий у больных пожилого возраста в условиях психиатрического стационара.
Материал и методы
В работу включили больных геронтопсихиатрического стационара в возрасте от 60 до 79 лет с депрессией легкой и умеренной выраженности. Все больные в течение 8 недель получали антидепрессивную моно- или комплексную терапию. Все пациенты прошли полное клиническое обследование (психопатологическое, психометрическое, терапевтическое и неврологическое). Для выявления структурных изменений головного мозга всем пациентам проведена магнитно-резонансная томография головного мозга.
Цитиколин назначали внутривенно капельно по 500 мг (4,0 мл) в 150 мл физиологического раствора 5 раз, затем по 1000 мг (4,0 мл) внутривенно капельно в 150 мл физиологического раствора 5 раз. После окончания курса внутривенных инфузий цитиколин назначали в виде раствора per os по 3,0 мл 2 раза в день внутрь в течение 6 недель.
В качестве антидепрессантов назначались препараты новых поколений с различным механизмом действия: агомелатин (6 человек в каждой терапевтической группе), венлафаксин (8 человек в 1-й терапевтической группе и 9 человек во 2-й терапевтической группе) и флувоксамин (7 человек в каждой терапевтической группе). Венлафаксин назначали в дозе 75–150 мг/сут в два приема. Агомелатин назначали 1 раз в сутки в одно и то же время (вечером) в дозе 25 мг в первые две недели терапии. При необходимости суточная доза увеличивалась до максимальной (50 мг) 1 раз вечером. Флувоксамин назначали в дозе 100–150 мг/сут в два приема. Общая продолжительность курса лечения в обеих группах составила 8 недель.
В работе использовался метод открытой сравнительной оценки разных видов антидепрессивной терапии в сопоставимых по клиническим характеристикам (поло-возрастное распределение, тяжесть депрессии) группах больных. Для оценки терапевтической эффективности (в соответствии со специально разработанным протоколом) использовали стандартизованные оценочные шкалы: шкалу Гамильтона для оценки депрессивных и тревожных расстройств (HAMD-17, HARS). Кроме того, оценка тяжести депрессии и степени клинического улучшения производилась с помощью шкалы общего клинического впечатления (CGI). Использовалась градуированная оценка тяжести состояния по подшкале CGI-S, где 1 балл соответствовал тому, что пациент не болен, 2 балла – пограничному состоянию (субклинический уровень), 3 балла – легкой степени, 4 балла – средней степени, 5 баллов – умеренно-тяжелому состоянию, 6 баллов – тяжелому состоянию, 7 баллов – чрезвычайно тяжелому состоянию. Подшкала (CGI-I) оценивала динамику состояния в процессе терапии по сравнению с его начальным уровнем; 1 балл соответствовал выраженному, 2 балла – умеренному и 3 балла – минимальному улучшению; 4 балла соответствовали отсутствию изменений, 5 баллов – минимальному ухудшению, 6 баллов – ухудшению и 7 баллов – выраженному ухудшению. Оценка состояния больных производилась 4 раза – до начала лечения в (0-й день), на 14-й, 28 и 56-й день терапии. Для оценки динамики когнитивного функционирования применяли краткую шкалу оценки когнитивного статуса (MMSE), тест воспроизведения 10 слов и тест рисования часов. Уровень когнитивной деятельности расценивали как нормальный при суммарной оценке по шкале MMSE 28 баллов и выше, от 25 до 27 баллов – как легкое когнитивное расстройство, 24 балла и ниже – как когнитивный дефицит в степени деменции. Для оценки побочных явлений терапии применяли шкалу оценки побочных эффектов (SARS).
Тяжесть депрессии оценивали по клиническим показателям (в соответствии с МКБ-10), а также по суммарной оценке шкалы депрессии Гамильтона HAMD-17. Оценки 7 баллов и ниже рассматривали как соответствующие клинической ремиссии; от 8 до 15 баллов – малой депрессии или «неполной» ремиссии; от 16 до 21 балла – легкой депрессии; от 22 до 26 баллов – депрессии средней тяжести; от 27 баллов и выше – тяжелой депрессии. Эффективность терапии определяли по степени редукции оценки по шкалам HAMD-17, HARS, а также по шкалам CGI-S и CGI-I на 14-й, 28 и 56-й день лечения по отношению с исходной оценке (в %) и по числу больных c редукцией на 50% и более оценки тяжести депрессии (в баллах) по шкале HAMD-17 к окончанию терапии.
Кроме того, эффективность терапии оценивали по качеству ремиссии, достигнутой к окончанию терапии. Ремиссия оценивалась как полная при показателях суммарного балла по шкале HAMD-17≤7 баллов, как ремиссия с резидуальными расстройствами (или неполная ремиссия) при показателях 8–15 баллов и как легкий депрессивный эпизод при показателях от 16 до 21 балла. Статистический анализ результатов проведен с применением программы Statistica 6.0. Для описания количественных признаков использовались средние значения и стандартные отклонения. Сравнения групп производили с использованием непараметрических методов (парного критерия Вилкоксона). Различия считались достоверными при p<0,05.
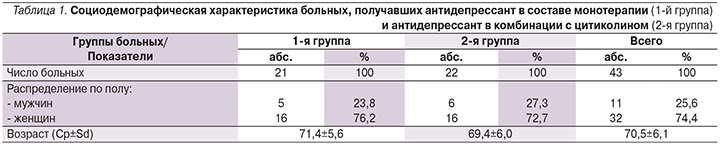
В исследование были включены 43 больных: 11 (25,6%) мужчин и 32 (74,4%) женщины в возрасте от 60 до 79 лет (средний возраст – 70,5±6,1 года) (табл. 1).
Длительность заболевания колебалась от 1 до 22 лет. Средняя длительность болезни составила 18,03±18,41 года (медиана – 15 лет). Возраст манифестации заболевания варьировался в широких пределах – от 26 до 76 лет. Длительность текущей депрессивной фазы составила от 1 до 18 месяцев (в среднем 4, 14,00±2,21 месяца), (медиана – 3,5 месяца). Все пациенты имели высшее или среднее специальное образование. На момент обследования в браке состояли 16 (37,2%) человек; никогда не вступал в брак 1 (2,3%) человек, 8 (18,6%) больных были в разводе и 18 (41,9%) женщин были вдовами. Среди поступивших на лечение больных преобладали пенсионеры – 37 (86,0%) больных. Большинство пациентов, 24 (55,8%) человека, проживали в семье, 13 (30,2%) – жили отдельно, но имели родственников и 6 (13,9%) человек были одинокими.
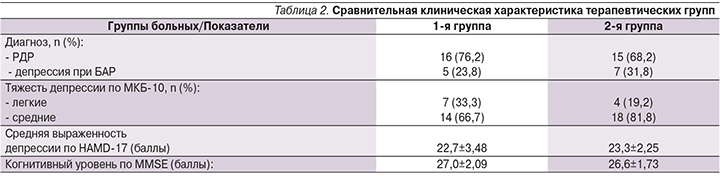
У всех больных был диагностирован большой депрессивный эпизод (в соответствии с классификацией DSM-III-TR или МКБ-10) различной этиологии: у 31 (72,1%) – депрессивная фаза в рамках рекуррентного депрессивного расстройства (РДР) и у 12 (27,9%) – в рамках биполярного аффективного расстройства (БАР) (табл. 2). У больных в анамнезе отсутствовали другие психические расстройства и первичные органические заболевания. По критериям МКБ-10, у 32 (74,4%) больных депрессия соответствовала депрессивному эпизоду средней степени тяжести, у 11 (25,6%) – легкому депрессивному эпизоду. Тревожный компонент депрессии по шкале тревоги Гамильтона составил в среднем по группе 20,44±3,80 балла. Уровень когнитивной деятельности большинства больных соответствовал возрастной норме со среднегрупповым показателем по шкале MMSE – 26,79±1,90 балла.
С учетом основных демографических и клинических (тяжесть депрессивного эпизода) характеристик было сформировано две группы больных. Больные 1-й группы (5 [23,8%] мужчин и 16 [76,2%] женщин со средним возрастом 71 год, 4±5,6 года) получали терапию одним из антидепрессантов. Больные 2-й группы (6 [27,3%] и 16 [72,7%] женщин со средним возрастом 69,4±6,0 лет) одновременно с антидепрессивной терапией получали терапию препаратом цитиколин.
Результаты
Полностью курс терапии завершили 42 (97,7%) из 43 больных. Одна пациентка была досрочно исключена из терапевтической программы на 14-й день антидепрессивной монотерапии из-за ухудшения психического состояния (усиление тревожно-ипохондрических расстройств). Эффективность терапии в обеих группах пролеченных больных оказалась достаточно высокой.
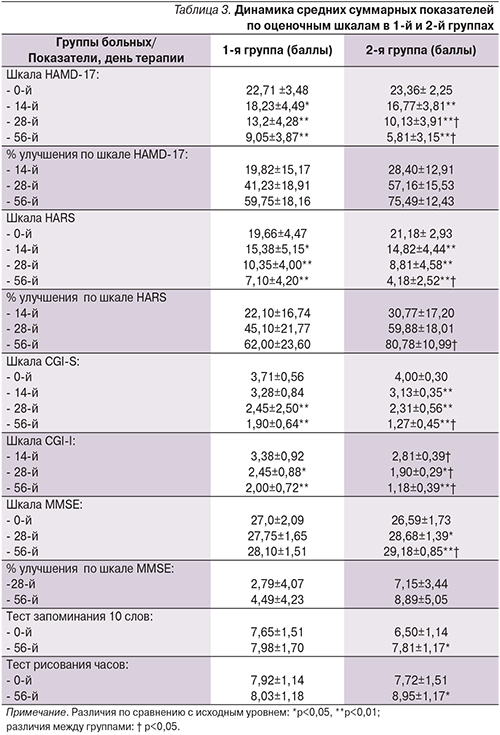
Достоверная редукция депрессивной симптоматики по шкале HAMD-17 была отмечена уже к 14-му дню терапии (р<0,05), в дальнейшем положительная динамика нарастала на протяжении всего терапевтического курса. К окончанию 56-дневного курса лечения средний суммарный балл по шкале HAMD-17 снизился в 1-й терапевтической группе с 22,71 до 9,05. Средняя степень улучшения составила 59,7%. Во 2-й терапевтической группе средний суммарный балл по шкале HAMD-17 снизился с 23,36 до 5,81, а степень улучшения достигла 75,49%.
У большинства пациентов отмечена редукция тревожных расстройств, наблюдавшихся в структуре депрессивной фазы. Достоверное антитревожное действие в обеих терапевтических группах было отмечено к 14-му дню терапии (р<0,05 в 1-й терапевтической группе и р<0,01 во 2-й) с дальнейшей редукцией тревожных расстройств на протяжении терапевтического курса. К окончанию терапии в 1-й терапевтической группе тревожные расстройства редуцировались на 62,0%, во 2-й – на 80,78%. Межгрупповые различия в динамике редукции депрессивных расстройств оказались статистически достоверными к 28-му дню терапии и к окончанию терапевтического курса (по шкале HAMD-17). Статистически достоверные межгрупповые различия показателей тревоги (по шкале HARS) отмечались только к окончанию терапевтического курса. Эффективность терапии, оцениваемая по количеству респондеров и нонреспондеров, также значительно отличалась в терапевтических группах. К респондерам относились больные с редукцией депрессивных расстройств, оцениваемых по шкале HAMD-17 на 50% и выше.
К 28-му дню терапии долю респондеров в 1-й терапевтической группе составили 6 человек (28,6%), во 2-й – 17 (77,3%). На 56-й день терапии – 14 (66,6%) человек и 21 (95,5%) соответственно. Через месяц терапии в 1-й терапевтической группе полная ремиссия была достигнута 3 (14,3%) пациентами, неполная ремиссия 10 (47, 6%) и легкая депрессия оставалась у 7 (33,3%) больных. К этому времени во 2-й терапевтической группе полной ремиссии достигли 5 (22,7%) человек, неполная ремиссия наблюдалась у 16 (72,7%) больных и легкая депрессия у 1 (4,7%). К окончанию курса терапии (56-й день) в 1-й терапевтической группе полной терапевтической ремиссии достигли 5 (23,8%) больных, у 14 (66,7%) пациентов отмечена неполная ремиссия и у 1 (4,8%) больной состояние оценено как легкая депрессия. Во 2-й терапевтической группе преобладали пациенты, достигшие полной терапевтической ремиссии, – 16 (72,7%) человек, неполная ремиссия отмечена у 6 (27,3%).
В результате проведенного лечения, число больных, достигших полной терапевтической ремиссии, оказалось вдвое больше через месяц терапии во 2-й терапевтической группе (по сравнению с 1-й), а к окончанию терапевтического курса оно превысило число полных ремиссий в 1-й группе почти в 3 раза. Таким образом, скорость наступления и выраженность терапевтического эффекта оказались выше в группе больных, получавших комбинированную терапию.
Динамика состояния когнитивных функций, оцененная по выполнению больными ряда тестов, показала достоверное улучшение когнитивного функционирования к окончанию терапевтического курса только во второй терапевтической группе. Достоверные изменения среднегрупповой суммарной оценки отмечены по всем шкалам, примененным для оценки когнитивных функций: по шкале MMSE, тесту запоминания слов и тесту рисования часов (табл. 3).
Таким образом, более быстрая и выраженная положительная динамика улучшения когнитивной деятельности наблюдалась в группе больных, получавших комбинированную терапию антидепрессантом в сочетании с цитиколином. В целом проведенный анализ динамики клинических показателей выявил существенные межгрупповые различия в степени выраженности и скорости развития терапевтического эффекта. Из представленных данных видно, что положительная динамика различной степени выраженности наблюдалась по всем оценочным шкалам в обеих терапевтических группах, но при этом показатели эффективности терапии по большинству из применявшихся оценочных шкал во 2-й терапевтической группе больных, получавших комбинированную терапию одним из антидепрессантов в сочетании с цитиколином, достоверно превышали аналогичные показатели в группе монотерапии.
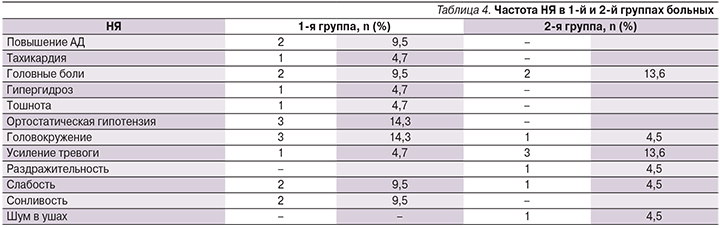
Нежелательные явления (НЯ) были зарегистрированы у 17 пациентов, т.е. у 39,5% из всех пролеченных больных. Серьезных НЯ ни в одной из групп больных отмечено не было. НЯ, наблюдавшиеся в процессе терапии, представлены в табл. 4. В 1-й группе НЯ отмечались у 10 (47,6%) больных. У половины (5 человек) из них наблюдалось одно, а у половины – два и более НЯ. Среди побочных эффектов терапии преобладали нарушения легкой и средней степеней тяжести.
В этой группе больных досрочно (через две недели терапии) курс терапии был прекращен одним пациентом. Прекращение лечения было обусловлено недостаточной эффективностью терапии: у выбывшей больной присутствовало усиление тревоги и депрессии с присоединением ипохондрического бреда. Во 2-й группе НЯ отмечались у 7 (31,8%) человек. Из них одно НЯ имело место у 5 больных, два – у 2. В этой группе чаще встречались такие НЯ, как тревожные реакции, цефалгии, раздражительность, что, вероятно, связано с некоторым активирующим действием терапии.
НЯ, возникшие в ходе терапии, были расценены как легкие, они возникали преимущественно в начале лечения (на 1–2-й неделе). В большинстве случаев отмеченные нарушения оценивались как усиление уже имевшихся у пациентов к началу лечения сомато-вегетативных симптомов. Анализ нежелательных явлений показал лучшую переносимость терапии во 2-й группе больных.
Обсуждение
Проведенное исследование показало, что включение цитиколина в комплексную антидепрессивную терапию больных позднего возраста способствовало значительному ускорению развития терапевтического ответа, повышению эффективности и безопасности лечения и приводило к значительному уменьшению когнитивной дисфункции.
Влияние цитиколина на связанные со старением когнитивные нарушения изучалось в работе А. Agnoli, G. Burno и М. Fioravanti [30]. В двойном слепом плацебо-контролируемом клиническом исследовании авторы установили улучшение внимания и памяти у больных, получавших в течение 6 месяцев цитиколин (1000 мг/сут), по сравнению с группой плацебо. Авторы отметили, что цитиколин оказывает допаминергическое действие, поскольку, по их мнению, эффективность обучения и памяти связана с функцией внимания, зависящей от функции допаминергических структур мозга. Ряд ранее выполненных исследований также свидетельствует о положительном нейроэндокринном, нейротрофическом и нейроиммуномоделирующем эффектах препарата за счет опосредованного действия ЦДФ-холина как агониста дофаминовых рецепторов. Это позволило авторам сделать вывод о целесообразности использования цитиколина в длительной комплексной терапии болезни Паркинсона в сочетании с более низкой дозой леводопы, чем при монотерапии леводопой [31].
Влияние цитиколина на вербальную память пожилых людей изучалось в двойном слепом плацебо-контролируемом испытании на 95 здоровых добровольцах в возрасте 50–85 лет [32]. В течение 3 месяцев цитиколин назначали по 1000 мг/сут. В следующие три месяца подгруппа лиц с более низкими показателями памяти получали либо 2000 мг/сут цитиколина, либо плацебо. После первой фазы лечения улучшение было установлено только в подгруппе лиц с плохой памятью, у которых после лечения цитиколином улучшились отсроченное воспроизведение и логическая память. К окончанию второй фазы большее улучшение обнаружили участники, получавшие 2000 мг цитиколина ежедневно, поэтому авторы пришли к заключению, что доза 2000 мг/сут более эффективна для лиц с расстройствами памяти, связанными со старением.
Способность цитиколина замедлять прогрессирование когнитивного дефицита у больных синдромом мягкого когнитивного снижения была установлена в исследовании С.И. Гавриловой и соавт. [27]. Результаты исследования подтвердили опубликованные ранее данные об эффективности и безопасности применения цитиколина при лечении когнитивных нарушений у пожилых лиц с синдромом мягкого когнитивного снижения амнестического типа, который в значительной части случаев служит проявлением додементной стадии болезни Альцгеймера. Авторы делают вывод, согласно которому фармакологические свойства Цераксона® (цитиколина), его способность стимулировать нейрогенез, регенерацию и защиту нейронов, а также подтвержденная в клинических исследованиях эффективность препарата в отношении когнитивных дисфункций и безопасность его применения делают Цераксон® многообещающим препаратом для проведения долгосрочных превентивных программ для лиц с высоким риском развития болезни Альцгеймера. Установлено также, что у больных сосудистой деменцией на фоне приема цитиколина не только приостанавливается прогрессирование заболевания, но и наступает значимое улучшение уровня когнитивного функционирования [27–29].
В ряде исследований была доказана эффективность цитиколина при лечении различных когнитивных расстройств цереброваскулярной этиологии, не достигающих уровня деменции. В исследование VITA (2012), в котором оценивалась эффективность цитиколина у больных цереброваскулярной болезнью, были включены 272 пациента со средним возрастом 81,5 года с подострой ишемией головного мозга цереброваскулярного генеза, получавших 2000 мг цитиколина внутривенно капельно с 500 мл раствора хлорида натрия в период от 5 до 10 дней. В процессе исследования было выявлено, что уже через 5 дней (у 80% респондеров) и 10 дней (у 20% респондеров) отмечалось выраженное улучшение навыков самообслуживания, особенно заметное среди возрастной группы 70–79 лет [28].
Мета-анализ результатов 14 опубликованных двойных слепых плацебо-контролируемых рандомизированных исследований цитиколина при лечении хронических церебрально-сосудистых расстройств, включивший в общей сложности 884 пожилых больных с когнитивными нарушениями [33], продемонстрировал эффективность цитиколина в виде улучшения памяти и поведения, но не внимания. В целом результаты исследований свидетельствовали о значительном улучшении когнитивных функций в группе больных, леченных цитиколином, по сравнению с группами, получавшими плацебо. В работе немецкой группы исследователей Skripuletz et al. [34] проводилось изучение эффективности цитиколина в условиях экспериментальной модели аутоиммунных энцефаломиелитов in vitro и in vivo у лабораторных мышей. По данным исследования было установлено, что цитиколин способен опосредованно влиять на процессы миелинизации нервных волокон. In vitro данный процесс регулировался протеинкиназой С, in vivo цитиколин потенцировал регенерацию миелина и уменьшал выраженность двигательных нарушений, неврологического дефицита, увеличивая ремиелинизацию за счет увеличения количества олигодендроцитов и их клеток-предшественников.
Установленные свойства цитиколина представляются особенно актуальными и в отношении лечения депрессий у пожилых пациентов, у которых наряду с депрессивными расстройствами часто выявляются признаки нерезко выраженной нейродегенеративной или церебрально-сосудистой патологии и когнитивного дефицита. Выявленную в данном исследовании способность цитиколина повышать эффективность собственно антидепрессивной терапии, вероятно, можно связать с нормализацией гемодинамических, гипоксических и метаболических процессов, сопровождающих развитие поздних депрессий. В последние годы у пожилых депрессивных больных были выявлены изменения мозгового кровотока, снижение плотности нейронов, содержания мозгового нейротрофического фактора (BDNF), нарушение метаболизма фосфолипидов [35, 36].
Цитиколин способен восстанавливать поврежденную мембрану клеток за счет ингибирования действия фосфолипаз, уменьшает гипоксию мозга, препятствует образованию свободных радикалов и даже предотвращает гибель клеток, воздействуя на механизмы апоптоза, что позволило включить его применение в терапию ишемического инсульта. Его использование позволяет уменьшать зону пенумбры, ускорять процесс восстановления уровня сознания и сокращать период реабилитации вплоть до способности самостоятельно передвигаться, а также время нахождения в стационаре [37].
В настоящее время цитиколин включен в стандарты лечения ишемического инсульта.
Повышение эффективности антидепрессивной терапии также можно объяснить способностью цитиколина улучшать переносимость психотропной терапии пожилых депрессивных больных за счет устранения нейротоксического эффекта [38, 14], что способствует преодолению явлений псевдорезистентности антидепрессивной терапии пожилых пациентов.
В большинстве исследований установлена хорошая переносимость цитиколина, отсутствие каких-либо значимых побочных эффектов в различных выборках пациентов, что позволяет рекомендовать данный препарат для длительного курсового лечения.
Выводы
Сравнительный анализ эффективности монотерапии одним из современных антидепрессантов и комплексной аналогичной антидепрессивной терапии в сочетании с цитиколином показал, что лучшие результаты были достигнуты больными, получавшими комбинированную терапию.
Полученные результаты позволяют сделать следующие выводы:
- применение комбинированной терапии дает возможность добиться более быстрого развития терапевтического ответа и более выраженного эффекта по сравнению с монотерапией антидепрессантом, что подтверждается более значимой редукцией депрессивных расстройств по всем оценочным тестам в группе больных, получавших комбинированную терапию. Статистически значимые различия между группами отмечались по большинству из применявшихся оценочных шкал уже через месяц терапии;
- более выраженное улучшение когнитивного функционирования также отмечено в группе больных, получавших комбинированную терапию: статистически достоверное улучшение когнитивных функций по всем тестам, отражающим уровень когнитивной деятельности (MMSE, тест запоминания 10 слов и рисования часов), было зарегистрировано к окончанию терапевтического курса лишь во 2-й группе больных;
- установлены различия в профиле переносимости моно- и мультимодальной антидепрессивной терапии у госпитализированных пожилых больных депрессией в виде уменьшения частоты нежелательных эффектов у больных, пролеченных цитиколином в сочетании с антидепрессантом.
Полученные результаты позволяют рекомендовать комбинированную антидепрессивную терапию (сочетание антидепрессанта с цитиколином) для применения в стационаре с целью достижения более быстрого и полного терапевтического ответа, снижения риска возникновения нежелательных эффектов антидепрессивной терапии и сокращения сроков госпитализации.



