Вструктуре онкологической заболеваемости колоректальный рак (КРР) занимает 3-е место в мире после рака легкого и рака молочной железы. В 2012 г. зарегистрировано около 1 млн 400 тыс. новых случаев КРР и около 700 тыс. смертей от этого заболевания [1].
В России отмечается ежегодное увеличение заболеваемости КРР при относительно стабильном уровне смертности [2]. Среди лиц с впервые установленным диагнозом КРР удельный вес пациентов с IV стадией заболевания составляет 27,6% для рака ободочной кишки, 23,7% для рака прямой кишки. В различные сроки после удаления первичной опухоли метастазы выявляются почти у 50% больных [3]. Таким образом, более чем половине больных раком толстой кишки в различные сроки показано проведение системного противоопухолевого лечения по поводу диссеминированного процесса.
Появление в 1960-х гг. фторурацила (ФУ) – непрямого ингибитора тимидилат синтетазы – позволило увеличить медиану выживаемости больных диссеминированным КРР с 6 месяцев при симптоматической терапии до 11, а при длительных инфузиях препарата – до 14 месяцев [4].
Подробное изучение механизма действия ФУ и понимание роли подавления тимидилат синтетазы (ТС) в реализации противоопухолевого эффекта привели к созданию прямого ингибитора ТС – ралтитрекседа. В клетке препарат проходит стадию полиглютамизации с помощью фермента фолилполиглютаматсинтетазы (ФПГС), образованный комплекс ралтитрексед-полиглютамат подавляет активность ТС в 100 раз более эффективно, чем неглютамизированный ралтитрексед. Время внутриклеточной жизни комплексного соединения составляет более 24 часов [5]. На основании данных предклинических исследований и результатов I–II фаз определен оптимальный режим введения препарата в дозе 3 мг/м2 путем 15-минутной внутривенной инфузии каждые 3 недели [5, 6].
В рандомизированных исследованиях III фазы по сравнению ралтитрекседа и ФУ не было получено статистически достоверных различий в частоте объективных ответов, медианах времени до прогрессирования и общей выживаемости. Следует отметить лучшее качество жизни больных в группе ралтитрекседа. Так, клинически значимые побочные эффекты (III–IV степеней) были достоверно выше в группе ФУ/ЛВ (кальциум фолинат): стоматиты – 16 против 2% (р<0,0001), лейкопении 13 против 6% и диареи 19 против 10%. Терапия ралтитрекседом вызывала несколько большее число анемий и астений. Повышение уровня печеночных трансаминаз в группе ралтитрекседа (13%) обратимо и клинически не значимо [5, 7, 8]. Из приведенных выше данных следует, что ралтитрексед при равной лечебной эффективности с ФУ обладает более благоприятным токсическим профилем.
Представляется важным применение ралтитрекседа больными КРР, имеющими повышенный риск кардиоваскулярных осложнений. Проведенный анализ (The COMET study) показал эффективность и безопасность терапии ралтитрекседом больных, ранее получавших химиотерапию с включением ФУ, имеющих в анамнезе состоявшиеся эпизоды развития кардиологической токсичности либо повышенный риск развития кардиоваскулярных осложнений [9].
В отделении химиотерапии и комбинированного лечения злокачественных опухолей РОНЦ им Н.Н. Блохина проведены исследования по применению ралтитрекседа в комбинации с различными препаратами группы фторпиримидинов больными КРР с метастазами в 1-й линии химиотерапии. При применении режима ралтитрексед+ФУ (болюсно) объективный контроль болезни был достигнут в 58,5%. Медиана времени до прогрессирования составила 6,9 месяца. При использовании режима ралтитрексед+капецитабин частота частичного регресса (ЧР) составила 36,1%, длительной стабилизации (СТ [>6 месяцев]) – 38,9%, медиана времени до прогрессирования – 6,9 месяца. При применении режима ралтитрексед+фторафур общая частота лечебного эффекта составила 59,1% (ЧР – 36,4%, СТ>6 месяцев – 22,7%), медиана времени до прогрессирования – 8,6 месяца. При использовании комбинации ралтитрекседа с фторпиримидинами отмечена незначительная частота гематологической и гастроинтестинальной токсичности преимущественно 1–2-й степеней. Нейтропения 3-й степени не превышала 4,8%, 4-я степень встречалась менее чем в 1% случаев. Диарея 3-й степени отмечена не более чем в 5,7% случаев. Особенностью данных режимов служило возникновение у некоторых больных астении и повышение температуры в отсутствие признаков инфекций, связанных с ралтитрекседом [10–12].
На рубеже XX–XXI вв. свою нишу в лечении КРР заняли новые препараты с отличным от ингибиторов СТ механизмом действия. Важную роль сыграло появление нового препарата, иринотекана, – производного растительного алкалоида камптотецина, получаемого полусинтетическим путем. Это первый препарат, показавший более высокую, чем ФУ, активность при КРР. Иринотекан, являясь специфическим ингибитором клеточного фермента топоизомеразы I, и его активный метаболит SN-38 стабилизируют комплекс топоизомеразы I с ДНК в развернутом состоянии, что приводит к разрывам ДНК и препятствует ее дальнейшей репликации, в конечном итоге вызывая гибель опухолевой клетки. Иринотекан также способен ингибировать фермент антихолинэстеразу и тем самым активировать парасимпатическую иннервацию.
Дозолимитирующими побочными эффектами иринотекана служат нейтропения (III–IV степеней у 32–47% больных) и отсроченная диарея (III–IV степеней у 31–39% больных). Эти осложнения не носят кумулятивного характера и дозозависимы. Диарея в первые сутки после введения препарата как проявление холинергического синдрома легко купируется подкожным введением атропина [13]. К настоящему времени проведены многочисленные исследования, доказавшие эффективность иринотекана во 2-й линии терапии диссеминированного КРР как в монорежиме, так и в различных комбинациях [14–18].
Комбинация иринотекана и ралтитрекседа изучалась в исследовании I–II фаз на больных, не получавших ранее лечения по поводу диссеминированного КРР. Пациентам назначали различные дозы иринотекана (180, 200 или 250 мг/м2) в виде 30-минутной инфузии и стандартную дозу ралтитрекседа 2 мг/м2 в виде 15-минутной инфузии каждые 2 недели. Оценка терапевтического эффекта проводилась каждый цикл (5 введений) из максимально запланированных двух циклов. В исследование были включены 11 больных, проведено 68 введений химиопрепаратов, 8 больным полностью проведен 1 цикл, 3 больным – 2. Только у 1 пациента, получавшего иринотекан в дозе 180 мг/м2, зафиксирован случай дозолимитирующей токсичности в виде повышения уровня печеночных трансаминаз. Эффект был оценен в отношении 6 больных: полный эффект достигнут 1 пациентом, ЧР – 2, СТ – 2 больными, прогрессирование на фоне лечения зафиксировано у 1 больного [19].
Эффективность и переносимость режима иринотекан+ралтитрексед в 1-й линии химиотерапии больных КРР с метастазами были изучены в исследовании II фазы S. Chiara и соавт.
В исследовании участвовали 48 пациентов. Первым 16 больным внутривенно ввели иринотекан в дозе 350 мг/м2, день 1-й, ралтитрексед в дозе 3 мг/м2, день 2-й, каждые 3 недели. После предварительной оценки токсичности данного режима побочные эффекты 3–4-й степеней были зафиксированы у 38% пациентов, в связи с чем в дальнейшем у 38 пациентов дозы обоих препаратов были редуцированы на 15% (иринотекан 300 мг/м2, ралтитрексед 2,6 мг/м2). Всего было проведено 290 циклов химиотерапии. Общий ответ составил 27%, из них полный эффект зарегистрирован у 3 больных, ЧР – у 10 пациентов. Медиана времени до прогрессирования составила 5 месяцев, медиана общей выживаемости – 14 месяцев. У первых 16 больных среди основных побочных эффектов зафиксированы диарея 3–4-й (25%) степеней и нейтропения 3–4-й (13%) степеней. В отношении последующих 32 пациентов диарея 3–4-й степеней составила 34%, нейтропения 3–4-й степеней – 6%. Таким образом, в данном исследовании комбинация иринотекан+ралтитрексед показала свою эффективность, но в связи с выявленной токсичностью требует корректировки режима [20].
Данные литературы и собственный опыт применения режимов химиотерапии на основе ралтитрекседа вызвали наш интерес к изучению комбинации иринотекан+ралтитрексед во 2-й линии химиотерапии больных КРР с метастазами.
Материал и методы
Цель исследования – изучить эффективность и побочные эффекты комбинации иринотекан+ралтитрексед во 2-й линии химиотерапии метастатического КРР.
Режим химиотерапии: иринотекан 125 мг/м2 вводился в виде 90-минутной инфузии в 1-й и 8-й дни, ралтитрексед 2,6 мг/м2 – в виде 15-минутной инфузии после иринотекана в 1-й день. Цикл лечения составил 3 недели.
В исследование были включены 24 больных метастатическим КРР. Первичная опухоль была удалена у всех больных. Все больные имели морфологическую (гистологическую) верификацию диагноза. Средний возраст – 57,6 года.
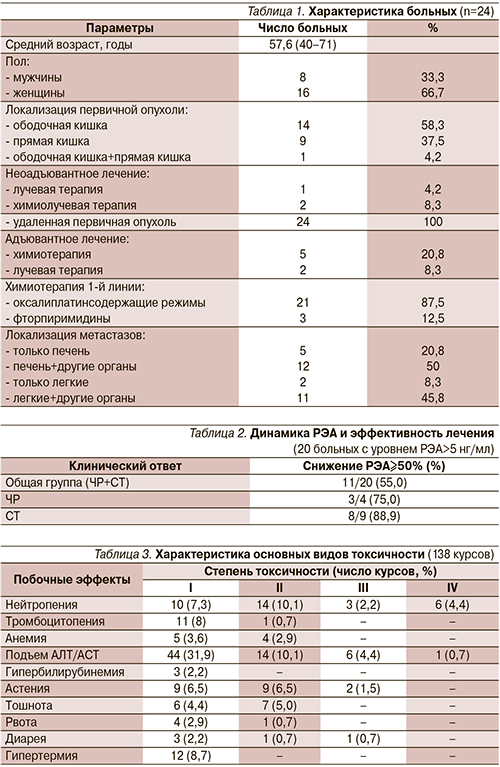
Адъювантная химиотерапия проведена в 20,8% случаев. Всем больным была проведена химиотерапия 1-й линии по поводу диссеминированной болезни; 21 (87,5%) больной получил оксалиплатинсодержащие режимы, 3 (12,5%) больных – химиотерапию на основе фторпиримидинов. Медиана времени до прогрессирования в 1-й линии химиотерапии составила 8,3 месяца. У 6 (25%) больных была достигнута ЧР, длительная СТ более 6 месяцев – у 10 (41,7%) больных.
К моменту назначения комбинации иринотекан+ралтитрексед 17 пациентов имели метастазы в печень±другие органы. Из них 4 страдали билобарным поражением с числом метастазов более 5. Размеры метастазов более 4 см отмечены у 8 (33,3%) больных, при этом у 2 пациентов размеры метастазов в печени достигали 11 см. У 13 пациентов диагностированы метастазы в легкие±другие органы. Число зон поражения ≥2 отмечено у 14 больных. Характеристика больных представлена в табл. 1.
Больные не имели противопоказаний к назначению цитостатической химиотерапии в соответствии с современными рекомендациями. Результаты лечения оценивали по RECIST-(response evaluation criteria in solid tumour)-критериям. Оценка токсичности проводимого лечения осуществлена в соответствии со стандартной шкалой токсичности CTCAE (Common, Terminology Criteria for Adverse Events) v.4.0.
Результаты
Всего было проведено 138 курсов химиотерапии.
Лечебный эффект оценен в отношении 24 больных: ЧР достигнута 4 больными, что составило 16,7%, СТ болезни более 4 месяцев зарегистрирована у 15 (62,5%) больных. Таким образом, контроль болезни достигнут 19 (79,2%) больными.
Медиана времени до прогрессирования составила 4,6 месяца, медиана общей выживаемости – 23,1.
Уровень раково-эмбрионального антигена (РЭА) определен для всех больных до начала лечения и в случае его исходного повышения свыше 5 нг/мл – каждые 2 курса. Повышенный исходный уровень РЭА зарегистрирован у 20 (83%) больных и составил в среднем 200 нг/мл. Значительное снижение РЭА на 50% и более было достигнуто 11 из 20 больных. Снижение маркера чаще сопровождало ЧР метастазов, что отмечено у 3 из 4 больных. При СТ болезни снижение РЭА более 50% отмечено в 8 из 9 случаев (табл. 2).
Побочные эффекты были изучены в период проведения 138 курсов 24 больным (табл. 3, 4).
При проведении химиотерапии наблюдалась токсичность, характерная для иринотекана и ралтитрекседа. Побочные эффекты 3–4-й степеней отмечены в 13,9% случаев в виде повышения уровня печеночных трансаминаз, нейтропении, диареи, астении.
Коррекция режима детально представлена в табл. 5.
Одновременная редукция дозы иринотекана на 20–30% и ралтитрекседа на 50% была проведена 5 больным.
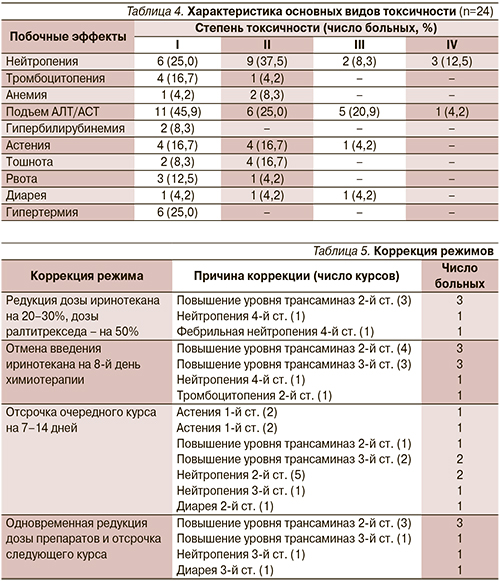
В связи с токсичностью отмена введения иринотекана на 8-й день химио-терапии была выполнена 8 больным на 9 курсах. Зарегистрирована отсрочка начала 14 курсов химиотерапии на 7–14-й дней для 9 больных. Одновременное снижение дозы препаратов и отсрочка начала следующего курса зарегистрированы в отношении 6 больных на 6 курсах. Астения III степени длительностью 4 дня отмечена дважды у 1 больного и не потребовала коррекции проводимой терапии.
Среди других побочных эффектов, не потребовавших коррекции проводимого лечения, отмечены анемия 1–2-й степеней, гипербилирубинемия 1-й степени, тошнота 1–2-й степеней, рвота 1–2-й степеней, повышение температуры тела 1-й степени без признаков инфекции сразу после введения ралтитрекседа.
Клинический случай
Больному П. 69 лет в июне 2007 г. в плане комбинированного лечения рака прямой кишки T3N2М0 (III ст.) проведена предоперационная химиолучевая терапия РОД 5 Гр (СОД 25 Гр) на фоне приема капецитабина 2500 мг/сут, 1–5-й дни, и двукратное введение метронидазола внутриректально в качестве радиомодификатора по 18 Гр. 26.07.2007 выполнена брюшно-промежностная экстирпация прямой кишки. Гистологическое заключение: умеренно дифференцированная аденокарцинома. В 6 лимфоузлах из 9 прилежащей клетчатки – метастазы аденокарциномы.
В декабре 2009 г. выявлены множественные метастазы в легких. По данным компьютерной томографии (КТ) органов грудной клетки: в S8/S9 нижней доли левого легкого очаги 2,4 и 2,7 см, в нижней доле правого легкого субплеврально – 1,6 см.
С 17.02.2010 по 26.03.2010 проведено 2 курса химиотерапии оксалиплатин+фторафур+кальциум фолинат. Отмечено прогрессирование болезни, увеличение метастазов в нижней доле левого легкого до 2,9 и 3,2 см, в нижней доле правого легкого субплеврально – до 2,1 см.
С 14.04.2010 по 26.01.2011 проведено 8 курсов химиотерапии: внутривенно иринотекан (125 мг/м2) – 200 мг 90 минут, дни 1-й, 8-й,+ралтитрексед (2,6 мг/м2) – 4 мг 15 минут, день 1-й. Цикл – 3 недели.
После 4 курсов химиотерапии отмечена стабилизация болезни. Побочные эффекты – повышение уровня аспартатаминотрансферазы (АСТ) 1-й степени, тромбоцитопения 1-й степени, гипербилирубинемия 1-й степени, нейтропения 3-й степени, в связи с чем начало 4-го курса было отложено на 9 дней.
После 6 курсов, по данным КТ органов грудной клетки, зафиксирована ЧР: очаги в нижней доле левого легкого – 2,6 и 2,3 см, в нижней доле справа субплеврально – 2,1 см. Побочные эффекты – гипербилирубинемия 1-й степени, нейтропения 1-й степени, повышение уровня печеночных трансаминаз 3-й степени на 5-м курсе, в связи с чем отменен 8-й день химиотерапии иринотеканом.
При контрольном обследовании после 8 курсов отмечается дальнейшая положительная динамика: в легких очаги в S8/S9 нижней доли слева 2,6 и 1,8 см, в нижней доле справа субплеврально не определяются. Побочные эффекты – повышение уровня АСТ 1-й степени.
08.04.11 пациенту выполнена нижняя лобэктомия слева и 28.04.11 – торакоскопическая клиновидная резекция нижней доли правого легкого. При гистологическом исследовании: метастазы аденокарциномы с признаками лечебного патоморфоза 1-й степени.
При регулярном динамическом наблюдении без проявлений болезни в течение 13 месяцев.
В мае 2012 г. при рентгенологическом исследовании органов грудной клетки выявлены множественные метастазы в легких размером до 1 см.
Таким образом, после неэффективного лечения оксалиплатином и фторафуром у больного с множественными метастазами рака прямой кишки в легких на фоне 2-й линии химиотерапии иринотекан+ралтитрексед достигнут частичный эффект, позволивший выполнить хирургическое лечение по удалению остаточных очагов в легких. При этом время до прогрессирования составило 25,4 месяца.
Заключение
Проведенное исследование показало высокую эффективность изученной комбинации ирино-текан+ралтитрексед во 2-й линии химиотерапии больных КРР с метастазами. Контроль болезни составил 79,2%, медиана времени до прогрессирования – 4,6, медиана общей выживаемости – 23,1 месяца. Токсичность 3–4-й степеней не превышала 14%.



