Папилломавирусная инфекция (ПВИ) – самая распространенная инфекция, передаваемая половым путем. В настоящее время доказана роль вируса папилломы человека (ВПЧ) в развитии таких осложнений, как предраковые поражения половых органов у женщин, рака различной локализации у мужчин и женщин, а также неблагоприятное воздействие на беременность и перинатальные исходы. ПВИ во время беременности приобретает особую актуальность; при этом частота регистрации всех типов ВПЧ у беременных женщин составляет 30–65%, а типов высокого онкогенного риска — 20–30% [1]. ПВИ может передаваться трансплацентарно и интранатально (в частности, ВПЧ 6 и 11 типов). Риск инфицирования прямо пропорционален тяжести инфекции (количеству вирусных частиц) и времени безводного промежутка в родах. Родоразрешение путем кесарева сечения (КС) не снижает риск инфицирования плода, что свидетельствует о преимущественно внутриутробном его заражении. Активные процессы, направленные на локальную иммуносупрессию, осуществляются в течение всей беременности в фетоплацентарном комплексе. В такой ситуации ПВИ является не только высоким риском развития ВПЧ-ассоциированной патологии на фоне физиологического иммунодефицита, но и возможности передачи ее от матери к ребенку во время родов [2].
Эстрогены и прогестерон увеличивают экспрессию ВПЧ в цервикальном эпителии и способствуют клеточной пролиферации и канцерогенезу. Из-за усиления васкуляризации, активного метаболизма в тканях, изменения микробиоценоза влагалища, снижения компенсаторных возможностей систем иммунитета повышаются риск заражения и заболеваемость различными инфекциями. При этом латентная ПВИ может перейти в субклиническую и клиническую формы. Во время беременности видимые кондиломы часто рецидивируют, имеют тенденцию к разрастанию, становятся рыхлыми, могут достигать гигантских размеров. А у детей интранатальное инфицирование может приводить к ювенильному рецидивирующему респираторному папилломатозу.
Возможно длительное течение ПВИ без клинических проявлений в форме вирусной персистенции (≥2 положительных результатов анализа на ВПЧ подряд в течение определенного периода) или вирусной латентности (эрадикации ВПЧ не происходит, однако вирус не определяется с помощью стандартных методов молекулярной диагностики, и инфекция может рецидивировать) [3]. При клинически латентном течении возможно чередование периодов эрадикации и рецидивов, что может привести к неверной оценке ВПЧ-статуса, если диагностика осуществляется на основании единственного анализа [4].
Несмотря на то что ПВИ рассматривается в качестве одной из ведущих причин неблагоприятных исходов беременности, таких как самопроизвольный аборт [5], преждевременные роды [6], а также ее осложнений [7], данные о механизмах и степени влияния ВПЧ на течение беременности до настоящего времени дискутируются. Не разработаны общепринятые подходы к ведению беременных с ВПЧ, профилактике возможных неблагоприятных влияний инфекции на ее исходы.
В исследованиях, проводимых зарубежными коллегами, подтверждается связь как мужского, так и женского бесплодия с наличием ПВИ, а также отрицательное влияние вируса на перинатальные исходы, такие как неразвивающаяся беременность, самопроизвольный выкидыш, преждевременные роды [8–10].
В литературе имеются данные, доказывающие, что при подтвержденной полимеразной цепной реакции (ПЦР) на ВПЧ у матери структурное повреждение компонентов последа в конце беременности определяется в 76,8% случаев и протекает с морфофункциональными признаками хронической плацентарной недостаточности, гипотрофии плода и осложнениями неонатального периода [11, 12].
Вакцинация против ВПЧ – единственная эффективная и безопасная мера первичной профилактики аногенитальных раков и бородавок. В связи с тем, что ВПЧ в основном передается половым путем, максимальная эффективность вакцинации против ВПЧ будет регистрироваться в том случае, если прививать население до контакта с этим вирусом (то есть дети и подростки в возрасте 9–14 лет до полового дебюта). Проведение полного курса вакцинации приводит к образованию специфических антител к четырем типам ВПЧ (6, 11, 16 и 18) более чем у 98% вакцинируемых. Всемирная организация здравоохранения (ВОЗ) осознает серьезность проблемы рака шейки матки (РШМ) и других заболеваний, вызываемых ВПЧ, и рекомендует включить плановую вакцинацию против ПВИ в национальные программы иммунизации [13].
В настоящее время профилактическая вакцинация против ВПЧ рекомендована ведущими профессиональными ассоциациями/организациями мира. С момента лицензирования в 2006 г. было использовано более 270 млн доз вакцин против ВПЧ. Более 90 стран во всем мире включили вакцину против ВПЧ в Национальные программы иммунизации, а в 20 странах внедрена гендерно-нейтральная стратегия вакцинации [14].
С 2007 г. в Московской области, так же как и в 30 регионах Российской Федерации, проводится программа «Вакцинопрофилактика онкологических заболеваний, вызываемых ВПЧ». На протяжении 10 лет Московская область накопила наибольший опыт в России по применению вакцины против ВПЧ; привито более 22 000 девочек-подростков в возрасте 12–17 лет и женщин до 45 лет. На сегодняшний день получены положительные результаты в снижении заболеваемости аногенитальными кондиломами (АГК) не только у девочек, проживающих в регионе, но и у всего населения Московской области [15, 16]. Глобальный совет экспертов по безопасности вакцин считает вакцины против ВПЧ в высшей степени безопасными. Никакой связи вакцинации против ВПЧ с негативным влиянием на фертильность, развитием аутоиммунных заболеваний или смерти не установлено [17].
Интересными являются данные о влиянии вакцины против ВПЧ на репродукцию. В 5 клинических исследованиях безопасности и эффективности квадривалентной вакцины не выявлено различий между группами в частоте беременностей, закончившихся рождением живого ребенка, гибелью плода, самопроизвольным абортом или рождением ребенка с врожденными пороками. При непреднамеренном введении вакцины беременным отмечена хорошая переносимость. По существующим в настоящее время данным, более 2000 женщин забеременели во время курса вакцинации без осложнений [18, 19].
Исследование в Новой Зеландии в период 2008–2014 гг. показало, что доля преждевременных родов у вакцинированных женщин значительно ниже, чем в группе пациенток, не прошедших вакцинацию. Однако риск мертворождения и развития преэклампсии (ПЭ) был одинаков в обеих группах [20].
Таким образом, проблема ПВИ во время беременности носит актуальный характер, а ввиду имеющихся профилактических возможностей нельзя упускать шанс сохранения репродуктивного здоровья женщин, что и нашло отражение в данной статье.
Цель исследования – изучить особенности течения беременности, родов и состояние новорожденных от ВПЧ-позитивных матерей и женщин, которым была проведена вакцинопрофилактика ПВИ в подростковом возрасте.
Материалы и методы
С целью изучения частоты распространения ВПЧ-ассоциированных заболеваний и гестационных осложнений у ВПЧ-позитивных и ВПЧ-негативных беременных пациенток после вакцинации проведено обследование 440 пациенток в возрасте от 18 до 36 лет.
В 1-ю группу вошли 320 беременных женщин, которые в подростковом возрасте были вакцинированы против ВПЧ, все пациентки оказались ВПЧ-негативными. Во 2-ю группу вошли 120 ВПЧ-позитивных беременных пациенток без вакцинопрофилактики и терапии ВПЧ. У всех пациенток проведен анализ репродуктивной функции, течения и исходов беременности, а также оценки состояния новорожденных.
Для изучения особенностей течения беременности использовали диагностику инфекций, передаваемых половым путем (ИППП), с помощью ПЦР, цитологический метод исследования мазков с экзо- и эндоцервикса, микроскопию мазков, ультразвуковое исследование плодов с допплерометрией, иммуногистохимическое (ИГХ) исследование ткани плаценты. Для оценки состояния новорожденных использованы оценка по шкале Апгар, признаки функциональной и морфологической зрелости, нейросонография. Все женщины были родоразрешены в условиях ГБУЗ МОНИИАГ.
Статистический анализ полученных результатов проведен с применением методов описательной и аналитической статистики: средние и относительные значения числовых показателей. Вероятность безошибочного прогноза составила не менее 95% (р<0,05).
Результаты
Средний возраст пациенток в 1-й группе составил 22,5 года, во 2-й – 26,5 года. Средний возраст коитархе в 1-й группе составил 17 (5) лет, во 2-й группе – 15,5 (2) года. В 1-й группе у 30% (n=96) пациенток была первая беременность, у 70% (n=224) – вторая и более. Во 2-й группе – 36,7% (n=44) пациенток указали на единственную настоящую беременность, а 63,3% (n=76) указали на две и более беременностей (табл. 1).
При первичном осмотре пациенток АГК выявлены у 80 (66,7%) пациенток 2-й группы, у беременных в 1-й группе кондиломы не обнаружены. Во 2-й группе с АГК у 38 в период гестации потребовалось радиоволновое удаление кондилом, у 1 пациентки это были гигантские кондиломы Бушке–Левенштейна, что потребовало дополнительной госпитализации и двухэтапного хирургического вмешательства с положительным результатом и возможностью родоразрешения через естественные родовые пути.
Результаты лабораторного обследования пациенток групп сравнения показали статистически значимые отличия по частоте выявления ИППП и нарушения биоценоза влагалища (табл. 2).
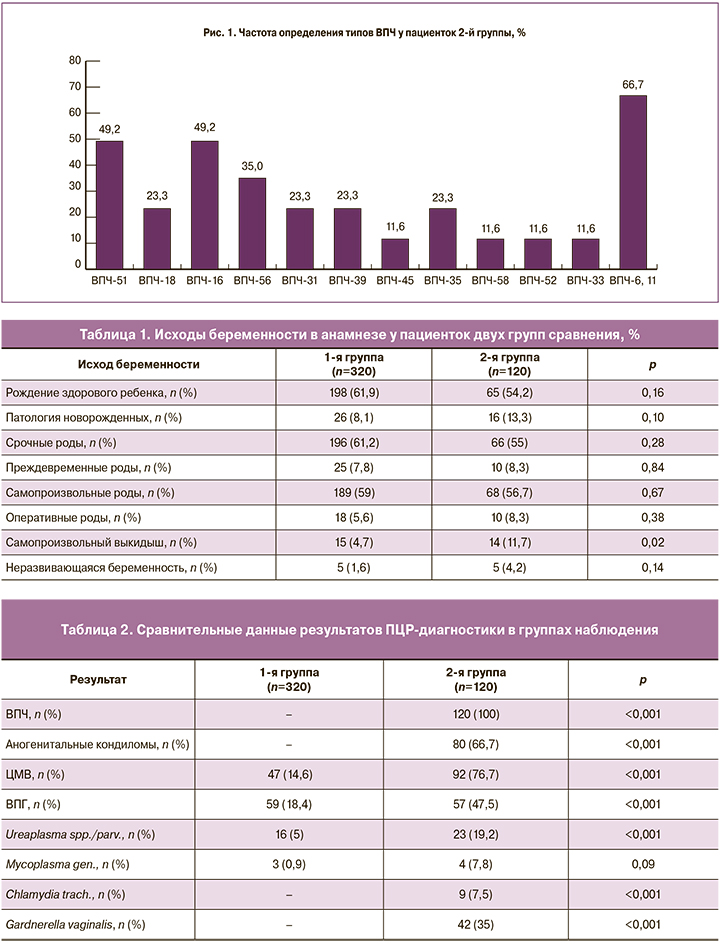
При проведении ПЦР-диагностики ВПЧ у пациенток 2-й группы был выявлен один или более типов ВПЧ (рис. 1).
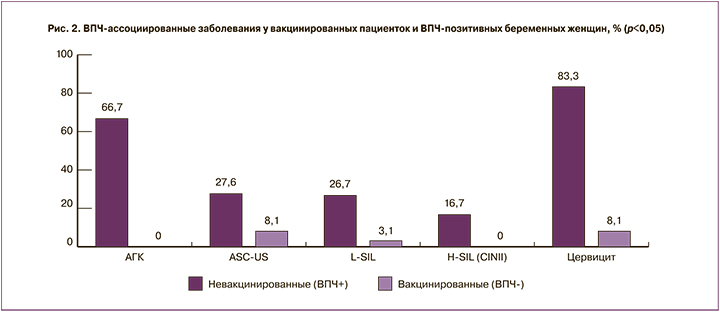
При проведении цитологического исследования мазков с экзо- и эндоцервикса ASC-US диагностированы у 27,5% (n=33) пациенток 2-й группы и у 8,1% (n=26) пациенток 1-й группы; L-SIL – у 26,7% (n=32) пациенток 2-й группы и у 3,1% пациенток (n=10) 1-й группы; H-SIL – у 16,7% (n=20) пациенток 2-й группы и не обнаружены в 1-й группе; признаки цервицита диагностированы у 83,3% (n=100) пациенток 2-й группы и только у 8,1% (n=26) пациенток 1-й группы (p<0,001 при всех сравнениях) (рис. 2).
При оценке течения беременности у пациенток в группах сравнения обнаружены статистически значимые различия.
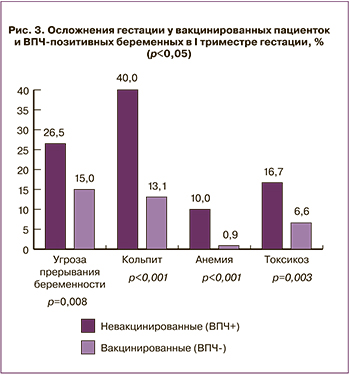 В I триместре у пациенток 2-й группы на 11,5% чаще была диагностирована угроза прерывания беременности, чем 1-й (26,5% (n=32) и 15% (n=48) соответственно, p=0,008), признаки кольпита были установлены также чаще у пациенток 2-й группы (40% (n=48) во 2-й группе и 13,1% (n=42) в 1-й, p<0,001), на 9,1% чаще во 2-й группе развилась анемия (10% (n=12) и 0,9% (n=3), p<0,001), а токсикоз разной степени выраженности был диагностирован во 2-й группе чаще, чем в 1-й группе на 10,1% (16,7% (n=20) и 6,6% (n=21) соответственно, p=0,003) (рис. 3).
В I триместре у пациенток 2-й группы на 11,5% чаще была диагностирована угроза прерывания беременности, чем 1-й (26,5% (n=32) и 15% (n=48) соответственно, p=0,008), признаки кольпита были установлены также чаще у пациенток 2-й группы (40% (n=48) во 2-й группе и 13,1% (n=42) в 1-й, p<0,001), на 9,1% чаще во 2-й группе развилась анемия (10% (n=12) и 0,9% (n=3), p<0,001), а токсикоз разной степени выраженности был диагностирован во 2-й группе чаще, чем в 1-й группе на 10,1% (16,7% (n=20) и 6,6% (n=21) соответственно, p=0,003) (рис. 3).
У пациенток 2-й группы II триместр гестации также осложнился большим количеством патологий: признаки многоводия были обнаружены у 13,3% (n=16) пациенток, что на 5,2% больше, чем в группе сравнения (8,1% (n=26)) (p=0,10), маловодия – у 16,7% (n=20) и 6,6% (n=21) пациенток 1-й и 2-й групп соответственно (p=0,003), ФПН диагностирована на 10,2% чаще также у пациенток 2-й группы (13,3% (n=16) и 3,1% (n=10) соответственно, p<0,001, угроза прерывания беременности на 15,2% была установлена чаще во 2-й группе пациенток и составила 33,3% (n=40) по сравнению с 1-й группой, где данная патология выявлена у 18,1% (n=58) женщин (p=0,001), признаки анемии диагностированы у 1,6% (n=5) и 13,3% (n=16) пациенток 1-й и 2-й групп соответственно (p<0,001); статистически значимых различий в формировании ПЭ в группах сравнения не наблюдалось, частота встречаемости составила 5% (n=16) в 1-й группе и 6,7% (n=8) у пациенток 2-й группы (p=0,49) (рис. 4).
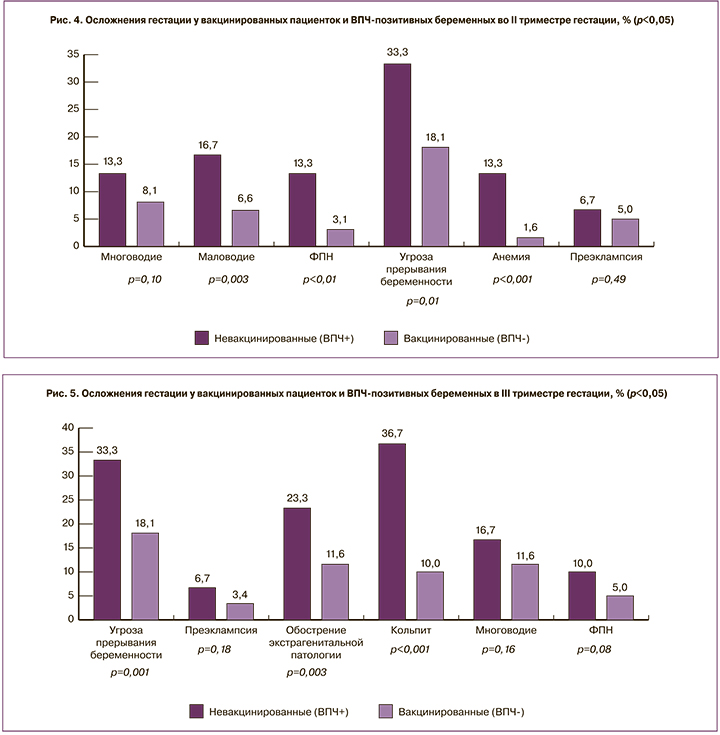
Анализ осложнений течения беременности в III триместре показал статистически значимые различия в группах сравнения: у пациенток 2-й группы угроза прерывания беременности диагностирована на 15,2% чаще (33,3 (n=40) и 18,1% (n=58)) (p=0,001), ПЭ встречалась в 2 раза чаще (6,7 (n=8) и 3,4% (n=11) соответственно, p=0,18), так же, как и обострение экстрагенитальной патологии (хронический пиелонефрит, бронхиальная астма, хронический гастродуоденит) (11,6% (n=37) в 1-й группе и у 23,3% (n=28) пациенток 2-й группы, p=0,003), кольпит диагностирован у 36,7% (n=44) пациенток 2-й группы против 10% (n=32) беременных 1-й группы (p<0,001), признаки многоводия выявлены у 16,7% (n=20) пациенток 2-й группы, что на 5,1% больше по сравнению с 1-й группой (11,6% (n=37)) (p=0,16); ФПН также в 2 раза чаще встречалась у пациенток 2-й группы (5 (n=16) и 10% (n=12) соответственно, p=0,08) (рис. 5).
Исходы беременности в группах сравнения также имели статистически значимые различия: во 2-й группе беременность на 16,7% чаще заканчивалась преждевременными родами, чем у пациенток 1-й группы (26,7% (n=32) и 10% (n=32) соответственно, p<0,001), однако срочными родами чаще закончились беременности у женщин 1-й группы (86,7 (n=277) и 63,3% (n=76) соответственно, p<0,001), у 33,3% (n=40) пациенток 2-й группы ВПЧ обнаружен в плаценте. На основании проведенного исследования плацентарной ткани ВПЧ-позитивных пациенток установлено: если в 1-й группе сравнения ВПЧ не выявлен вообще, то во 2-й группе он обнаружен у 40 (33,3%) обследованных женщин, что характеризовалось очаговой лимфолейкоцитарной инфильтрацией при сохранении достаточного уровня компенсаторных реакций (ангиоматоз, увеличение синцитиокапиллярных мембран в терминальных ворсинах). По более частому выявлению диссоциированного развития котиледонов, истончению синцитиотрофобласта ворсин, уменьшению притока крови через сосуды опорных ворсин констатирована начальная степень хронической плацентарной недостаточности (ХПН) или, по другой терминологии, – компенсированная ХПН. Такую общую морфологическую оценку подтвердила и ИГХ-визуализация ПВЧ, которая характеризовала состояние плацентарной ткани в составе воспалительных инфильтратов, промежуточном и инвазивном цитотрофобласте, а также в материнских макрофагах в межворсинчатом пространстве плацент, что свидетельствовало о несомненной инфицированности этим вирусом определенной части женщин 2-й группы.
На 6,7% чаще у пациенток 2-й группы диагностировано невынашивание беременности (10 (n=12) и 3,3% (n=11) соответственно, p=0,) (рис. 6).

Проведенный анализ клинического состояния новорожденных (табл. 3) показал, что частота всех патологических состояний в раннем неонатальном периоде была выше у новорожденных ВПЧ-позитивных матерей по сравнению с детьми, родившимися у женщин после вакцинопрофилактики (табл. 3). Более чем в 2 раза чаще новорожденные матерей 2-й группы рождались в состоянии асфиксии и с проявлениями ЗВУР, чем в 1-й группе (13,3% (n=16) и 5% (n=16) соответственно, p=0,006). Симптомы перинатального повреждения ЦНС статистически значимо чаще диагностировались у новорожденных матерей с ПВИ, чем у детей вакцинированных матерей (23,3% (n=28) и 5% (n=16) соответственно, p<0,001), причем у 50% новорожденных 2-й группы, даже клинически здоровых, при нейросонографии были выявлены патологические изменения в виде мелких кист в сосудистых сплетениях латеральных желудочков мозга и повышения резистентности мозговых сосудов. Кровоизлияния в кожу, как проявления локального геморрагического синдрома, имели место у 6,6% (n=21) детей 1-й группы и у 20% (n=24) – 2-й, (p<0,001). Неонатальную желтуху, которая требовала проведения фототерапии, в 2 раза чаще отмечали у новорожденных матерей с ПВИ по сравнению с детьми вакцинированных матерей (16,7 (n=20) и 8,4% (n=27) соответственно, p=0,02). Внутриутробная инфекция по сумме клинических и таких лабораторных симптомов, как лейкоцитоз и/или лейкопения, повышение нейтрофильного индекса, анемия, тромбоцитопения, повышение уровня С-реактивного белка, была диагностирована у 44 (36,6%) новорожденных ВПЧ-позитивных матерей и только у 11 (3,4%) детей, чьи матери были вакцинированы против ВПЧ (p<0,001). Врожденные пороки развития в виде малых аномалий (гипоспадия головки полового члена, полидактилия, гидроцеле) были выявлены у 3 (2,5%) новорожденных матерей 2-й группы и не были выявлены в 1-й группе (p=0,02).
Заключение
Анализ течения беременности и ее исходов у ВПЧ-позитивных матерей без лечения во время гестации и у ВПЧ-негативных пациенток, которым в анамнезе была проведена вакцинопрофилактика ВПЧ, показал статистически значимые различия в пользу вакцинированных женщин, что отражает актуальность комплексного подхода работы акушеров-гинекологов с подростками и молодыми женщинами по вопросам предгравидарной подготовки.
Проведение вакцинопрофилактики ВПЧ-ассоциированных заболеваний в подростковом возрасте до сексуального дебюта дает возможность защиты от инфицирования ВПЧ с момента коитархе, что, в свою очередь, не оказывает отрицательного влияния на репродуктивные возможности женщины и снижает риск развития ВПЧ-ассоциированных заболеваний и возникновения осложнений во время беременности, а также улучшает перинатальные исходы и предотвращает инфицирование новорожденных ВПЧ от ВПЧ-позитивных матерей.
Новорожденных от матерей с ПВИ необходимо обследовать с целью выявления ВПЧ для корректного диспансерного наблюдения и профилактики инфекционных осложнений в будущем.
ВОЗ подчеркивает серьезность проблемы заболеваний, вызываемых ВПЧ, для международного общественного здравоохранения и рекомендует включить ВПЧ-вакцины в национальные программы иммунизации. Таким образом, внедрение вакцинопрофилактики ПВИ в рамках календаря прививок у подростков является приоритетным направлением здравоохранения по улучшению репродуктивного здоровья населения как в Московской области, так и в России в целом.



