Введение
Несмотря на постоянное совершенствование протоколов иммуносупрессивной терапии, отторжение по-прежнему остается одной из основных причин утраты трансплантата в отдаленном периоде. К концу 1-го года после трансплантации почки число функционирующих трансплантатов составляет около 90%, к 5 годам снижается до 70%, к 10–15 – еще до 50% [1]. Одним из эффективных методов лечения стероидрезистентного отторжения является фотоферез (ФФ).
ФФ – это метод клеточной иммунотерапии, при котором из крови больного выделяют мононуклеарные клетки крови, сенсибилизируют 8-метоксипсораленом, затем, подвергая длинноволновому ультрафиолетовому облучению, возвращают обратно больному. ФФ впервые был предложен Richard Edelson в 1987 г. для терапии Т-клеточной лимфомы кожи [2]. Дальнейшее изучение данного метода показало его высокую эффективность при терапии псориаза, системной склеродермии, купировании реакции «трансплантат против хозяина», ревматоидном артрите и в ряде других заболеваний [3–5].
Данный метод показал высокую эффективность в лечении кризов острого и хронического отторжения при трансплантации сóлидных органов [5]. Высокая клиническая эффективность ФФ характеризуется прежде всего отсутствием тотальной иммуносупрессии, также при проведении данного метода не было выявлено развития каких-либо специфических осложнений. Многоцентровые исследования, посвященные использованию данного метода при трансплантации сердца, легких и стволовых кроветворных клеток, позволили рекомендовать ФФ в качестве терапии 2-й линии при развитии отторжения трансплантированных органов [4, 6].
Включение данного метода в стандартный иммуносупрессивный протокол на ранних этапах после трансплантации почки показало хорошие клинические результаты в течение первых 6 месяцев наблюдения [7].
Предполагается, что применение ФФ при трансплантации сóлидных органов способно приводить к формированию частичной иммунологической толерантности [4, 8]. По-прежнему остаются неясными длительность толерогенного эффекта этого метода в отдаленном посттрансплантационном периоде и функциональные особенности почечного трансплантата.
Материал и методы
Было проведено открытое когортное рандомизированное исследование, в которое были включены 60 пациентов с хронической болезнью почек 5Д-стадии. Всем пациентам была выполнена одногруппная трупная трансплантация почки. Пациенты были случайным образом рандомизированы в две группы. Все трансплантаты были парными, причем одну почку получал пациент основной группы, другую – группы сравнения. Тридцать пациентов основной группы получали стандартную иммуносупрессию и 10–15 сеансов ФФ в течение первых 6 месяцев после трансплантации. Пациенты группы сравнения получали только иммуносупрессивную терапию.
Конечные точки: основная – утрата трансплантата, суррогатные – число кризов отторжения, динамика концентрации креатинина в крови, скорости клубочковой фильтрации (СКФ) и суточной протеинурии.
Пациенты на момент включения не различались по основным клиническим показателям (табл. 1). В основе развития хронической болезни собственных почек на первом месте был хронический гломерулонефрит – 17 пациентов основной группы и 17 – группы сравнения, на втором месте – гипертонический нефросклероз у 5 и 2, на третьем – поликистоз почек у 2 и 4, на четвертом – хронический пиелонефрит у 2 и 2, на пятом месте – аномалия развития мочевой системы у 1 и 3 соответственно. Причиной хронической болезни почек для 3 пациентов основной группы послужила диабетическая нефропатия, для 2 пациентов группы сравнения – антифосфолипидный синдром. Срок наблюдения за пациентами составил от 1 до 7 лет, в среднем 4,5±2,0 года.
Развитие отторжения у пациентов с почечным аллотрансплантатом (ПАТ) мы оценивали по клинико-лабораторной симптоматике (внезапному повышению уровня креатинина, суточной протеинурии, снижению СКФ) при исключении иных причин дисфункции ПАТ, а также при проведении морфологического исследования. Всем больным выполнены протокольные биопсии через полгода после трансплантации, а также биопсии on demand при развитии дисфункции. Морфологическую оценку патологии ПАТ провели согласно международной классификации Banff 2007 г. [9].
Иммуносупрессивная терапия. Индукция осуществлена базиликсимабом в дозе 20 мг внутривенно до операции и на 4-е сутки после.
 Метилпреднизолон вводили внутривенно капельно во время трансплантации по 10 мг/кг, затем в 1-е и 4-е сутки по 250 мг.
Метилпреднизолон вводили внутривенно капельно во время трансплантации по 10 мг/кг, затем в 1-е и 4-е сутки по 250 мг.
Базовая иммуносупрессия: такролимус в стартовой дозе 0,12 мг/кг массы тела в сутки. Поддерживались общепринятые целевые концентрации препарата в крови [10]. Микофенолата мофетил применен в дозе 2 г/сут, преднизолон: стартовая доза – 30 мг/сут. При стабильной функции трансплантата с 14-го дня доза преднизолона снижалась по 2,5 мг в 3 дня до дозы 20 мг/сут к концу месяца. В отдаленном периоде после аллотрансплантации трупной почки (АТП) все пациенты придерживались стандартного трехкомпонентного иммуносупрессивного протокола, состоявщего из такролимуса, преднизолона и препаратов микофеноловой кислоты [10].
При развитии острого отторжения трансплантата больным проведена пульс-терапия с внутривенным введением метилпреднизолона по 250 мг в течение 4 последовательных суток. При развитии острого гуморального отторжения в отношении 1 пациента основной группы и 2 – контрольной помимо пульс-терапии метилпреднизолоном применялся антитимоцитарный глобулин в дозе 4 мг на 1 кг массы тела совместно с 3–5 сеансами каскадной плазмофильтрации.
Процедуры ФФ. Начинали проводить на 3–7-й день после трансплантации почки и продолжали их по следующей схеме: в первые 2 недели после трансплантации почки по 2 процедуры в неделю, следующие 6 недель – по 1 процедуре в неделю, в течение 3-го месяца – 1 раз в 2 недели, затем 1 раз в месяц в течение 4–6 месяцев после трансплантации почки. Суммарно получалось 15 процедур ФФ. Для осуществления фотосенсибилизации использовали аммифурин, рассчитанный в дозе 1 мг/кг массы тела, и принимался он пациентом за 2–3 часа до начала процедуры заготовки клеток крови. Сепарацию и накопление мононуклеарных клеток проводили при помощи аппарата «Haemonetics MCS+» (США). В течение одной процедуры заготавливали около 40–70 мл концентрата мононуклеарных клеток. Затем полученный концентрат клеток ресуспендировали в 200 мл 0,9%-ного раствора хлористого натрия. Клеточную взвесь подвергали ультрафиолетовому воздействию при длине волны 320–400 нм на аппарате «Юлия» (Россия) в течение 40 минут. Общая доза экспозиции составила 0,8–1,2 Дж/см2. После 90 минут инкубационного периода при температуре 20–24°С клетки реинфузировали пациенту в течение 30 минут.
Методы статистического анализа. Переменные, имеющие нормальное распределение, описывали как среднее±стандартное отклонение (M±SD). Для переменных с распределением, отличным от нормального, вычисляли медиану и интерквартильный размах.
При сравнении двух независимых выборок, имеющих нормальное распределение, применен непарный критерий Стьюдента с учетом равности дисперсий. Для попарного межгруппового сравнения двух выборок, имевших распределение, отличное от нормального, применены критерии Манна–Уитни (несвязанные выборки).
При анализе динамики креатинина, СКФ и протеинурии применяли двухфакторный дисперсионный анализ с повторными измерениями (RMANOVA) с двумя факторами – «время» и «группа». Апостериорные критерии проведены с помощью критериев Тьюки и Фишера.
Выживаемость оценивалась по методу Kaplan–Meyer. Значимость различий оценивали с помощью критериев Log rank (отдаленный период) и Breslow (ближайший период).
При определении относительного риска рассчитывали инцидентность в двух группах (отношение числа случаев к суммарному времени наблюдения), а затем рассчитывали их отношение (incidence rate ratio) с 95% доверительными интервалами (95% ДИ).
Расчеты произведены в программах SPSS v.23, Statistica v10 и GraphPad Prizm v.7.
Результаты
Всего у 23 больных основной группы и 20 – группы сравнения была отмечена первичная функция трансплантата.
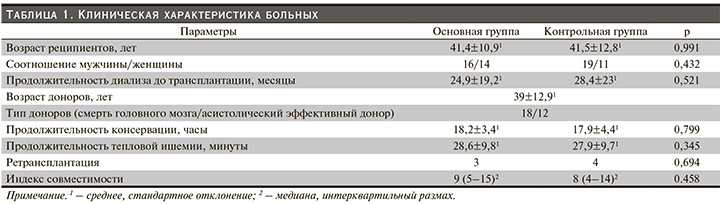
В среднем на 30-е сутки послеоперационного периода концентрация креатинина в основной группе составила 0,14±0,08, в группе сравнения – 0,17±0,12 ммоль/л, различия между группами были статистически незначимыми (р=0,19). Однако к 6 месяцам после АТП уровень креатинина в основной группе составил 0,15±0,06 ммоль/л, в группе сравнения – 0,19±0,06, при этом различия между группами стали статистически значимыми (p=0,017). Начиная с 6 месяцев после АТП средняя концентрация креатинина в основной группе значимо отличалась (была ниже) от таковой в группе сравнения на протяжении всего оставшегося срока наблюдения. Если в основной группе уровень креатинина оставался стабильным на протяжении всего срока наблюдения, в среднем 0,16±0,08 ммоль/л, то в группе сравнения уровень креатинина постепенно нарастал и к 5 годам составлял 0,24±0,09 ммоль/л. Как показал дисперсионный анализ с повторными измерениями, динамика креатинина в группах различалась статистически значимо (р=0,0129, рис. 1).
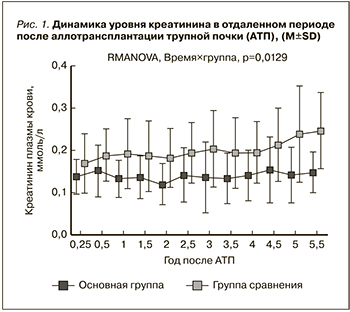
Уровень СКФ на 30-е сутки в основной группе составил 69±30, в группе сравнения – 52±28 мл/мин, что также было статистически незначимо (p=0,084). Различия по уровню СКФ, подобно уровню креатинина, стали статистически значимыми к 6 месяцам: в основной группе – 67±23 мл/мин, в группе сравнения – 48±19 мл/мин (p=0,013). В целом динамика СКФ в обеих группах имела тенденцию к снижению, однако на протяжении всего периода наблюдения СКФ в основной группе была выше. Динамика СКФ в группах различалась статистически значимо (p=0,011, рис. 2). К концу наблюдения (5,5 года) уровень СКФ в основной группе составил 63±17, в группе сравнения – 39±13 мл/мин.
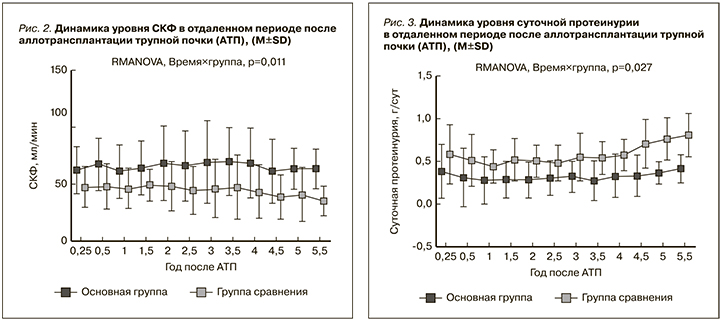
На 30-е сутки уровень суточной протеинурии в основной группе составил 0,61±0,29, в группе сравнения – 0,81±0,57 г/сут, различия были статистически незначимыми (p=0,21). Также не наблюдалось значимых различий через 6 месяцев после АТП (p=0,091): в основной группе – 0,41±0,38, в группе сравнения – 0,58±0,29 г/сут. Однако начиная с 1,5 лет после АТП и до конца наблюдения (5,5 года) различия между группами были статистически значимыми. Таким образом, общая динамика статистически значимо различалась в двух группах (p=0,027, рис. 3).
Благодаря включению ФФ в протокол иммуносупрессии в раннем послеоперационном периоде в основной группе функция ПАТ была значительно лучше, чем в группе сравнения. Это стало наиболее заметно на поздних этапах посттрансплантационного периода.
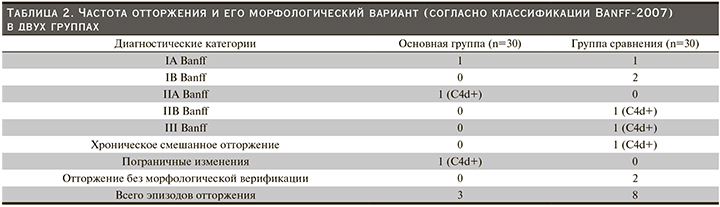
За весь период наблюдения у 2 из 30 пациентов основной группы (всего 3 криза) и у 7 из 30 пациентов группы сравнения (всего 8 кризов) выявлено отторжение (табл. 2). Морфологическая картина биоптатов ткани трансплантата соответствовала клеточно-опосредованному отторжению.
У многих мы также отметили свечение C4d-компонента комплемента, т.е. отторжение имело смешанный характер.
Несмотря на проведенную противокризовую терапию, двоим пациентам контрольной группы функцию ПАТ восстановить не удалось, в связи c чем были выполнены трансплантатэктомия и возврат пациентов на гемодиализ.
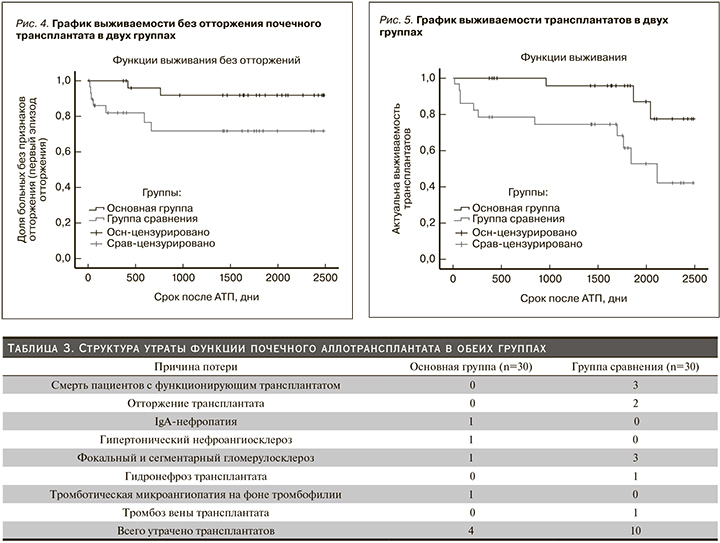
Инцидентность отторжения в основной группе составила 2,479 (95% ДИ – 0,631–6,748) на 100 пациенто-лет, в группе сравнения – 9,877 (4,587–18,75) на 100 пациенто-лет. Риск отторжения в основной группе был значительно ниже, чем в группе сравнения: incidence rate ratio – 0,2509 (95% ДИ – 0,05386–0,9167; р=0,0358). Беcсобытийная выживаемость (до первого криза отторжения) также была значительно выше в основной группе (Log Rank р=0,037; Breslow р=0,025, рис. 4).
Применение ФФ в основной группе позволило значительно снизить частоту случаев отторжения, а также его тяжесть в позднем посттрансплантационном периоде.
Из 60 пациентов, включенных в исследование, 14 утратили функцию ПАТ. Из них 4 пациента были из основной группы, 10 – из группы сравнения. Структура причин потерь ренальных аллотрансплантатов представлена в табл. 3. Трое пациентов группы сравнения умерли с функционирующим трансплантатом. Двое из них умерли вследствие тяжелой респираторной инфекции, возникшей на 2–3-й месяц после АТП, у третьего пациента возникла реактивация гепатита с развитием фульминантной печеночной недостаточности через 4,5 года после АТП.
Выживаемость трансплантатов в основной группе была значительно выше, чем в группе сравнения (Log Rank р=0,009; Breslow р=0,005, рис. 5).
Однолетняя выживаемость трансплантата в основной группе составила 100%, в группе сравнения – 80%, пятилетняя – 97 и 70% соответственно.
При оценке риска потери ПАТ за весь период наблюдения для основной группы инцидентность составила 3,307 (95% ДИ – 0,89–8,465) на 100 пациенто-лет, для группы сравнения – 11,89 (95% ДИ – 5,691–21,86) на 100 пациенто-лет. Таким образом, риск утраты трансплантата также был ниже в основной группе: 0,2782 (95% ДИ – 0,07562–0,8657; p=0,026).
Обсуждение
При анализе функции ПАТ в обеих группах нами установлено, что раннее применение ФФ улучшает процессы функционирования ПАТ – в основной группе наблюдается более низкий уровень креатинина и суточной протеинурии, а также более высокие показатели СКФ. Суточная протеинурия является не только косвенным показателем функции ПАТ, но и прогностическим маркером [11]. Так, к концу 1-го года после АТП у 13 пациентов группы сравнения и всего у 6 пациентов основной группы уровень суточной протеинурии составил >0,5 г/л, что может повышать риск утраты ПАТ в 4 раза. Различия в показателях почечной функции ПАТ между группами обусловлены преимущественно большей тяжестью хронической трансплантационной нефропатии у больных группы сравнения, что было подтверждено морфологическим исследованием трансплантатов.
В основной группе профилактическое применение ФФ помогло значительно снизить риски и тяжесть развития отторжения ПАТ. Такой протективный эффект ФФ при трансплантации сóлидных органов обусловлен формированием частичной иммунологической толерантности [4], при которой иммунная система реципиента воспринимает чужеродные антигены трансплантата как свои собственные. По мнению ряда авторов, иммунологическая толерантность к трансплантату сохраняется за счет влияния Т-регуляторных клеток, которые образуются в результате проведения курса ФФ и индуцируют апоптоз цитотоксических Т-лимфоцитов, направленных против тканей трансплантата [5, 12, 13].
Также ранее нами было продемонстрировано [14], что в раннем посттрансплантационном периоде в группе с ФФ по сравнению с группой сравнения отмечалось снижение содержания наивных Т-лимфоцитов, имевших фенотип: CD3+CD4+CD45RO-CD28+, а также снижение плотности экспрессии (MFI) молекул CD28+ на данной субпопуляции лимфоцитов к 30-м суткам после АТП. Это может указывать на снижение второго коактивационного пути Т-хелперных лимфоцитов, снижение активации Т-хелперных лимфоцитов, что в свою очередь приводит к снижению содержания специфических аллогенных Т-цитотоксических лимфоцитов.
Важно отметить, что ФФ не обладает дополнительным иммуносупрессивным или нефротоксичным действием, поэтому в основной группе за весь период наблюдения не было отмечено развития фатальных инфекционных осложнений, а пятилетняя выживаемость ПАТ была на 27% выше, чем в группе сравнения.
Полученные клинические результаты по эффективности профилактического применения ФФ при трансплантации почки диктуют необходимость проведения дальнейших исследований по изучению механизмов поддержания иммунологической толерантности.
Заключение
Применение ФФ на ранних этапах после трансплантации почки способствует улучшению клинических результатов в отдаленном посттрансплантационном периоде, снижает риск развития отторжения и риск потери почечного аллотрансплантата.



