Введение
Диагностика и лечение аортального стеноза (АС) определены действующими рекомендациями [1, 2, 3]. Согласно последним, тяжелым стенозом аортального клапана (АК) (в т.н. конкордантном варианте) считается симптомный или асимптомный АС, обладающий следующими характеристиками: максимальная скорость трансаортального кровотока (Vmax) ≥4 м/с, средний трансклапанный градиент давления (PGmean) ≥40 мм рт.ст., площадь отверстия АК (SАК) ≤1,0 см2, индекс SАК ≤ 0,6 см2/м2 [1–3].
Тактика ведения пациентов, прежде всего хирургическая, зависит не только от гемодинамических и размерных характеристик АС, но и от анализа клинической картины (симптомности/асимптомности), сопутствующей патологии, оценки функционального состояния миокарда, скорости прогрессирования порока, выраженности кальциноза и ряда других факторов.
Большинство научных публикаций последних лет посвящено обсуждению проблем сложных диагностических и клинических модификаций АС [4–9]. В частности, предложена гемодинамическая классификация АС по принципу градиент/поток в следующих вариантах [9]:
- высокий градиент/нормальный поток (high gradient/normal flow [HGNF]);
- высокий градиент/низкий поток (high gradient/low flow [HGLF]);
- низкий градиент/нормальный поток (low gradient/normal flow [LGNF]);
- низкий градиент/низкий поток (low gradient/low flow [LGLF]).
Низким градиентом считается показатель PGmean менее 40 мм рт.ст., высоким соответственно – более 40 мм рт.ст. Поток считается «низким» (low flow) при наличии следующих характеристик: интеграл линейной скорости трансаортального кровотока менее 15 см, индекс ударного объема (ИУОЛЖ) менее 35 мл/м2 или систолический поток (УОЛЖ/время изгнания) менее 200 мл/с [10]. Важно напомнить, что низкий поток может сопровождаться нормальным показателем процента фракции выброса левого желудочка (ФВЛЖ) [8]. Характеристики высокого (именно высокого, не «нормального») потока окончательно не определены.
Диагностика кальцинированных аортальных стенозов (КАС) у пациентов с терминальной хронической почечной недостаточностью (ТХПН), получающих лечение программным гемодиализом (ПГД), сложна, часто результаты ее оказываются неоднозначными. Это определяется тяжелой коморбидностью, быстрым прогрессированием порока и некоторыми особенностями центральной гемодинамики (ЦГД), обусловленными влиянием на нее функционирующей артериовенозной фистулы (АВФ). Влияние колебаний волемического статуса на оценку тяжести АС не столь существенно, т.к. определяющим патогенетическим гемодинамическим паттерном является увеличение постнагрузки. Объективизация тяжести аортальных стенозов у пациентов на ПГД особенно актуальна в контексте перспективы трансплантации почки (ТП), поскольку оптимальным сроком для проведения хирургической коррекции АС считается период до трансплантации [11, 12].
Авторы предлагают проанализировать гемодинамическую модель АС с высоким выбросом – высокий градиент/высокий поток (high gradient/high flow [HGHF]), явившуюся результатом изолированного влияния функционирующей АВФ с избыточным кровотоком на ЦГД у пациента после аллотрансплантации трупной почки (АТП). А также обсудить возможность создания диагностического алгоритма оценки тяжести АС у пациентов с функционирующей АВФ и возможности его экстраполяции на пациентов с АС, находящихся на ПГД.
Кальцификация и стенозирование АК
Кальцификация аортального клапана (КАК) представляет собой медленнопрогрессирующий патологический процесс отложения депозитов кальция в структуре фиброзного кольца и створок АК.
КАК широко распространена среди пациентов старшей возрастной группы, в 2000 г. число пациентов c КАК в развитых странах оценивалось в 2,5 млн, к 2030 г. предполагаемая цифра может достигнуть 4,5 млн [13].
Кальцинированный аортальный стеноз (КАС) – клапанный порок сердца, патоморфологическим субстратом которого является сужение (стеноз) отверстия АК в результате процесса его кальцификации. Согласно современным данным, 2,7–3,4% населения развитых стран старше 75 лет имеют установленный диагноз тяжелого стеноза АК [14, 15].

Кальцификация и стенозирование АК у пациентов с ТХПН, находящихся на ПГД
Пациенты, страдающие ТХПН, представляют собой отдельную субпопуляцию, имеющую колоссальные метаболические предпосылки для развития КАК [16]. Сочетание нарушения гомеостаза кальция и фосфора с хроническим воспалением, патологическим костным ремоделированием и снижением уровня ингибиторов процессов кальцификации создают ситуацию «идеального шторма», в результате которого происходит «вымывание» кальция из костных структур и отложение его депозитов по всему организму (т.н. метастатическая кальцификация) [17]. Одной из форм висцеральной внекостной кальцификации является скопление кальция в сердечных структурах – фиброзных кольцах и створках МК и АК, хордальном аппарате, в сердечной мышце [17–19].
Частота КАК среди пациентов ТХПН почти в 2 раза превышает таковую в общей популяции [20–22]. Согласно результатам ряда исследований, от 28 до 85% пациентов, получающих ПГД, имеют признаки КАК, от 6 до 13% – страдают тяжелым АС [23–32]. Средний возраст пациентов на ПГД, имеющих диагноз тяжелого КАС, – 52 года [11]. КАК и его трансформация в КАС напрямую зависят от продолжительности заместительной почечной терапии (ЗПТ), а именно – винтажа диализа [20, 21]. Немало важен тот факт, что скорость стенозирования АК вследствие его кальцификации у пациентов на ПГД более чем в два раза превышает таковую в общей популяции (уменьшение SАК на 0,23 см2 в год по сравнению с 0,05–0,1 см2 в год) [4, 11, 20]. Чем выраженнее КАК, тем быстрее происходит развитие КАС [34]. Согласно результатам исследования T. Kume et al. (2006), среди пациентов, получающих лечение ПГД, скорость прогрессивного увеличения показателя Vmax трансаортального кровотока и уменьшения SАК больше в группе КАК (0,37±0,36 и 0,17±0,29 м/с, 0,17±0,15 и 0,04±0,07 см2 соответственно) [35]. Таким образом, течение КАС у этих пациентов соответствует определению быстропрогрессирующего АС: увеличение Vmax более, чем на 0,3 м/с в год, при наличии кальциноза клапана [34]. Ряд исследований подтверждают, что наличие КАК у пациентов с ТХПН ассоциировано с высокой сердечно-сосудистой летальностью [36, 37].
Особенности оценки тяжести КАС у пациентов с АВФ, или почему рутинная оценка степени тяжести КАС может ввести в заблуждение
1) Каковы особенности ЦГД при функционировании АВФ?
Реализация гемодинамического эффекта функционирующей АВФ наступает практически сразу после ее формирования [38, 39]. Часть объема циркулирующей крови, минуя микроциркуляторное русло, шунтируется через АВФ из артериальной системы в венозную, что вызывает стойкое повышение венозного возврата и как следствие – увеличение сердечного выброса (СВ) и частоты сердечных сокращений (ЧСС). Артериовенозное шунтирование приводит к десатурации кислородом артериального сегмента кровообращения и артериализации венозного. Этот феномен в сочетании с повышением СВ обусловливает снижение периферического сосудистого сопротивления (ПСС) [40].
Таким образом, универсальными гемодинамическими последствиями функционирования АВФ являются увеличение СВ, падение ПСС, увеличение ЧСС.
Общепринятого понятия высокого сердечного выброса на настоящий момент не существует. Для обозначения статуса высокого сердечного выброса мы предлагаем опираться на критерии, предложенные I.S. Anand et al. [41]: СВ>8 л/мин, сердечный индекс (СИ)>3,9 л/мин/м2.
Гипердинамическая модель функционирования сердечно-сосудистой системы истощает компенсаторные возможности сердца – при определенных условиях неизбежными гемодинамическими последствиями функционирующей АВФ могут стать сердечная недостаточность с высоким сердечным выбросом (СНВСВ) и ее осложнения – развитие тяжелой диастолической дисфункции ЛЖ (ДДЛЖ), легочной гипертензии (ЛГ), дисфункции правого желудочка (ПЖ). Однако сроки реализации этих последствий и степень их выраженности варьируются в очень широких пределах и находятся в зависимости от исходного состояния сердечно-сосудистой системы пациента, длительности ПГД, сопутствующих заболеваний и избыточного кровотока по АВФ [42].
 Следует отметить, что не существует и общепринятых критериев статуса сердечной недостаточности с высоким сердечным выбросом. Для определения СНВСВ мы предлагаем опираться на критерии, предложенные P.A. Mehta et al. [40]: сочетание симптомов сердечной недостаточности с критериями высокого сердечного выброса (СВ>8 л/мин, СИ>3,9 л/мин/м2) и показателями сатурации венозной крови кислородом (SvO2)>75%. Следует упомянуть часто цитируемое в периодической медицинской литературе определение СНВСВ других авторов (MacRae et al.): сочетание симптомов сердечной недостаточности и подтвержденного высокого СИ (>3,0 л/мин/м2) [44].
Следует отметить, что не существует и общепринятых критериев статуса сердечной недостаточности с высоким сердечным выбросом. Для определения СНВСВ мы предлагаем опираться на критерии, предложенные P.A. Mehta et al. [40]: сочетание симптомов сердечной недостаточности с критериями высокого сердечного выброса (СВ>8 л/мин, СИ>3,9 л/мин/м2) и показателями сатурации венозной крови кислородом (SvO2)>75%. Следует упомянуть часто цитируемое в периодической медицинской литературе определение СНВСВ других авторов (MacRae et al.): сочетание симптомов сердечной недостаточности и подтвержденного высокого СИ (>3,0 л/мин/м2) [44].
2) Какой кровоток по АВФ расценивают как высокий или избыточный?
Известно, что СНВСВ, как правило, является следствием избыточного фистульного кровотока [38, 39]. MacRae et al. предлагают считать фистульный кровоток высоким при достижении значений 1500 мл/мин в сочетании с показателем кардиопульмональной рециркуляции (КПР), превышающим 25% [44]. Basile et al. полагают, что риск сердечной недостаточности возникает при достижении объемного кровотока по АВФ значения 2000 мл/мин [45]. КПР рассчитывается по формуле: КПР=УОF/УОЛЖ×100%, где УОF – ударный объем фистулы, рассчитываемый как VF/ЧСС (VF – объемный кровоток по АВФ), УОЛЖ – ударный объем ЛЖ (рассчитанный допплерографически). Однако окончательного общепринятого определения избыточного кровотока по АВФ не существует. Опираясь на личный опыт, следует признать, что развитие СНВСВ, как правило, происходит при превышении объемного кровотока по АВФ 2000 мл/мин, причем при оценке этого показателя обязательно следует учитывать поправку на площадь поверхности тела. Показатель КПР имеет очевидную диагностическую ценность, однако его клиническая интерпретация зачастую бывает неоднозначной на этапе формировании статуса высокого выброса или на начальном этапе формирования СНВСВ. Исходя из опыта авторов статьи, превышение КПР более 30% у пациентов со сформированным статусом высокого сердечного выброса безусловно приводит к симптомной сердечной недостаточности.
3) На какие параметры оценки степени тяжести АС влияет функционирующая АВФ?
Актуальная гемодинамическая тяжесть АС у пациента с функционирующей АВФ должна быть определена с учетом:
- Увеличения гемодинамических параметров, зависящих от величины потока (flow-depended), за счет увеличения СВ на фоне работы АВФ;
- Уменьшения параметров, характеризующих постнагрузку, за счет снижения периферического сосудистого сопротивления на фоне работы АВФ;
Общеизвестно, что оценка тяжести АС проводится с учетом СВ [1]. К гемодинамическим показателям, напрямую зависящим от величины СВ и рутинно измеряемым при проведении ЭхоКГ, относятся Vmax трансаортального кровотока и PGmean. Таким образом, анализ величин трансклапанных градиентов у пациентов с функционирующей АВФ должен проводиться с учетом ожидаемого их увеличения.
Практически важным представляется оценка параметров, характеризующих постнагрузку. Оцениваются ПСС, определяемое наиболее точно при катетеризации правых отделов сердца (КПОС), и показатели диастолического АД (АДд). Как было сказано выше, падение периферического сопротивления является одним из универсальных гемодинамических последствий функционирования АВФ, пониженное АДд также характерно для пациентов с функционирующей АВФ [46]. Перспективно определение податливости артериальной стенки (ПАС) (SAC в англоязычной литературе), вычисляемое по формуле: ПАС=ИУОЛЖ/АДс – АДд. Согласно данным Briand et al., снижение SAC<0,6 мл2×мм×Hg-1 наблюдается у 40% пациентов с АС и является дополнительным критерием тяжести АС, а также предвестником неблагоприятных сердечно-сосудистых событий [47]. Очевидно, что этот показатель для нашего контингента пациентов будет, напротив, повышен.
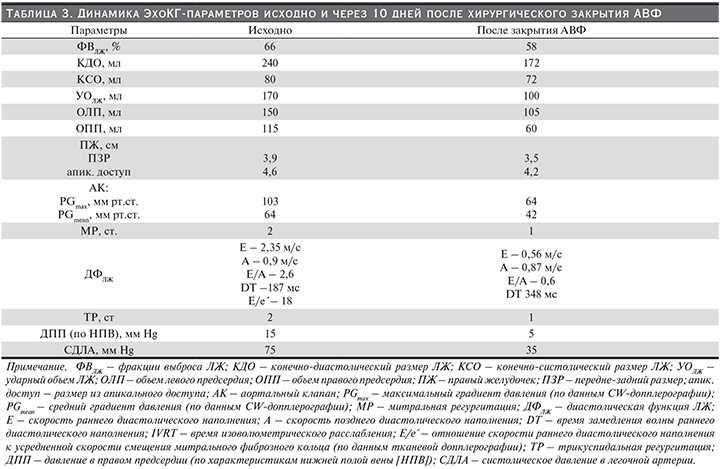
Отдельно следует остановиться на вальвулоартериальном импедансе (ВАИ) (ZVA в англоязычной литературе). Считается, что ВАИ отражает глобальную гемодинамическую нагрузку на ЛЖ (клапанную и артериальную – суммарно) и рассчитывается по формуле, предложенной Garcia et al. [51]: ВАИ=(АДс+PGmean)/ИУОЛЖ. Значения 3,5–4,5 мм Hg×мл1×м2 соответствуют умеренной, 4,5 мм Hg×мл-1 мл2 и выше – тяжелой степени гемодинамической нагрузки на ЛЖ [4, 48]. ВАИ свыше 4,5 является дополнительным критерием тяжести АС, предиктором дисфункции ЛЖ и неблагоприятных исходов для пациентов с АС [48, 49]. Поскольку при расчете данного показателя учитывается и средний трансклапанный градиент, и индекс ударного объема, т.е. параметры, зависящие от гемодинамического влияния АВФ на сердечно-сосудистую систему, динамика его изменений включена в представленный случай.
4) Что представляет собой проба с временной окклюзией АВФ?
Корректная оценка реального вклада функционирующей АВФ с избыточным кровотоком в изменения ЦГД основывается на результатах пробы с временной окклюзией сосудистого доступа. Во избежание механической травматизации сосудистого доступа предлагается либо тест 1-минутной манжеточной окклюзии (обычно проводится в ходе ЭхоКГ-исследования), либо 5-минутная манжеточная окклюзия (в ходе проведения КПОС). Кратковременное прекращение кровотока по фистуле при наложении манжетки тонометра проксимальнее функционирующей АВФ с его последующим восстановлением позволяет непосредственно у постели больного определить динамику ряда параметров ЦГД, измеряемых либо с помощью допплерографии, либо прямым инвазивным способом. Известно, что синдром СНВСВ может развиться при ряде заболеваний и патологических состояний, не связанных с наличием АВФ, а обусловленных стойкой периферической вазодилятацией. К последней могут привести хроническая гиперкапния у пациентов с заболеваниями легких, дефицит витамина В (болезнь берибери), гиперпродукция вазоактивных цитокинов при сепсисе и выброс вазоактивных субстанций при карциноидном синдроме; отдельного упоминания заслуживают тяжелая хроническая анемия и тиреотоксикоз [40]. В случае же критического снижения показателей СВ при проведении пробы с временной окклюзией АВФ причина развития СНВСВ становится очевидной.
Клиническое наблюдение
Пациент А. 61 г. находился на лечении в отделении нефрологии и патологии трансплантированной почки ГКБ № 52 Москвы с 31.10 по 11.11.2016.
 В анамнезе: в 1992 г. после отравления парами керосина во время службы в армии был диагностирован интерстициальный нефрит. В 2002 г. начато лечение ПГД в связи с формированием ТХПН. В 2005 г. проведена АТП, функция трансплантата немедленная, уровень креатинина в норме, пациент начал получать иммуносупрессивную терапию. В процессе дальнейшего наблюдения отмечалось прогрессирующее ухудшение функции трансплантата, в 2008 г. возобновлено лечение ПГД. В 2010 г. пациент перенес повторную операцию АТП, функция трансплантата немедленная, кризов отторжения не отмечалось, показатели креатинина в норме. Пациент получал иммуносупрессивную терапию, работал, с физическими нагрузками справлялся. Ухудшение самочувствия в виде прогрессирующего снижения толерантности к физическим нагрузкам началось за 2 месяца до госпитализации. Амбулаторное лечение без эффекта, госпитализирован в связи с появлением периферических отеков и нарастающей одышки при минимальных физических нагрузках и в покое.
В анамнезе: в 1992 г. после отравления парами керосина во время службы в армии был диагностирован интерстициальный нефрит. В 2002 г. начато лечение ПГД в связи с формированием ТХПН. В 2005 г. проведена АТП, функция трансплантата немедленная, уровень креатинина в норме, пациент начал получать иммуносупрессивную терапию. В процессе дальнейшего наблюдения отмечалось прогрессирующее ухудшение функции трансплантата, в 2008 г. возобновлено лечение ПГД. В 2010 г. пациент перенес повторную операцию АТП, функция трансплантата немедленная, кризов отторжения не отмечалось, показатели креатинина в норме. Пациент получал иммуносупрессивную терапию, работал, с физическими нагрузками справлялся. Ухудшение самочувствия в виде прогрессирующего снижения толерантности к физическим нагрузкам началось за 2 месяца до госпитализации. Амбулаторное лечение без эффекта, госпитализирован в связи с появлением периферических отеков и нарастающей одышки при минимальных физических нагрузках и в покое.
При физикальном осмотре: рост 188 см, вес 106 кг, массивные периферические отеки с признаками анасарки.
В легких дыхание справа ниже угла лопатки резко ослаблено, выслушивается небольшое количество рассеянных мелкопузырчатых хрипов. Границы относительной сердечной тупости расширены влево и вправо, над проекцией аортального клапана – рубый рокочущий пансистолический шум, иррадиирующий на сосуды шеи, II тон значительно ослаблен. Над верхушкой сердца выслушивается систолический шум иного тембра, проводящийся влево до задней подмышечной линии, I тон ослаблен. Отмечается акцент II тона над легочной артерией. При пальпации живота – увеличение размеров печени, признаки наличия свободной жидкости в брюшной полости. ЧСС – 75 уд/мин, ритм правильный, АД 180/80 мм рт.ст. Обращало на себя внимание присутствие на левой руке функционирующей проксимальной брахиоцефальной АВФ с аневризматической деформацией поверхностных вен плеча.
В анализах при поступлении: Hb 108 г/л, эритроциты 3,4×106, лейкоциты 8,3×106, СОЭ 10 мм/ч, К+5,8 ммоль/л, креатинин 208,86 ммоль/л, мочевина 20,1 ммоль/л. Суточная протеинурия 0,4 г/л, мочевой осадок без особенностей, показатели системного воспалительного ответа в норме, NT-pro-BNP более 35 тыс. нг/л.
На ЭКГ – синусовый ритм, признаки гипертрофии ЛЖ.
R-графия ОГК – картина застоя по малому кругу кровообращения вплоть до признаков отека легких, двусторонний гидроторакс, преимущественно справа.
Таким образом, учитывая удовлетворительную функцию трансплантата и отсутствие протеинурии, нефрологическая патология как причина отечного синдрома была исключена. Поскольку при поступлении имела место развернутая клиническая картина тяжелой застойной сердечной недостаточности (ЗСН) в рамках IV ф.к. (NYHA), дальнейший диагностический поиск был сосредоточен на уточнении ее генеза.
Трансторакальное ЭхоКГ-исследование выявило сохранную систолическую функцию обоих желудочков (ФВЛЖ 66% [по модифицированному методу Simpson], TAPSE 2,0 см), УОЛЖ, вычисленный методом допплерэхокардиографии, составил около 170 мл. При ЧСС 62 уд/мин и площади поверхности тела 2,32 м2, СВ – 10,5 л, СИ – 4,5 л/м2. Определялась выраженная концентрическая симметричная гипертрофия миокарда ЛЖ (индекс массы миокарда ЛЖ [ИММЛЖ] – 211 г/м2, относительная толщина стенки ([ОТС] – 0,53), значительная дилатация левых отделов сердца (индекс конечно-диастолического объема [ИКДО] – 103 мл/м2, индекс объема левого предсердия [ИОЛП] – 65 мл/м2). Определялись выраженный кальциноз кольца и створок АК, кальциноз кольца МК с формированием комбинированного аортально-митрального порока сердца: тяжелый сочетанный аортальный порок (PGmax – 103 мм Hg, PGmean – 64 мм Hg, аортальная регургитация 1-й ст.), умеренная недостаточность МК. При импульсноволновом допплеровском исследовании и методом тканевой допплерографии получены характеристики трансмитрального кровотока (ТМК), соответствовавше нарушению диастолической функции (ДФ) по рестриктивному типу с косвенными признаками повышения конечно-диастолического давления в ЛЖ. Кроме того, была выявлена дилатация правых отделов сердца, в большей степени – правого предсердия (ПП) (площадь ПП – 30 см2), ЭхоКГ-признаки выраженной легочной гипертензии (ЛГ) – систолическое давление в легочной артерии (СДЛА) составило 75 мм рт.ст. (пиковый градиент трикуспидальной регургитации [ТР] – 60 мм рт.ст., максимальная скорость – ТР 3,9 м/с при диаметре нижней полой вены [НПВ] 2,8 см и коллабировании при вдохе менее 50%), ТР 3-й ст. Данных за наличие внутрисердечного шунтирования крови не получено. Определялось значимое уплотнение листков перикарда.
Результаты ЭхоКГ-исследования в совокупности с клинической картиной подтвердили наличие у пациента кальцинированного комбинированного аортально-митрального порока сердца с преобладанием тяжелого симптомного стеноза АК. Однако высокие показатели CВ и СДЛА у пациента с функционирующей проксимальной АВФ заставили продолжить диагностический поиск с целью определения влияния АВФ per se на показатели ЦГД у пациента с тяжелым сформированным пороком сердца. На первом этапе методом дуплексного сканирования была определена объемная скорость кровотока по фистуле: VF=4500 мл/мин при ЧСС 63 уд/мин. Таким образом, УОF составил 72 мл, КПР – 42%, что существенно превосходило допустимые значения.
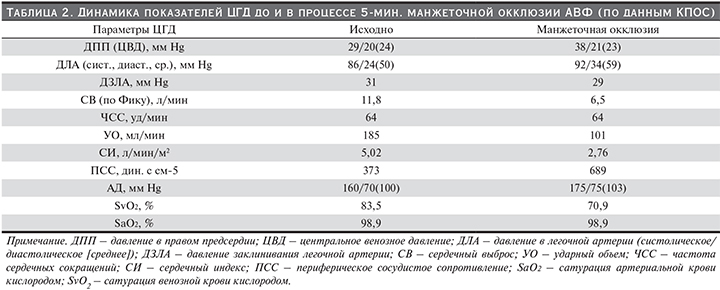
Полученные данные свидетельствовали о вероятном существенном негативном влиянии функционирующей АВФ на показатели ЦГД и послужили основанием для проведения пробы временной 1-минутной манжеточной окклюзии сосудистого доступа (результаты представлены в табл.1).
В результате проведения данной пробы было отмечено снижение УОЛЖ, соответственно, СВ и уменьшение PGmax и PGmean трансаортального потока. При этом наблюдался умеренный рост расчетного показателя ВАИ (ZVA). Таким образом, была установлена инструментальная составляющая CНВСВ, характерной для АВФ с высокой объемной скоростью кровотока и КПР, превышающей 25%. Полученные результаты позволили констатировать наличие у пациента двух взаимоотягощающих проблем: тяжелого симптомного КАС и СНВСВ вследствие избыточного фистульного кровотока. Показания к хирургической коррекции порока сердца были сформированы кардиохирургом (проф. Е.В. Ковалева НИИСМП им. Н.В. Склифосовского), но экстренность оперативного вмешательства с учетом тяжести ЗСН оставалась предметом обсуждения. Для окончательной оценки параметров ЦГД после получения информированного согласия пациента была произведена КПОС по методике Swan–Ganz.
Измерение прямых и расчетных параметров ЦГД осуществлялось до и в конце 5-минутной манжеточной окклюзии АВФ (табл. 2). Полученные результаты подтвердили аномально высокий СВ, а также обнаружили, что компрессия АВФ приводит к значительному уменьшению показателей СВ и УОЛЖ (на 45%) и росту ПСС (на 45%), а также снижению сатурации венозной крови (на 15% от исходной). Кроме того, был произведен забор венозной крови из ПП – сатурация кислородом была значимо увеличена и составила 82,6% (норма насыщения крови кислородом в ПП – 70–75%). Отсутствие динамики сатурации артериальной крови объяснялось тем, что КПОС проводилась на фоне инсуфляции кислорода ввиду тяжелого состояния пациента. Из представленных результатов видно, что в конце 5-минутной окклюзии АВФ наблюдалось некоторое увеличение показателей давления заклинивания легочной артерии (ДЗЛА) и давления в легочной артерии (ДЛА), что можно объяснить возникновением локального болевого синдрома и сопутствующим ему повышением системного АД к концу проведения пробы.
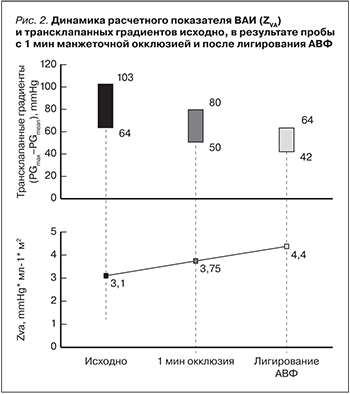
Полученные в ходе КПОС данные свидетельствовали о наличии у пациента тяжелой сформированной СНВСВ вследствие функционирования АВФ с избыточным фистульным кровотоком. В сложившейся ситуации очевидным представлялось взаимное отягощение АС и СНВСВ. С целью гемодинамической разгрузки миокарда было проведено окончательное хирургическое лигирование сосудистого доступа. В течение последующих 10 дней отмечена выраженная положительная динамика состояния пациента: прекращение одышки в покое, существенное увеличение толерантности к физической нагрузке, регресс функционального класса ХСН до II, полное разрешение периферических отеков, критическое снижение NT-pro-BNP до 12000 нг/мл. Результаты динамического ЭхоКГ-исследования представлены в табл. 3.
Элиминация клинико-инструментальных признаков СНВСВ после лигирования АВФ позволила пересмотреть актуальную стадию АС в обсуждаемом случае: из тяжелого симптомного с высокими трансаортальными градиентами АС трансформировался в асимптомный тяжелый. По согласованию с кардиохирургом пациент был включен в лист ожидания на хирургическую коррекцию АС и выписан в удовлетворительном состоянии с сохраненной функцией трансплантата.
Обсуждение
Диагностика и тактика ведения пациентов с тяжелыми кальцинированными клапанными пороками сердца является одной из актуальных проблем кардиоренальных взаимодействий и широко изучается [11, 12]. Тем не менее, существуют лишь единичные публикации, обсуждающие влияние АВФ на клиническую картину и инструментальную оценку тяжести АС [50, 51].
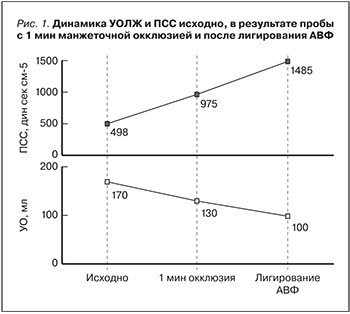
Интерес представленного случая определяется сосуществованием у конкретного пациента гемодинамической модели АС с высоким выбросом (высокий градиент/высокий поток (high gradient/high flow) и СНВСВ, развившейся в результате длительного функционирования АВФ с избыточным кровотоком. Определение гемодинамической «роли» АВФ в формировании тяжелых и неоднозначных изменений ЦГД было необходимо для объективизации клинико-инструментальной оценки тяжести АС. Включение в диагностический алгоритм пробы с манжеточной окклюзией АВФ, КПОС, а также последующее лигирование АВФ наглядно продемонстрировали влияние избыточного фистульного кровотока на ЦГД конкретного пациента. Этапные изменения некоторых гемодинамических параметров, трансклапанных градиентов и ВАИ представлены на рис.1 и 2.
Известно, что ЛГ и тяжелая ДДЛЖ являются независимы предиктором летальных сердечно-сосудистых событий для пациентов ХБП-5 [52–54], с одной стороны, и мощным отягощающим фактором при хирургической коррекции АС, с другой [55]. В связи с этим особый практический интерес представляет динамика ЭхоКГ-показателей, характеризующих ЛГ и ДФЛЖ. Купирование ЛГ и нормализация ДФЛЖ не только привели к исчезновению симптомов сердечной недостаточности у пациента, но и существенно снизили анестезиологические и периоперационные риски планируемого хирургического вмешательства.
Подводя практические итоги представленного случая и обобщая в некоторой степени клинический опыт авторов, представляется важным сформулировать ряд соображений, которые должны учитываться в работе с подобного рода пациентами:
- АВФ с избыточным кровотоком существенно влияет на показатели ЦГД, формируя симптомокомплекс СНВСВ, приводящий к развитию тяжелой ДДЛЖ и высокой ЛГ;
- АВФ с избыточным кровотоком маскирует истинную гемодинамическую стадию АС, а СНВСВ, развившаяся вследствие длительного функционирования АВФ с избыточным кровотоком, маскирует истинную симптомность АС;
- Сочетание тяжелого АС с СНВСВ имеет гемодинамические особенности в виде high-gradient/high flow [HGHF] паттерна;
- Проба с манжеточной окклюзией АВФ должна быть включена в протокол диагностических мероприятий для оценки роли АВФ в сложившихся нарушениях ЦГД и определения показаний к лигированию/сохранению АВФ;
- КПОС с одновременным проведением пробы 5-минутной манжеточной окклюзии является «золотым стандартом» диагностики влияния АВФ на показатели ЦГД;
- Лигирование АВФ с избыточным кровотоком позволяет точно оценить актуальную гемодинамическую тяжесть АС за счет снижения зависимых от потока (flow-depended) параметров и демаскирует истинную тяжесть гемодинамической нагрузки на ЛЖ;
- Наличие тяжелого АС должно рассматриваться как одно из показаний к лигированию АВФ у пациентов после АТП, а само лигирование АВФ с избыточным кровотоком – как мост к хирургической коррекции АС.
Особенностью проблемы клапанной кальцификации у пациентов, находящихся на ПГД, является быстрый и практически безальтернативный исход КАК в тяжелый КАС, который на практике нередко лишает пациента перспективы трансплантации почки. Понимание вышеописанных гемодинамических особенностей сочетания АС и СНВСВ, а также применение диагностического алгоритма оценки истинной тяжести АС позволят избежать конфликта определения времени оптимальной хирургической коррекции порока в контексте принятия решения о проведении трансплантации почки.



