Введение
До недавнего времени хроническую задержку мочи (ХЗМ) зачастую рассматривали в качестве осложнения доброкачественной гиперплазии предстательной железы, что в основном встречается у мужчин пожилого и старческого возраста [1–3]. Однако ХЗМ может также являться весьма распространенным и характерным осложнением ряда сосудистых, опухолевых, нейродегенеративных и демиелинизирующих заболеваний центральной нервной системы и носить нейрогенный (функциональный) характер. По данным R. Sakakibara и соавт. (1997), наиболее часто хронические нарушения мочеиспускания обструктивного характера встречаются при поражениях спинного мозга (экстра- и интрамедуллярные опухоли, инсульт спинного мозга, поперечный миелит, позвоночно-спинномозговая травма), реже наблюдаются у пациентов, страдающих заболеваниями головного мозга (ишемический инсульт) [4]. По мнению М.Р. Касаткина (1963), Н.А. Лопаткина (1998), J. Kesselring (1997), нейрогенная задержка мочи наряду с легочными осложнениями является ведущей причиной гибели неврологических больных вследствие прогрессирования хронической болезни почек и уросепсиса [5–7]. Постепенное нарастание признаков ХЗМ, по мнению R. Sakakibara и соавт. (1999), S.S. O’Sullivan и соавт. (2008), П.Г. Шварца (2015), характерно для первично- и вторично-прогредиентной форм рассеянного склероза (РС), опухолей спинного мозга и мультисистемной атрофии типа А [8, 9]. Необходимо отметить, что до настоящего времени недостаточно разработанными остаются клинические и уродинамические подходы к раннему выявлению нейрогенных обструктивных расстройств мочеиспускания, сопровождающихся наличием остаточной мочи, при демиелинизирующих заболеваниях нервной системы. Особенностью РС по сравнению с другими заболеваниями ЦНС (опухолевого, сосудистого и дегенеративного характера) является самая высокая вариабельность клинической картины, в т.ч. форм нарушения мочеиспускания, что обусловлено многоочаговостью поражения с вовлечением в процесс демиелинизации головного и спинного мозга [10]. Ниже представлена классификация основных форм нейрогенных нарушений мочеиспускания при РС, встречающихся в клинической практике.
Классификация нейрогенных нарушений мочеиспускания при РС (с учетом фаз мочеиспускания и уродинамических форм дисфункции НМП):
- Нарушения фазы накопления мочи:
- Дневная поллакиурия с императивными позывами и детрузорной гиперактивностью.
- Императивное недержание мочи с детрузорной гиперактивностью.
- Недержание мочи при напряжении (стрессовая инконтиненция).
- Нарушения суточных ритмов мочеиспускания:
- Дневная поллакиурия без императивных позывов и детрузорной гиперактивности.
- Изолированная ноктурия.
- Энурез простой.
- III. Нарушения инициации мочеиспускания:
- Псевдодиссинергия:
- позанезависимая форма (пирамидного происхождения);
- позазависимая форма (мозжечковая форма): в положении сидя (у женщин), в положении стоя (у мужчин).
- Гипотония детрузора (снижение сократительной активности детрузора):
- со снижением силы позыва (нарушение лобной и мозжечковой афферентации НМП);
- без снижения силы позыва (нарушение эфферентации НМП);
- извращенный позыв к мочеиспусканию (ощущение позыва как распирание внизу живота) – нарушение лобной афферентации НМП.
- Псевдодиссинергия:
- Нарушение продолжения мочеиспускания:
- Детрузорно-сфинктерная диссинергия (ДСД; данную форму можно отнести и к нарушению накопления [I], инициации [III] и окончания мочеиспускания).
- Нарушения мочеобразования:
- Ночная полиурия (поражение гипоталамуса).

Как следует из классификации, дисфункции мочеиспускания при РС представлены чувствительными, моторными, мозжечковыми, эндокринными расстройствами и нарушениями ритма физиологических функций. Таким образом, многообразие мочепузырных нарушений отражает общую клиническую картину заболевания. К развитию хронической нейрогенной задержки мочи (ХНЗМ), как правило, приводят гипотония детрузора (три ее разновидности), ДСД и псевдодиссинергия. До настоящего времени подходы к медикаментозной терапии больных ХНЗМ при рассеянном склерозе полностью не разработаны. По мнению большинства авторов, патогенетическая терапия не может рассматриваться как средство влияния на параметры мочеиспускания у пациентов с демиелинизирующими заболеваниями нервной системы [11, 12]. Поэтому одной из задач данного исследования стала разработка алгоритма симптоматической терапии расстройств мочеиспускания, основанного на анализе сохранности рефлексов, обеспечивающих нормальное функционирование нижних мочевых путей (НМП).
В табл. 1 представлены афферентные, эфферентные и центральные звенья рефлексов мочеиспускания (по F.J.F. Barrington(1925), М. Kuru (1964) и D.T. Mahony (1977), переработано и дополнено) [13–15].
Как видно из таблицы, нормальный акт мочеиспускания состоит из 4 фаз и воспроизводится посредством 12 рефлексов, афферентные и эфферентные звенья которых представлены в гипогастральном (симпатическом), тазовом (парасимапатическом) и сакральном (соматическом) сплетениях. Центральные звенья представлены специализированными ядрами (Баррингтона, Шеррингтона, Онуфа) и неспецифическими образованиями (нижнегрудные вставочные интернейроны, регулирующие сосудистый тонус на спинальном уровне, таламус, островок Рейля и др.), опосредующими различные этапы мочеиспускания.
Рассинхронизация этих центров вследствие центральной демиелинизации при РС лежит в основе описанного многообразия нарушений мочеиспусканий. Сходная вариабельность наблюдается на рецепторном и нейромедиаторном уровнях, которые являются мишенью фармакотерапии, направленной на улучшение нервного проведения в системе нарушенных рефлексов мочеиспускания.
Патогенетические механизмы псевдодиссинергии при РС и точки приложения лекарственной терапии
Псевдодиссинергия клинически проявляется затрудненным началом акта мочеиспускания. Данное состояние встречается при РС, ишемическом инсульте (мозжечковая и теменная локализация) и мультисистемной атрофии типа С (спиноцеребеллярная дегенерация). Различия как в самих заболеваниях, так и в локализации повреждений, приводящих к псевдодиссинергии, требуют уточнений.

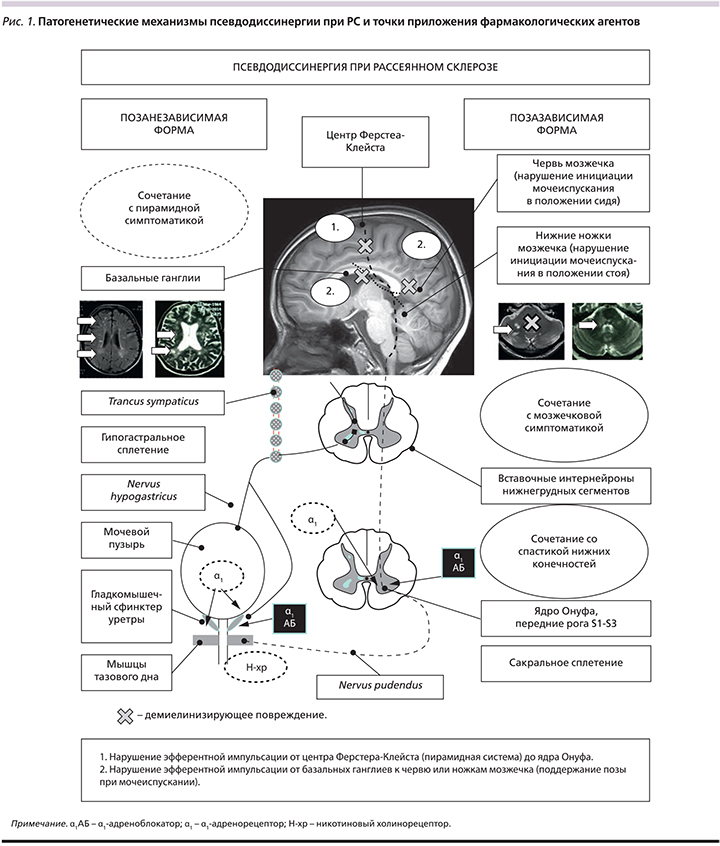
С этой целью приводим рис. 1, на котором изображены основные механизмы формирования этой формы нарушения мочеиспускания при РС (при других заболеваниях они будут другими).
Как видно из рис. 1, существует 2 механизма развития данного состояния:
- Нарушение эфферентной импульсации от центра Ферстера–Клейста (пирамидная система) до ядра Онуфа.
- Нарушение эфферентной импульсации от базальных ганглиев к червю или ножкам мозжечка (поддержание позы при мочеиспускании).
В первом случае эффекты α1-адреноблокатора будут носить центральный характер и воздействовать на постсинаптические рецепторы ядра Онуфа (соматический эффект), участвующего в произвольном начале и окончании мочеиспускания посредством мускулатуры тазового дна. Второй эффект обусловлен блокадой постганглионарных постсинаптических рецепторов на мышце уретрального сфинктера, облегчая его непроизвольное расслабление в начале мочеиспускания и в его продолжении. Возможно сочетанное применение миорелаксантов группы агонистов ГАМК (баклосан, бензодиазепины).
Патогенетические механизмы гипотонии детрузора (снижения сократительной активности детрузора) при РС и точки приложения лекарственной терапии
Как следует из представленной выше классификации, при РС клинически и уродинамически выявляются три варианта расстройства мочеиспускания, сопровождающиеся гипотонией детрузора (рис. 2). Первый из них, наиболее редкий при РС (3–5%), характеризуется наличием затрудненного мочеиспускания с натуживанием без сенсорных нарушений (позыв сохранен). Эта форма обусловлена нарушением проведения эфферентной импульсации (вследствие центральной демиелинизации) от островка Рейля к ядру Баррингтона (страдает моторная функция мочевого пузыря).
Вторая форма, встречающаяся несколько чаще, обусловлена нарушением афферентной импульсации от ванилоидных рецепторов мочевого пузыря к лобной доле. Ощущение распирания внизу живота формируется не в поясной извилине, а в коре мозжечка.
Третья форма проявляется снижением силы позыва и обусловлена интрацеребральными нарушениями афферентации на участке таламус – поясная извилина (снижение силы позыва). Фармакотерапия в этих случаях наравлена в первую очередь на восстановление позыва на мочеиспускание и активацию сокращения детрузора. С этой целью применяют антихолинэстеразные средства обра-тимого (пиридостигмин) и необратимого (дистигмин) действий. Эта груп-па лекарственных средств облегчает проведение нервных импульсов за счет накопления собственного ацетилхо-лина в синаптической щели холинергических синапсов (как мускариновых, так и никотиновых), а также улучшают проведение афферентных импульсов на «церебральном уровне».
Патогенетические механизмы ДСД при РС и точки приложения лекарственной терапии
Возможность существования описанных ранее в литературе «сакральных очагов демиелинизации при РС, приводящих к развитию гипотонии детрузора», вызывает большие сомнения, т. к. по логике самого заболевания их развитию должно предшествовать образование церебральных и спинальных грудных очагов, а это в свою очередь приводит к развитию ДСД, а не гипотонии. Так что, по нашему мнению, гипотония детрузора при РС – результат церебральной демиелинизации. ДСД в 75% случаев формируется к 3–6-му году заболевания вслед за предшествовавшим ей гиперактивным мочевым пузырем. Ирритативная симптоматика в виде императивного недержания мочи дополняется обструктивной с наличием прерывистой струи. На рис. 3 представлены основные механизмы формирования этого варианта нарушения мочеиспускания при РС. Важно отметить, что устаревшее представление о ДСД, как о локализованном поражении спинного мозга на нижнегрудном уровне, не выдерживает критики. В прошлых работах было показано, что состав рефлексов, нарушаемых при ДСД, входя три рефлекса, замыкаемые в т.ч. на уровне головного мозга (детрузор-ингибирующий рефлекс). «Полноценную» клиническую и уродинамическую картину ДСД можно наблюдать только у пациентов с поражением головного и спинного мозга.
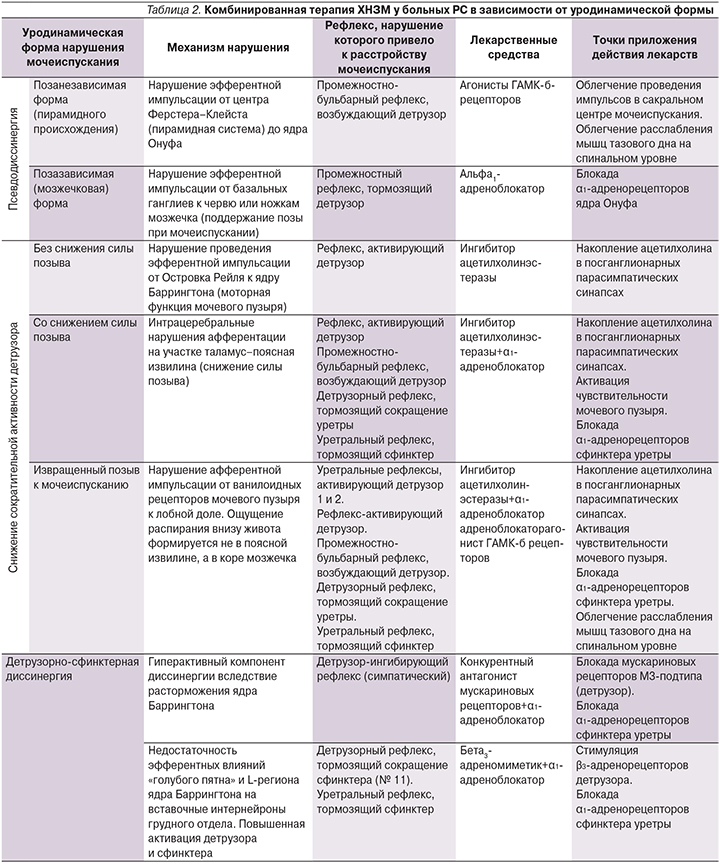
Дисфункции в системах трех различных рефлексов, приводящие к развитию у больного РС ДСД, требуют фармакологической коррекции комбинацией лекарственных средств из различных групп. Наиболее целесообразны сочетания α1-адреноблокатора с антихолинергическим (толтеродин и др.) или бета-адреномиметическим средством (мирабегрон) (табл. 2).
Следовательно, назначение средств лекарственной терапии не может быть эмпирическим, а должно определяться, исходя из выявленных нарушений в системах рефлексов мочеиспускания. В табл. 2 представлены результаты собственных наблюдений, касающихся комбинированной терапии ХНЗМ у больных РС в зависимости от уродинамической формы и выявленного дефицита рефлексов мочеиспускания. Как следует из табл. 2, в основе некоторых уродинамических форм лежат нарушения в системе одного рефлекса, а в других случаях их число может доходить до шести. В этом случае монотерапия оказывается неэффективной, и необходимо применить сочетание лекарственных средств с различными механизмами действия. Другой особенностью фармакотерапии является способность одного лекарственного средства оказывать действие в различных рецепторных системах. Проведенные ранее исследования с использованием уродинамических методов (профилометрия, урофлоуметрия) показали, что α1-адреноблокаторы могут оказывать преганглионарное действие на уровне ядра Онуфа, тем самым облегчая расслабление произвольной мускулатуры тазового дна (соматический отдел), и на постганглионарном уровне гипогастрального сплетения, обеспечивая расслабление гладкомышечного сфинктера уретры (симпатический отдел). Это позволяет облегчить проведение нервного импульса у пяти рефлексов мочеиспускания.
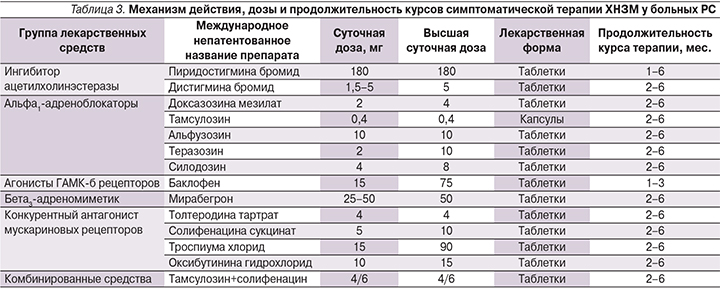
Наиболее эффективные сочетания комбинированной терапии ХНЗМ при псевдодиссинергии, различных вариантах гипотонии детрузора и ДСД на фоне РС также представлены в табл. 2.
Другой особенностью фармакотерапии является индивидуальная чувствительность и переносимость лекарственных средств, составляющих одну фармакологическую группу (например, α1-адреноблокаторы). Вариабельность индивидуальных реакций организма больного на сходные по строению или механизму действия средства определяет необходимость персонального подбора терапии.
В основу терапевтической тактики следует положить выявленные на диагностическом этапе нарушения в системах 12 рефлексов мочеиспускания.
В табл. 3, которая является продолжением табл. 2, представлены лекарственные средства различных фармакологических групп, данные об их дозировках и длительности курсов терапии.
Все вышесказанное определяет актуальность исследования данной проблемы как с научной, так и с практической точки зрения. Для иллюстрации фармакологической коррекции нарушений мочеиспускания приводим ниже результаты наблюдений за 50 больными, страдавшими ДСД на фоне РС.

Материал и методы
В исследовании принимали участие 50 больных РС цереброспинальной формы ремиттирующего течения, у которых ХНЗМ развилась на фоне сочетанного поражения головного и спинного мозга. Эти пациенты были разделены на две группы. Первую группу составили 30 пациентов, находившихся в периоде обострения, вторую – 20 больных в стадии ремиссии (неполной). Такое разделение пациентов на группы было обусловлено тем фактом, что на фоне гормональной терапии обострения РС метилпреднизолоном в редких случаях отмечалась положительная динамика в виде уменьшения симптомов НМП, но чаще наблюдались прогрессирование или стабилизация нарушений мочеиспускания.
В ходе исследования были выделены три этапа. На первом этапе изучали клинические проявления ХНЗМ у вышеуказанных групп больных. Оценивали частоту, характер и время наступления нарушений функции НМП у пациентов с ХНЗМ в зависимости от стадии РС. На втором этапе проводили корреляционный анализ между локализацией очагов демиелинизации (по данным магнитно-резонансной и компьютерной томографии головного мозга) и клиническими проявлениями расстройств мочеиспускания, а также клинико-уродинамические сопоставления. На третьем этапе оценивали эффективность и переносимость α1-адреноблокатора у больных РС с ХНЗМ. В данном исследовании применяли препарат доксазозина мезилат, механизм действия которого состоит в избирательном блокировании постсинаптических α1-адренорецепторов и расслаблении гладкомышечных волокон. Препарат применяли больные с нарушением произвольного расслабления поперечнополосатых мышц тазового дна и сократительной активности детрузора для облегчения начала мочеиспускания. В течение первой недели лечения, учитывая возможное снижение артериального давления, доксазозина мезилат назначали в дозе 1 мг на ночь. При хорошей переносимости препарата дозу увеличивали до 2 мг в сутки на ночь. Измерение артериального давления проводили 2 раза в день (утром и вечером) в течение первой недели приема препарата и 1 раз в неделю в последующем. Курс лечения составил 8–12 недель.
Результаты и обсуждение
У пациентов с РС отмечено наибольшее разнообразие клинической картины, обусловленное множественным характером поражения белого вещества головного и спинного мозга. Клинически отмечено сочетание императивных позывов и прерывистого характера мочеиспускания. При ДСД также нарушались рефлексы, обеспечивающие продолжение мочеиспускания (симпатические). Чувствительность НМП не страдала. Нарушения в реализации окончания мочеиспускания наиболее часто сочетались с нарушениями уретральной и глубокой чувствительности в нижних конечностях, со спастическим парезом нижних конечностей, что сопровождало клиническую картину рассеянного склероза (шейные, грудные очаги).
Сравнение клинической, уродинамической и нейровизуализационной картины ХНЗМ пациентов с РС позволило вычленить спинальный и церебральный компоненты «сфинктерной» и «детрузорной» задержки мочи, а также сенсорную и моторную ее составляющую. Необходимо отметить, что динамика появления и развития симптомов ДСД может указывать на очередное обострение заболевания. Поэтому анализ времени появления, характера и динамики симптомов нижних мочевых путей является важным этапом диагностики основного неврологического заболевания.
Появление новых очагов демиелинизации в ряде случаев приводило к смене формы нейрогенного нарушения мочеиспускания. Нами была отмечена закономерность, согласно которой по мере прогрессирования РС возрастает число пациентов с ДСД, что, по нашему мнению, связано с вовлечением в процесс демиелинизации проводников (в белом веществе) как головного, так и спинного мозга. Можно предположить, что в развитии ДСД важным моментом является разобщение не только спинальных центров мочеиспускания с ядрами Баррингтона, но и ядер Баррингтона с лобными центрами мочеиспускания. Также для формирования стойких нарушений мочеиспускания при РС, сохраняющихся после обострения в периоде ремиссии, по-видимому, важна симметричность повреждения проводящих путей головного мозга. Поэтому появление симптомов ДСД у пациента с РС должно стать показанием к проведению магнитно-резонансной томографии грудного отдела спинного мозга.
Пациентам с РС и ДСД в период обострения (n=21) и неполной ремиссии (n=12) доксазозина мезилат назначали на 12 недель ввиду относительно неблагоприятного течения (прогрессирования) заболевания.
При анализе эффективности и переносимости α1-адреноблокатора доксазозина мезилата оценивали следующие параметры мочеиспускания:
- Время отсроченного начала мочеиспускания (по данным урофлоуметрии), что косвенно указывало на связь центра Ферестера–Клейста с ядром Онуфа (нисходящие пути пирамидного тракта) и ослабление влияния рефлекса с ядра Онуфа на мышцы тазового дна («блокада симпатических влияний»).
- Параметры средней и максимальной скорости потока мочи при урофлоуметрии (блокада симпатических влияний нижнегрудных сегментов через подчревный нерв на гладкие мышцы уретры и шейки мочевого пузыря в процессе продолжения мочеиспускания).
- Показатели остаточной мочи по данным ультразвукового исследования (УЗИ) мочевого пузыря.
Ниже приведены результаты лечения пациентов с ДСД вследствие РС. На рис. 4 представлены показатели мочеиспучкания по данным УЗИ.
Как следует из рис. 4, на фоне приема доксазозина мезилата у пациентов с ДСД на фоне РС отмечено уменьшение времени ожидания мочеиспускания, достоверно изменились показатели скоростей мочеиспускания, что, вероятно, было обусловлено облегчением сокращения (предотвращением внезапного сокращения) гладкомышечных волокон уретры в фазу продолжения мочеиспускания, что позволяло больным помочиться за один прием. Также у пациентов отмечено уменьшение объема остаточной мочи. Вероятно, этот эффект был обусловлен облегчением сокращения (предотвращением внезапного сокращения) гладкомышечных волокон уретры в фазу продолжения мочеиспускания, что позволяло больным помочиться одной порцией. Следует отметить, что т.к. у пациентов с РС и ДСД нарушение мочеиспускания связано со спастикой непроизвольной мускулатуры уретры, усиливающейся в фазу продолжения мочеиспускания, больные не могут полностью помочиться «по команде» за 1 раз. Мы в 80% случаев наблюдали, как, вернувшись с УЗИ в палату, больные с «остаточной мочой» мочились без таковой. Поэтому в качестве практической рекомендации мы предлагаем при исследовании остаточной мочи у больных РС создавать условия для максимально комфортного мочеиспускания в непосредственной близости от аппарата УЗИ.
Заключение
ХНЗМ является характерным клиническим синдромом, сопровождающим РС и бывает следствием специфического повреждения центров и ассоциативных зон, регулирующих нормальное мочеиспускание, а также центральных проводников афферентных и эфферентных импульсов, обеспечивающих реализацию рефлексов мочеиспускания.
Важным условием восстановления самостоятельного мочеиспускания была сохранность центров мочеиспускания головного и спинного мозга, не затронутых заболеванием. Это позволило сделать предварительный вывод о том, что в основе регуляции мочеиспускания лежат не периферические механизмы (как считалось ранее), а центральные (спинальные и церебральные). Возможность реорганизации функций находится в прямой зависимости от наличия «парного» центра мочеиспускания (по отношению к пораженному), а также от образования «новых связей» в системе центральных нервных проводников или формирования «обходных путей» посредством аксон-рефлексов. От скорости формирования новых связей между центрами мочеиспускания зависит скорость наступления восстановления самостоятельного мочеиспускания. Это время берет отсчет от начала лечения и диктует продолжительность консервативной терапии, направленной на фармакологическую коррекцию нарушенного мочеиспускания (по сути, имитацию нормальной регуляции периферического звена регуляции мочеиспускания).



