Введение
Согласно классификации Международного общества по изучению сосудистых аномалий (International Society for the Study of Vascular Anomalies, ISSVA) пересмотра 2020 г., пиогенная гранулема (ПГ) относится к доброкачественным сосудистым опухолям и ее возникновение обусловлено мутациями в генах BRAF, RAS и GNA14 [1].
В 1844 г. клиническую картину ПГ в области десны верхней челюсти беременной женщины впервые описал американский челюстно-лицевой хирург Саймон Халлихен [2]. Термин «пиогенная гранулема» предложен в 1904 г. американским дерматологом Милтоном Бикслером Хартцеллом [3] и является общеупотребимым, однако в определенном смысле ошибочным, т.к. морфологически образование не является гранулемой и не связано с нагноением. Иногда в литературе можно встретить другие названия ПГ – лобулярная капиллярная гемангиома, ботриомикома, телеангиэктитаческая гранулема [4–8].
ПГ встречается с одинаковой частотой у детей обоих полов, во взрослом возрасте – чаще у женщин. Провоцируют ее появление мелкие травмы, порезы, уколы, ожоги, гормональные изменения, инородные тела, прием некоторых лекарственных препаратов [4, 6, 9–11].
ПГ может возникать на любом участке кожи и слизистых оболочек. Поражаться могут верхние конечности, нижние конечности, туловище, кожа головы. Наиболее распространенными локализациями ПГ являются лицо и шея, а также пальцы рук и ног [8, 12], что, по всей вероятности, связано с их частой травматизацией. ПГ в области ногтевых пластин (НП) сопровождается онихолизисом и может располагаться под НП и около нее, поражая как проксимальный, так и дистальный околоногтевой валик одного или нескольких пальцев [4, 5, 7, 13]. Появление околоногтевых ПГ может быть связано с хроническими дерматозами, например атопическим дерматитом и псориазом, а также являться осложнением хронической паронихии на фоне приема некоторых лекарственных препаратов: таксанов, ингибиторов рецепторов эпидермального фактора роста (EGFR), ингибиторов тирозинкиназы EGFR, ингибиторов тирозинкиназы, ингибиторов митоген-активируемой протеинкиназы MEK/ERK, ингибиторов BRAF (например, вемурафениба и энкорафениба), антагонистов CD20, ингибиторов фактора роста эндотелия сосудов, антиретровирусных препаратов и ретиноидов [7, 9, 13, 14].
ПГ слизистых оболочек чаще всего обнаруживается в ротовой полости в области десен, губ и языка, однако может поражать слизистую оболочку носа, влагалища, уретры, конъюнктиву глаз [4, 5, 15, 16]. ПГ может появляться на фоне гормональных изменений; в частности, описаны случаи ее возникновения на фоне приема комбинированных оральных контрацептивов с регрессией при их отмене [17]. ПГ в области десен у беременных носит название «epulis gravidarum», или «granuloma gravidarum», возникает обычно во втором или третьем триместрах беременности [4, 17] и, как правило, самостоятельно регрессирует после родов [8]. В настоящее время описано выявление ПГ на внутренней стенке вен [18], трахеи [19, 20], гортани [21]. ПГ могут располагаться на слизистой оболочке желудочно-кишечного тракта, становясь причиной анемии [13, 22, 23]. Описано появление ПГ на фоне других сосудистых мальформаций, например пламенеющего невуса [24, 25].
Клиническая картина и диагностика
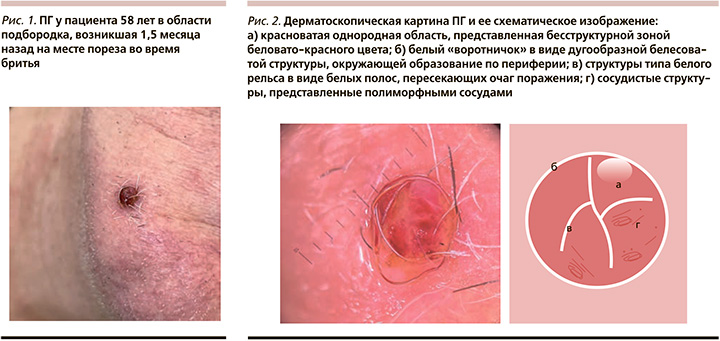
Клинически ПГ представляет собой солитарную, чаще безболезненную, приподнятую папулу с тонким или широким основанием (рис. 1). По периферии основания может определяться «воротничок» отслаивающегося эпидермиса, возникающий вследствие быстрого роста образования, «прорывающегося» через эпидермис. Цвет ПГ варьируется от желтого до ярко-красного, фиолетового или сине-черного; поверхность чаще гладкая, блестящая, иногда может быть папилломатозной или мацерированной. Окружающая кожа, как правило, не изменена. Консистенция ПГ мягко-эластическая или рыхлая, образование легко кровоточит при травматизации, вследствие чего на поверхности гранулемы может наблюдаться геморрагическая корка. Размеры ПГ, как правило, не превышают 1 см, изредка могут достигать 3–5 см. Для ПГ характерен быстрый рост в течение недель или месяцев, затем стабилизация в размере. Как правило, очаг одиночный, изредка поблизости могут появляться сателлитные очаги [7, 8, 13, 26]. Существуют единичные сообщения о диссеминированных формах ПГ, наблюдающихся, например, после ожогов [11].
Диагноз ПГ основывается на характерной клинической картине, данных анамнеза, дерматоскопии, в сомнительных случаях подтверждается биопсией с гистологическим исследованием материала. При морфологическом исследовании ПГ состоит из капилляров и венул с набухшими эндотелиальными клетками, разделенными на дольки фибромиксоидной стромой [13]. Набухшие эндотелиальные клетки подобно свежей грануляционной ткани окружены смешанной клеточной популяцией, состоящей из фибробластов, тучных клеток, лимфоцитов, плазматических клеток. Эпидермис истончен и атрофичен, при прогрессировании эрозирован и изъязвлен [7]. Эндотелиальные клетки ПГ экспрессируют CD34, ICAM-1, VCAM-1, ассоциированные с большим количеством микрососудов. В эндотелиальных клетках ПГ идентифицирована мутация BRAF c.1799T>A, являющаяся главной драйверной мутацией в ее патогенезе. Это в т.ч. объясняет возникновение множественных ПГ у пациентов, получавших ингибиторы BRAF [13].
При дерматоскопии ПГ наблюдается комбинация признаков в виде красноватой однородной области, белого воротничка, структур типа белого рельса, изъязвлений и сосудистых структур (рис. 2). Красноватая однородная область – это наиболее часто выявляемая дерматоскопическая структура. Она представлена бесструктурной зоной, цвет которой варьируется от полностью красного до красного с беловатыми участками, что гистологически коррелирует с наличием многочисленных мелких капилляров или пролиферирующих сосудов, расположенных в миксоидной строме гранулемы. Белый воротничок, дугообразная белесоватая структура, окружающая образование по периферии, наиболее специфична для ПГ, гистологически соответствует гиперплазированному эпителию по периферии поражения. Структуры типа белого рельса определяются как белые полосы, пересекающие очаг поражения, гистологически соответствуют фиброзным перегородкам, окружающим капиллярные конгломераты или дольки. Для ПГ специфичен дерматоскопический паттерн, состоящий из одновременной комбинации красноватой однородной области, белого воротничка и структур типа белого рельса. Сосудистые структуры присутствуют не всегда; они могут иметь вид линейных нерегулярных сосудов, полиморфных/атипичных сосудов, сосудов в виде шпилек, сосудов-точек. При выявлении в образовании, напоминающем пиогенную гранулему, сосудистых структур на фоне красноватой однородной области, необходимо проявлять настороженность в отношении беспигментной меланомы [27].
Дифференциальную диагностику ПГ необходимо проводить с беспигментной меланомой (БПМ) кожи, невусом Шпитц, лимфангиомой, ангиокератомой, ангиосаркомой, бациллярным ангиооматозом, саркомой Капоши, плоскоклеточным и базальноклеточным раком кожи [6, 7, 13, 27].
БПМ – редкая форма меланомы, которая встречается, по разным оценкам, в 2–8% случаев клинических форм меланом. Среди БПМ распространен узловой вариант. Выявление БПМ создает серьезную диагностическую проблему в связи с неспецифичностью клинических и дерматоскопических проявлений. Для диагностики БПМ, особенно узловых вариантов, классические критерии ABCDE (асимметрия, неровные границы, вариации цвета, диаметр более 6 мм, эволюция очага) не могут служить основой клинической диагностики, т.к. эти новообразования симметричны, с четкими границами и имеют один-два варианта цвета. Для диагностики узловатых меланом Kelly et al. было предложен акроним EFG (приподнятость, плотность, рост более 1 месяца), а McClain et al. – правило 3R (красный цвет [red], приподнятость [raised], недавние изменения новообразования [recent change]). При дерматоскопии беспигментных узловатых меланом выявляются атипичные сосуды (змеевидные, неправильные линейные, сосуды-точки, сосуды-шпильки), иногда может наблюдаться клинически неразличимая остаточная пигментация в виде атипичной сосудистой сети вдоль периферических краев образования или в виде коричневых бессруктурных зон, белых линий в поляризованном свете. Для дерматоскопической картины как БПМ, так и ПГ характерны красноватая однородная область, линейные неправильные сосуды, атипичные/полиморфные сосуды [27–30].
Напоминать ПГ может невус Шпитц, особенно полипоидный, ангиоматоидный и классический гипопигментированый варианты. Невус Шпитц чаще встречается у детей и молодых людей на конечностях и лице, клинически выглядит как одиночная папула около 5–6 мм розового цвета плотноватой консистенции с куполообразной гладкой поверхностью и правильными округлыми очертаниями. Розовый цвет обусловлен высокой васкуляризацией и низким содержанием меланина. Чаще всего невус возникает de novo, увеличивается в течение 3–6 месяцев, после чего не меняет размеры несколько лет. В дальнейшем, как правило, трансформируется в обычный меланоцитарный невус или спонтанно исчезает. При дерматоскопии определяются линейные и точечные сосуды по всей площади, расположенные на однородном розовом фоне, белая псевдосеть [31, 32].
При лимфангиоме выявляются множественные полупрозрачные папулы белого цвета или цвета кожного покрова с пурпурными областями. При дерматоскопии данных образований видны лакуны от желтого до розового или голубоватого цвета, а также признак, напоминающий гипопион (при вертикальном положении зоны тела с лимфангиомой кровь скапливается в нижних отделах лакун, что создает вид наполовину наполненного пузыря или гипопиона) [33].
Ангиокератома ограниченная может быть как врожденной, так и приобретенной, представляет собой доброкачественное гиперкератотическое сосудистое новообразование, сформированное стойко расширенными сосудами сосочкового слоя дермы, с явлениями папилломатоза, гиперкератоза и акантоза. Клинически это папулы от темно-красного до сине-черного цвета, локализующиеся на коже нижних конечностей, расположенные односторонне, часто сегментарно. Характерна кровоточивость при легкой травме. Дерматоскопическая картина сходна с таковой при гемангиоме [34].
Саркома Капоши – сосудистая опухоль, вызванная вирусом герпеса 8-го типа (HHV-8). Дифференциальная диагностика пиогенной гранулемы проводится с узлами при опухолевой стадии саркомы Капоши. Узлы могут быть единичными, но чаще встречаются множественные образования красно-синюшного или синюшно-буроватого цвета мягкой или плотно-эластической консистенции, диаметром от 1–2 до 5 см. Дифференциальная диагностика может быть сложной, поскольку могут выявляться гистологические признаки как пиогенной гранулемы, так и саркомы Капоши.
В этом случае диагноз основывается на положительном иммуногистохимическом исследовании на CD34 и HHV-8 [35].
Бациллярный ангиоматоз представляет собой инфекционную пролиферацию сосудов, вызываемую грамотрицательными бактериями Bartonella henselae и Bartonella quintana, и возникает у людей с иммунодефицитными состояниями (СПИД, хронический лимфолейкоз, терапия глюкокортикостероидами, химиотерапия, состояние после трансплантации органов). Очаги могут быть одиночными, но чаще бывают множественными и распространенными. Это могут быть папулы, бляшки, ангиоматозные опухоли, редко – гиперкератотические или узелки с поверхностью красно-фиолетового цвета. Характерным признаком является шелушащийся воротничок по периферии поражения. Очаги рыхлые и могут легко и обильно кровоточить. Бациллярный ангиоматоз может сопровождаться диссеминированным поражением внутренних органов как у иммунодефицитных, так и у иммунокомпетентных лиц [36].
Дифференциальная диагностика ПГ проводится с узловой формой базальноклеточного рака. При дерматоскопии нодулярной формы базальноклеточного рака будут наблюдаться множественные и разнообразные сосудистые структуры (древовидные сосуды, сосуды в виде штопора, запятые, точки), серо-голубые глобулы, бесструктурные области бело-розового цвета, редко эрозии и язвы [7, 8].
Лечение
Лечение ПГ основано на хирургическом удалении или деструкции с помощью электрокоагуляции, лазерного или радиоволнового излучения, хотя в некоторых случаях очаги разрешаются самостоятельно. После неполного удаления могут быть рецидивы. Изредка на месте ранее удаленной ПГ или вокруг нее могут развиваться множественные сателлитные очаги (чаще на плечах и туловище у молодых пациентов). Описано успешное применение склеротерапии [13]. Если ПГ спровоцирована беременностью или приемом лекарственных препаратов, вероятность рецидивов после лечения выше [7]. Поскольку ПГ поражает сетчатый слой дермы, импульсные лазеры на красителях, удаление «шейвинг»-методом и коагуляция имеют частоту рецидивов 43,5% [6].
У детей может быть эффективна медикаментозная терапия антагонистами β-адренорецепторов пропранололом и тимололом [13, 37–39].
Клинические наблюдения
Пациент C. 35 лет обратился с жалобами на появление образования без субъективных ощущений в области III пальца правой кисти. При расспросе пациент сообщил, что в течение многих лет страдает атопическим дерматитом, в связи с обострением которого последнее время эпизодически применял топические глюкокортикостероиды, в т.ч. в области кистей. Две недели назад отметил появление образования в области НП, которое быстро увеличивалось в размерах, эпизодически кровоточило. При осмотре в проксимальной области ногтевого ложа III пальца правой кисти наблюдалось опухолевидное безболезненное образование в виде узла размером 6×8 мм мягковатой консистенции вишневого цвета с гладкой поверхностью, выступающее из-под проксимального края НП (рис. 3а). Дистальная фаланга пальца была слегка отечна и гиперемирована. Лимфатические узлы не были увеличены. При осмотре кожных покровов наблюдались немногочисленные эритематозно-сквамозные зудящие очаги преимущественно в области кистей и единичные мелкие рассеянные везикулы с прозрачным содержимым и плотной покрышкой в области боковой поверхности пальцев кистей и ладоней. Общее состояние было удовлетворительным. Видимые слизистые оболочки не были поражены. НП стоп не имели патологических изменений. В лабораторных исследованиях (общий анализ крови, общий анализ мочи, биохимический анализ крови) отклонений от нормы выявлено не было. ВИЧ, гепатиты В и С, Lues – отрицательно. При дерматоскопическом исследовании признаков меланоцитарной природы образования выявлено не было, визуализировалась красноватая однородная область и структуры типа белого рельса; сосудистые структуры не выявлялись.
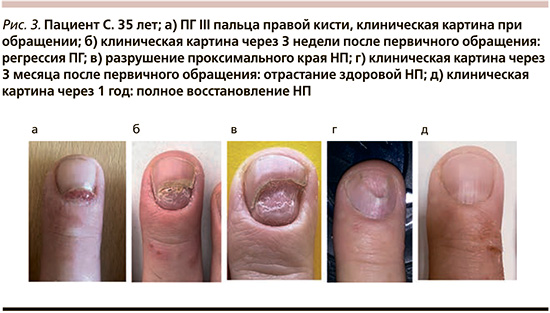
С учетом данных анамнеза, клинической и дерматоскопической картины установлен диагноз «пиогенная гранулема. Атопический дерматит». Пациенту рекомендовано удаление образования, от которого он воздержался. При повторном визите через 3 недели отмечена самостоятельная регрессия ПГ, наблюдалось частичное разрушение проксимального края НП (рис. 3б). При динамическом наблюдении через 5 недель и 3 месяца от первичного обращения отмечено возобновление роста здоровой НП (рис. 3в, 3г). На контрольном осмотре через 1 год (рис. 3д) констатировано полное восстановление НП.
Пациентка M. 8 лет с родителями обратились с жалобами на безболезненное образование в области I пальца правой стопы. По словам матери ребенка, за 10 дней до визита к врачу обратили внимание на изменения в области свободного края НП. Отмечали, что данная область часто травмируется врастающей НП. Самостоятельно 2 дня наносили раствор бриллиантового зеленого – без эффекта, образование продолжало увеличиваться, появилась кровоточивость. При осмотре в области дистального края НП I пальца правой стопы наблюдалось опухолевидное безболезненное образование размером 2×4 мм мягкой консистенции вишневого цвета с гладкой блестящей поверхностью, выбухавшее из-под свободного края ногтевой пластины (рис. 4а). Возле края НП отмечалась слабовыраженная гиперемия кожи, бахромка отслаивающегося эпидермиса.
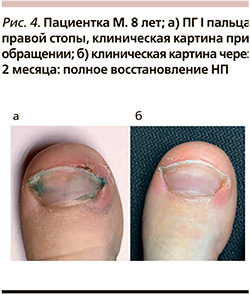
В проекции расположения образования НП имела область 4×4 мм белесоватого цвета с достаточно четкими неправильными границами, по-видимому, соответствующая зоне онихолизиса. При дерматоскопическом исследовании наблюдалась красноватая однородная область, структуры по типу белого рельса; сосудистых структур выявлено не было. Лимфатические узлы не были увеличены. Других высыпаний на коже и видимых слизистых оболочках не было, остальные НП кистей и стоп не были поражены. Общее состояние ребенка было удовлетворительным.
С учетом данных анамнеза, клинической и дерматоскопической картины установлен диагноз «пиогенная гранулема» и рекомендовано удаление образования, от которого родители отказались, в связи с чем рекомендован обязательный динамический контроль, исключение травматизации образования (применение повязок, деликатная коррекция формы НП, ношение свободной ортопедической обуви, временное ограничение физической нагрузки), назначен раствор тимолола малеата 0,25% по 1 капле 2 раза в день на срок 2 недели до следующего посещения врача. При динамическом наблюдении через 2 недели отмечалась регрессия ПГ, исчезновение воспалительных явлений. При динамическом наблюдении через 2 месяца (рис. 4б) наблюдалось полное восстановление НП. Рецидивов в течение 2 лет динамического контроля не наблюдалось.
Обсуждение
Несмотря на то что большинство исследователей сходятся во мнении о необходимости удаления ПГ с их последующим гистологическим исследованием, последнее время появляются сообщения о возможности консервативного ведения ПГу детей. В 2014 г. Malic et al. и в 2016 г. Knopfel et al. применили с положительным эффектом топический β-адреноблокатор тимолол у детей [38, 39]. Тимолол является неселективным β-адреноблокатором с мощным периферическим действием, в 5 раз превышающим действие пропранолола [40]. Предполагается, что β-адреноблокаторы действуют путем ингибирования индуцируемого гипоксией фактора 1-α (HIF1α) и фактора роста эндотелия сосудов (VEGF), что приводит к сужению сосудов, уменьшению ангиогенеза и индукции апоптоза вовлеченных эндотелиальных клеток [40]. Kelly et al. в 2022 г. опубликовали данные сравнительного анализа инвазивных и неинвазивных методов лечения ПГ у 98 пациентов в возрасте от 6 месяцев до 22 лет (преимущественно детей). 35 пациентов получали топическое лечение: 14 топическими глюкокортикостероидами сильной и очень сильной потенции 2 раза в день под окклюзию и 16 пациентов топическим β-адреноблокатором тимолол. При этом исследователями отмечено что нежелательных явлений при местной терапии не выявлялось, а наилучший эффект от местной терапии наблюдался при размерах очагов ≤4 мм [41]. Patra et al. опубликовали в 2022 г. данные своего исследования с участием 40 пациентов с диагнозом «пиогенная гранулема», 22 из которых наносили на очаг пиогенной гранулемы стерильный раствор 0,5% тимолола малеата по 1–2 капли 2 раза в день в течение 6 недель. В контрольной группе из 18 пациентов применялся глицерин. Авторы пришли к заключению, что топический тимолол безопасен и эффективен при ПГ, возникших менее чем за 8 недель до момента назначения, не всегда приводит к исчезновению ПГ, однако уменьшает ее размеры и склонность к кровоточивости, что может быть использовано вместо или до ее удаления [40].
Заключение
Согласно данным литературы, в некоторых случаях наблюдается самостоятельная регрессия ПГ, что демонстрирует и представленный нами первый клинический случай. Несмотря на это, по нашему мнению, при сомнениях в диагнозе (принимая во внимание схожесть клинической картины ПГ и отдельных новообразований, например, БПМ), при кровоточивости очага, а также в целях быстрой радикальной терапии следует прибегать к удалению очагов с последующим проведением гистологического исследования. При возникновении ПГ в детском возра-сте в случае типичной для ПГ клинической и дерматоскопической картины возможно местное применение β-адреноблокаторов, в т.ч. на начальном этапе терапии для уменьшения размеров очага в качестве подготовки к последующему проведению деструкции. В нашем случае применение топического β-адреноблокатора привело к полной регрессии ПГ.



