Введение
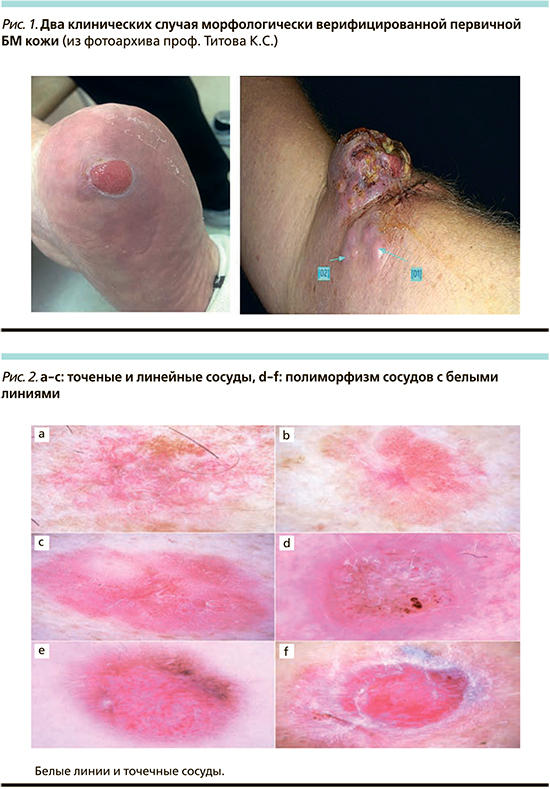
Беспигментная меланома (БМ) является одной из редких ее форм и сложной для первичной диагностики среди злокачественных опухолей кожи. Свое название этот вид опухоли получил из-за полного отсутствия темного пигмента меланина в опухолевых клетках меланомы. Распространенность БМ среди других злокачественных новообразований кожи составляет около 2–8%. Такие различия в оценке эпидемиологических данных обусловлены, с одной стороны, трудностями диагностики, с другой – некорректным использованием термина «беспигментная меланома» пациентами с гипопигментными меланомами [6].
К типичным особенностям БМ относятся быстрый рост и склонность к изъязвлению очага. Также отмечено наличие гендерных различий: у мужчин этот вид новообразований чаще встречается в области туловища, в то время у женщин – в области конечностей. При акральной локализации чаще поражаются нижние конечности. В таком случае появление неблагоприятного прогностического признака в виде изъязвления очага наблюдалось более чем в половине (60,2%) случав по сравнению с таковым при локализации на верхних конечностях (32,1%) [10]. Описаны случаи БМ вульвы. Из всех меланом данной локализации беспигментные встречаются в 27% случаев и располагаются преимущественно на слизистой оболочке в виде узелков розового или красного цветов [1].
Количество научных исследований по изучению БМ по сравнению с другими новообразованиями кожи и пигментной меланомой до настоящего времени невелико, и они мало структурированы, что не позволяет с точностью говорить о механизмах канцерогенеза, диагностических критериях, персонализированных и наиболее эффективных методах лечения БМ.
Канцерогенез
Канцерогенез БМ связывают с мутациями преимущественно в генах BRAF, С-KIT и NRAS. Ген BRAF кодирует протеин, участвующий в сигнальном пути RAS/MAPK, играющих важную роль в пролиферации, дифференцировке и миграции клеток. При данной мутации повышается выживаемость опухолевых клеток за счет подавления апоптоза. Мутации в гене BRAF возникают преимущественно на участках кожи, которые в меньшей степени подвергались инсоляции: туловище, нижние конечности и слизистые оболочки. Ген С-KIT кодирует фермент из важнейшего семейства рецепторов тирозинкиназы. Мутации в гене NRAS чаще определяются в меланомах, расположенных на фотоповрежденных инсоляцией участках кожи. Изменения затрагивают экспрессию ГТФазы, участвующей во многих процессах, в т.ч. в пролиферации и дифференцировке клеток [3, 4, 6].
В 2013 г. D. Massiс et al. опубликовали результаты научного исследования по экзомному секвенированию 33 пациентов с БМ кожи для поиска мутации в генах BRAF и С-KIT. Мутации в гене BRAF выявлены у 70,3% пациентов, а в гене С-KIT только у 12,1%. Следует отметить, что все пациенты с наличием мутаций в гене С-KIT имели акральнолентигинозную меланому [19].
В другом исследовании, представленном в 2015 г., I. Zalaudek et al. показали редкое обнаружение мутаций в гене BRAF у 2 (5,7%) из 35 пациентов с местнораспространенной БМ слизистой оболочки дна полости рта. Изменения затрагивали три нуклеотидных последовательности C1796T, G1798A и T1799A. Во всех случаях мутации представляли собой замену двух аминокислотных последовательностей в 599-м и 600-м кодонах протеина BRAF [16, 25].
В исследованиях БМ некоторыми авторами продемонстрирована прямая корреляция между снижением или полным прекращением экспрессии Е-кадгерина и β-катенина при развитии данной опухоли. Е-кадгерин участвует в процессах клеточной адгезии, обеспечивая связь клеток друг с другом. При его недостатке опухолевые клетки легко отделяются от первичного опухолевого очага, что способствует высокой скорости распространения метастазов. Кроме того, при снижении их количества ускоряется эпителиально-мезенхимальный переход, который ведет к усилению агрессивности опухоли [9].
Молекулярный анализ более 30 клеточных линий меланом кожи человека выявил, что ряд генов, включенных в ангиогенез, кодирующих Е-кадгерин, тирозинкиназу с доменами EGFR-1 и фибронектин-1, множество эпителийассоциированных генов (рецептор-2 эфрина тип А (EphA2), экспрессируются в клетках агрессивных форм меланом, в частности в БМ, при сравнении с менее агрессивными клетками. Более того, обнаружено, что гены, связанные с ангиогенезом EphA и VEGF, имеют уровень экспрессии выше в очагах сети васкулогенной мимикрии по сравнению с другими участками культур клеток агрессивных биологических вариантов кожной и увеальной форм меланомы [5]. Установлено, что в канцерогенезе БМ важную роль играют эпигенетические процессы, в т.ч. изменение экспрессии микро-РНК. Это целое семейство коротких РНК, принимающих участие во многих процессах жизнедеятельности клеток, а также выступающих как опухолевые супрессоры. При изменении количества некоторых из них увеличивается пролиферативная активность и способность к усилению инвазии опухолевых клеток.
На настоящий момент роль микроРНК в формировании БМ требует уточнения: необходимо более точное установление классов, ответственных за активацию и супрессию опухолевых процессов [5, 13].
Отсутствие типичной для БМ окраски объясняется остановкой развития меланосом на 2-й фазе. В этот период в них еще не содержится меланин из-за отсутствия и/или низкой активности тирозиназы, катализирующей синтез пигментов на основе L-тирозина [23, 24].
Диагностика
Диагностика БМ на ранних стадиях затруднена, что связано с отсутствием государственных программ по скринингу и раннему выявлению меланомы кожи, недостаточной настороженностью дерматологов и врачей амбулаторного звена относительно данной патологии, ее видимой имитацией доброкачественных и злокачественных немеланоцитарных опухолей, воспалительных заболеваний кожи, а также вариантами нетипичной локализации и расположением в труднодоступных для самостоятельного осмотра участках тела. Большое значение имеют осведомленность врача о теоретических аспектах БМ и его личный опыт [2, 12]. Первым этапом диагностики является визуальный осмотр. Он должен включать тщательное исследование всего кожного покрова и видимых слизистых оболочек. Из-за субъективности оценки возрастает вероятность гипердиагностики и как следствие – увеличение количества необоснованных исследований и удалений кожных образований [2].
В настоящее время выделяют две формы БМ: узловую и поверхностно-распространяющуюся. Клинически они определяются как эритематозное пятно, бляшка или папулонодулярное новообразование. Узловая форма считается более высокозлокачественной за счет вертикального роста опухоли. В некоторых случаях клиническая картина БМ обусловлена только метастатическим поражением. Определение ее первичной локализации не представляется возможным за счет ее склонности к спонтанному регрессу вплоть до полного исчезновения [3]. Метастазирование БМ происходит лимфогенным и гематогенным путями, а метастазы наиболее часто определяются в коже, регионарных лимфоузлах, мягких тканях, легких, печени и головном мозге [4, 6].
Следующим обязательным этапом диагностики является проведение дерматоскопии. Данный оптический метод позволяет более точно определять изменения пораженного участка, а также выявлять заболевание на ранней стадии, когда наиболее эффективно лечение и отсутствуют метастазы, что положительно влияет на долгосрочную выживаемость [8, 11].
Ввиду полного отсутствия пигмента в данном типе меланомы большое значение следует уделять сосудистым изменениям. Характерно два морфологических типа: с плоским сосудистым и возвышающимся сосудистым узорами, что зависит от вида опухоли. При дерматоскопии сосуды визуализируются в случае плоской БМ преимущественно в виде точек и коротких изогнутых линий, а при увеличении толщины патологического очага сосуды приобретают вид длинных, извитых и петлеобразных линий. Это происходит из-за особенностей направления роста сосудов и их расположения относительно поверхности кожи. Если преобладает один вид сосудистого рисунка, то он называется мономорфным, если же выражено несколько видов измененных сосудов, то полиморфным. Еще одним патогномоничным дерматоскопическим признаком БМ является сочетание нерегулярных линейных и кластеризованных расширенных сосудов по периферии очага [7].
По данным S. Menzies et al., линейные беспорядочные сосуды считаются преобладающим типом при БM. По результатам исследований, опубликованных Jaimes et al., извитые сосуды были обнаружены в 85% случаев при первичной БM и ее метастазах в кожу. Также отмечено наличие скрученных («клубочковые сосуды») или сильно извитых сосудов. В публикациях некоторых авторов отмечено присутствие контуров («шпилечные сосуды»).
S. Menzies et al. считают их одним из наиболее важных диагностических сосудистых признаков БM [20]. S. Cavicchini et al. указывают, что пунктирные сосуды следует рассматривать как наиболее полезные дерматоскопические признаки для выявления БМ [15].
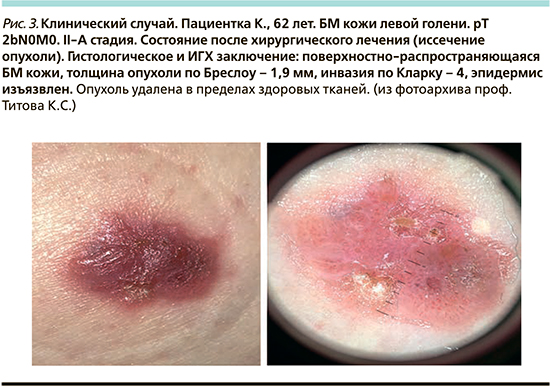
M. Pizzicheta et al. выявили, что комбинация точек и беспорядочных линейных сосудов может выступать в качестве полезных критериев для различия БM от других патологических очагов [21], что впоследствии подтвердили S. Menzies et al., выделив их как один из наиболее точных сосудистых признаков БM [20]. I. Zalaudek et al. также сообщили о сочетании пунктирных сосудов с линейными извитыми, сделав аналогичные выводы об их значимости [26]. Важным диагностическим критерием является наличие белых линий, окружающих и(или) пронизывающих опухоль. Патогномоничность данного признака достигает 90% [25, 26]. Для увеличения точности диагностики дерматоскопию необходимо дополнительно проводить при поляризованном освещении, т.к. только при этом визуализируются перпендикулярные белые линии различной длины, невидимые в обычном свете.
Стоит отметить, что дерматоскопия является важнейшим инструментом в дифференциальной диагностике БМ, в частности, с такими злокачественными опухолями кожи, как базальноклеточный рак (базалиома), плоскоклеточный рак и карцинома Меркеля. Дерматоскопическими признаками беспигментной базалиомы являются отсутствие пигментной сети и наличие хотя бы одного критерия: изъявление, структура, подобная кленовому листу, сине-серые глобулы гнезда, древовидные сосуды и «спицевое колесо». При выявлении плоскоклеточного рака отмечаются процессы кератинизации с преобладанием белых бесструктурных областей, нерегулярные группы белых перифолликулярных кругов, кровянистые пятна. У пациентов с карциномой Меркеля визуализируются линейные нерегулярные и полиморфные сосуды, молочно-розовые, белые и бесструктурные области, а также архитектурный беспорядок [6].
Еще одним неинвазивным методом диагностики БМ считается конфокальная микроскопия. Ее чувствительность составляет 84% по сравнению с таковой при дерматоскопии в 39%. В основе данного метода лежит исследование в ближнем инфракрасном излучении лазером малой мощности, что позволяет визуализировать клеточные структуры [2].
Наиболее достоверный и точный метод диагностики БМ – это эксцизионная биопсия подозрительных опухолей с последующим имммуногистохимическим (ИГХ) исследованием. К основным показателям определения БМ при ИГХ относятся белок S-100, Меlan A, HMB-45 и тирозиназа.
Белок S-100 относится к растворимым протеинам. Он выделен из ткани головного мозга и считается специфическим маркером глиальных клеток. В настоящее время имеются данные о его экспрессии меланоцитами, клетками Лангерганса, гистиоцитами, хондроцитами, липоцитами, скелетными и сердечными мышечными клетками, Шванновскими клетками, эпителием и миоэпителием молочных, слюнных и потовых желез. Также он синтезируется в злокачественных новообразованиях, развившихся из вышеуказанных клеток. Белок S-100 часто используется для диагностики меланом, однако с учетом большой распространенности экспрессии должен применяться только в совокупности с другими маркерами, одним из которых является меланомо-специфический антиген (HMB-45), содержащийся в премеланосомах [8].
Лечение
Тактика хирургического лечения БМ такая же, как и при пигментной меланоме кожи. В настоящий момент использование стандартных схем монои полихимиотерапии пациентами с метастатической формой БМ неэффективно. Широкое распространение приобрели комбинированная таргетная терапия и иммунотерапия как в комбинации, так и в монорежиме.
В связи с частым обнаружением мутации в гене BRAF у пациентов с БМ высокоэффективна комбинированная таргетная терапия BRAF и МЕК ингибиторами (объективный ответ составляет 65%). При этом 5-летняя выживаемость составляет до 35%.
Общая выживаемость пациентов с мутациями в гене С-KIT была более низкой, чем у больных без нее. Применение С-KIT-ингибитора иматиниба в данном случае продемонстрировало значительную активность в отношении метастазов с объективным ответом – 23,3%, но с небольшой длительностью [17].
Наиболее эффективным подходом к лекарственной терапии метастатической БМ является иммунотерапия ингибиторами РD-1 с преимуществом назначения ее в 1-й линии лечения вне зависимости от наличия мутаций. Z. Lin et al. провели мета-анализ ее эффективности. В работу было включено 5 исследований с участием 2828 взрослых пациентов. При иммунотерапии анти-PD-1 агентами выявлена высокая частота ответа как в группе не получавших лечения ранее, так и для рецидивирующих/рефрактерных опухолей. Общий уровень ответа составил более 40% у пациентов, которые получали ниволумаб 3 мг/кг внутривенно каждые 2 недели в качестве 1-й линии терапии, и 31,6% у пациентов, которые получали ниволумаб в той же дозе во 2-й линии после лечения анти-CTLA-4 (ипилимумаб). Различные дозы пембролизумаба также улучшали общую частоту ответа как от ранее не получавших лечения, так и от тех, кто уже проходил терапию. В двух исследованиях общий показатель объективного ответа на пембролизумаб составил от 23,3 до 33,2%. Во всех пяти исследованиях были значительные различия между контрольной группой и группами пациентов, получавших анти-PD-1, в улучшении общей частоты объективного ответа [18].
В исследовании J. Sidor-Kaczmarek et al. выявили высокую чувствительность беспигментных клеток меланомы к трем ингибиторам протеасомы, среди которых наиболее эффективен эпоксомицин. Его противоопухолевая активность была обнаружена Hamada et al., продемонстрировавшими, что гибель клеток БМ вызвана митохондриальным апоптозом, а также происходила независимо от каспаз. Цитотоксческий эффект проявлялся, несмотря на стабилизацию p21 Cip1/Waf1, p27 Kip1 и накопление HSP. Лечение БМ эпоксимицином показало свою эффективность и требует дальнейших клинических исследований [22].
Лучевая терапия при БМ описана лишь в небольшом количестве исследований. В работе Y.M. Bartlema et al. 50 взрослых пациентов с БМ глаза прошли лучевую терапию рутением-106 (106Ru) в сочетании с транспупиллярной термотерапией. Такая комбинация при оценке 5-летних результатов показала свою эффективность с точки зрения регрессa опухоли, однако в результате лучевой макулопатии выявилась значительная потеря остроты зрения [14].
Фотодинамическая терапия неэффективна при БМ из-за поглощения энергии на длине волны возбуждения фотосенсибилизаторов меланином. Эффективность данного метода лечения может быть усилена электропорацией, улучшающей перенос фотосенсибилизатора через переходные поры в мембране. Такая комбинация также требует выполнения дополнительных исследований [14].
Заключение
Таким образом, БМ является трудным диагнозом из-за своей редкой распространенности и имитации других опухолей и болезней. К основным методам диагностики относятся дерматоскопия с выявлением специфических критериев и инцизионная и экзцизионная биопсии с ИГХ, включающим определение маркеров: белка Меlan A, S-100, HMB-45 и тирозиназы. Дифференциальную диагностику необходимо проводить с другими злокачественными опухолями кожи, такими как базальноклеточный рак, плоскоклеточный рак, карцинома Меркеля, лимфома кожи и др.
Наиболее эффективной лекарственной терапией неоперабельной и метастатической БМподлительности ответа на лечение является комбинированная иммунотерапия ингибиторами СТLA4 и РD-1 (ниволумаб+ипилимумаб), а также и иммунотерапия в монорежиме (пембролизумаб, ниволумаб).



