Управление назначением антимикробных химиопрепаратов (АМХП) – это стратегия сдерживания лекарственной устойчивости бактерий и снижения других рисков, связанных с назначением антибиотиков, направленная на сокращение их ненадлежащего использования в эмпирических, профилактических и терапевтических целях. Основными целями рационального использования АМХП являются улучшение клинических исходов у пациентов, минимизация побочных эффектов и снижение риска формирования резистентности к антибиотикам [1]. Второстепенной целью считается снижение затрат на здравоохранение.
Проведение клинико-фармакоэпидемиологического анализа позволит выявить недостатки в применении АМХП у беременных с соматическими инфекционно-воспалительными заболеваниями, а также оптимизировать их применение путем разработки рекомендаций по тактике лечения у этой сложной категории пациентов.
Цель исследования: анализ рутинной практики назначения системных АМХП беременным с сопутствующими соматическими инфекционно-воспалительными заболеваниями.
Материалы и методы
Проведен неинтервенционный ретроспективный анализ данных из различных форм первичной медицинской документации, выписных эпикризов, результатов клинико-лабораторного обследования и консультаций врачей терапевтического профиля у 144 беременных, получавших антимикробную химиотерапию (АМХТ) в связи с соматическими заболеваниями и родоразрешенных нами в различных акушерских стационарах Санкт-Петербурга. Заболевания идентифицировались согласно стандартному определению случая. Период проведения исследования: сентябрь 2018–сентябрь 2019 гг. (до пандемии новой коронавирусной инфекции).
Критерий включения: курс АМХТ при беременности. Критерии невключения: назначение АМХТ врачами нетерапевтического профиля (инфекционно-воспалительная патология ЛОР-органов, хирургические, стоматологические инфекции и т.д.), а также перипартальные инфекции. Всемирная организация здравоохранения в 2015 г. определяет перипартальную инфекцию у матери как «бактериальную инфекцию половых путей или окружающих тканей, возникающую в любое время между началом разрыва плодных оболочек или родов и 42-м днем после родов» [2]. Они включают: хориоамнионит, сепсис, многоводие, преждевременный разрыв плодных оболочек, носительство стрептококка группы В, послеродовой эндометрит и раневую инфекцию после абдоминального родоразрешения, разрыва промежности или эпизиотомии.
Проведено описательное фармакоэпидемиологическое исследование – ретроспективное исследование серии случаев (оценка структуры АМХП выбора у беременных с экстрагенитальными заболеваниями и длительность их применения в конкретных клинических ситуациях). Дополнительно проведен анализ результатов определения чувствительности к АМХП изолятов, выделенных у беременных с острыми (и с обострением хронических) внебольничными экстрагенитальными инфекциями, включая бессимптомную бактериурию. Настоящее исследование ограничено отсутствием тотального комплексного микробиологического тестирования, выявления антигенов и серологических исследований на атипичные патогены.
Результаты
Всего у беременных зарегистрировано семь основных групп нозологий терапевтического профиля, потребовавших назначения АМХТ (таблица).
В подавляющем большинстве случаев – 141/144 (97,9%) беременные получили АМХТ при инфекции мочевыводящих – 98/144 (68,1%) или нижних дыхательных – 43/144 (29,9%) путей.
Инфекция мочевыводящих путей
Определены две основные нозологические формы хронической и острой неосложненной бактериальной инфекции мочевыводящих путей (ИМП) у беременных, по поводу которых была назначена АМХТ: бессимптомная бактериурия и пиелонефрит. Частота назначения АМХП была выше в амбулаторных условиях – 120/144 (83,3%) и в основном во второй половине беременности.
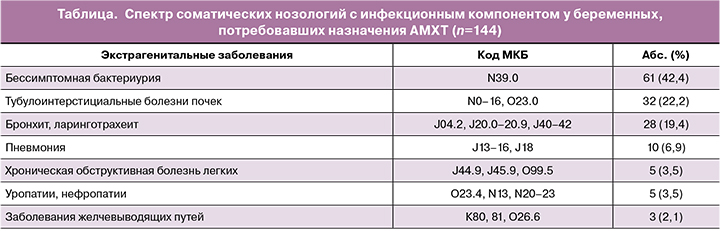
Эмпирическая этиотропная терапия ИМП состояла из β-лактамных антибиотиков, перорального фосфомицина трометамола и парафармацевтиков (рис. 1). Общий показатель превышает 100% за счет смены антимикробной терапии у части пациенток.
Лидерами по назначению оказались АМХП групп цефалоспоринов (47%), ингибиторозащищенных аминопенициллинов (37,8%) и фосфомицин (28,6%); причем с наибольшей интенсивностью для лечения ИМП у беременных использован пероральный цефалоспорин III генерации – цефиксим (препарат «Супракс»). Несмотря на хорошую комплаентность, профиль безопасности при беременности, микробиологическую и клиническую эффективность, отмечена недостаточно высокая частота назначения фосфомицина.
В лечении ИМП не применяли такие АМХП первой линии, как нитрофурантоин и фуразидин, рекомендованные отечественными и зарубежными регламентирующими документами [3–5]. Безопасность указанных препаратов при лечении ИМП в период беременности установлена (категория действия на плод по U.S. Food and Drug Administration – B). Сложно также объяснить назначение биологически активных добавок, тератогенный потенциал, клиническая эффективность и фармакологическая безопасность которых при беременности не исследуются во всем мире.
В группе ингибиторозащищенных аминопенициллинов, лидирующих по частоте назначения, наиболее используемыми препаратами были амоксициллин/клавулановая кислота и ампициллин/сульбактам. Значительно реже в исследуемой группе беременных применяли другие β-лактамные антибиотики (парентеральные цефалоспорины – цефтриаксон и цефазолин).
Согласно действующему на момент проведения настоящего исследования Приказу Минздрава РФ по профилю «акушерство и гинекология» № 572н, качественный состав АМХТ не регламентирован, рекомендован только деэскалационный подход к назначению антибиотика [6]. По нашему мнению, регулярный мониторинг назначения системных АМХП позволяет принимать стратегические решения в отношении АМХТ у беременных с целью ее оптимизации.
Для последующей оценки обоснованности и рациональности назначения АМХТ полученные результаты мы сопоставили с бактериологической структурой ИМП у беременных и уровнем лекарственной устойчивости ведущих возбудителей.
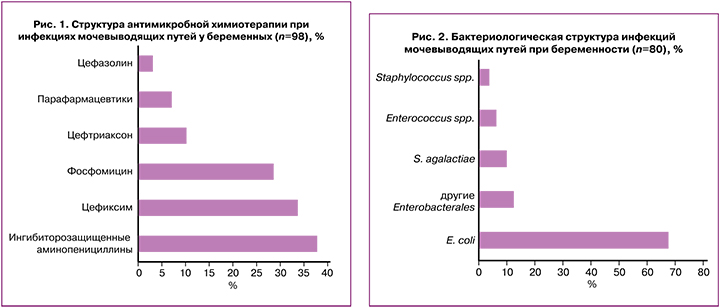
Уропатогены обнаружены у 80/98 (80,1%) обследованных пациенток (рис. 2) и в основном представлены грамотрицательными энтеробактериями с преимущественной изоляцией кишечной палочки. «Стерильных» посевов выявлено не было. В 18,4% случаев безосновательно возможности микробиологической диагностики не были использованы, т.е. лечение назначено без проведения культуральной диагностики и анализа антибиотикограммы.
Другие представители порядка Enterobacterales изолированы значительно реже (Klebsiella spp. – 5%, Enterobacter/Citrobacter – 5%, Proteus spp. – 2,5%). Грамположительные кокки вызывали ИМП у каждой пятой беременной.
In vitro изучена активность АМХП в отношении уропатогенов, выделенных у беременных с острыми (и обострением хронических) внебольничными ИМП, включая бессимптомную бактериурию (рис. 3).
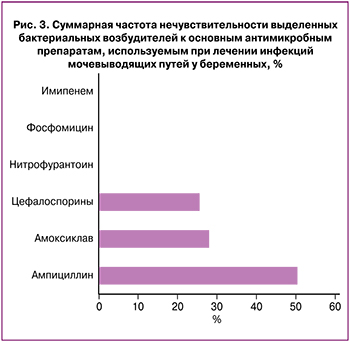
Выделенные уропатогены обладали 100% чувствительностью к имипенему, фосфомицину и нитрофурантоину. У каждой четвертой беременной с ИМП прогнозируется клиническая неэффективность при использовании цефалоспоринов (тестированы цефотаксим, цефиксим, цефуроксим) и ингибиторозащищенного амоксициллина. Наивысший уровень резистентности зарегистрирован у ампициллина (50,4%).
Антибиотикорезистентные штаммы отмечены только среди энтеробактерий. На основании результатов проведенных фенотипических тестов уровень ESBL-продуцентов [extended spectrum betalactamases (бета-лактамазы расширенного спектра действия)] составил 15%.
Бронхолегочные заболевания
Заболевания органов дыхания у исследованных беременных – вторая по частоте встречаемости экстрагенитальная патология с инфекционным компонентом, потребовавшая назначения АМХП. У исследованных беременных острые респираторно-вирусные заболевания нередко возникали в сочетании или осложнялись вторичной бактериальной инфекцией. Коморбидной патологией выступали ожирение – 12/43 (27,9%), анемия – 9/43 (20,9%), хронические инфекции ЛОР-органов – 5/43 (11,6%) и хроническая никотиновая интоксикация – 4/43 (9,3%). Около 1/3 обследованных беременных с респираторными инфекциями не имели сопутствующих заболеваний, и единственным фактором риска была беременность.
Клинические проявления респираторной инфекции во время беременности существенно не отличаются от таковых у небеременных пациенток репродуктивного возраста и включают кашель (у 96,2% беременных), боль в груди, одышку и симптомы интоксикации (лихорадка, озноб, потоотделение и т.д.). Ведущий синдром – катаральный.
Наиболее часто диагностированы следующие нозологические формы хронической и острой инфекции нижних дыхательных путей: ларингит, трахит, бронхит и пневмония (таблица). Несмотря на то что большинство острых инфекций воздухоносных путей при беременности протекали в легкой форме, были сезонными и большая часть из них имела вирусную этиологию (отсутствовал гнойный характер мокроты, отмечен кратковременный период пирексии при манифестации заболевания, гематологические изменения не характерны для бактериальных патогенов и т.д.), всем без исключения пациенткам была назначена АМХТ. У двух беременных на фоне гриппа возникла пневмония, в связи с чем к противовирусному препарату (ингибитору нейраминидазы) с профилактической целью были добавлены АМХП, активные в отношении S. aureus и суперинфекции S. pneumoniae.
Подавляющее большинство (80%) пневмоний у беременных манифестировали во II и в III триместрах, были монолобарными (нижнедолевыми), с нетяжелым течением, и все являлись внебольничными.
Эмпирическая АМХТ респираторных инфекций у беременных состояла в основном из аминопенициллинов (группа «доступ» по классификации AWaRe) и цефалоспоринов (группа «наблюдение») в примерном соотношении 1:1 (рис. 4). Общий показатель превышает 100% за счет смены антимикробной терапии у части пациенток.
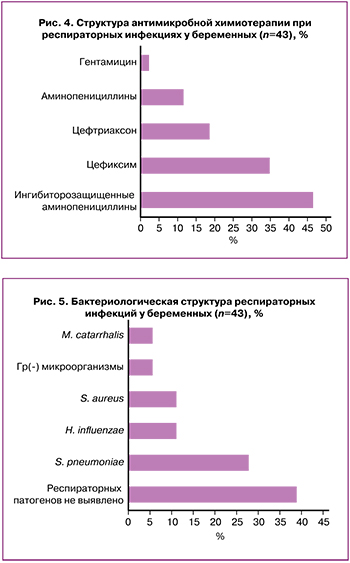
Следует отметить, что не были использованы макролиды, эффективные препараты при бронхолегочных инфекциях, охватывающие весь спектр респираторных патогенов, с лучшим профилем безопасности, наименьшей степенью проникновения через плаценту и активно не накапливающиеся в тканях плода. Однако, согласно Приказу Минздрава РФ по профилю «акушерство и гинекология» № 572н, показаниями к назначению макролидов должны быть исключительно атипичные формы заболевания органов дыхания, осложняющие беременность, либо непереносимость β-лактамных антибиотиков [6]. В новом отраслевом приказе 1130н удалено приложение № 5 (таким образом, новый приказ не регламентирует объемы лечения при различных нозологиях) [7].
Наиболее часто (37,2%) в качестве стартового антибиотика при бронхолегочных заболеваниях назначали ингибиторозащищенный амоксициллин (препараты «Амоксиклав», «Аугментин») или цефалоспориновые антибиотики III генерации (пероральный цефиксим – 34,7%, парентеральный цефтриаксон – 18,6%). Нерациональным выбором фармакотерапии следует признать назначение комбинации цефтриаксона с гентамицином, так как аминогликозиды неактивны в отношении подавляющего большинства респираторных патогенов, выделенных у беременных. Выбор указанных препаратов сложно трактовать и с позиции клинических протоколов [8–10], регламентирующих назначение ингибиторозащищенных пенициллинов и цефалоспоринов III и IV генераций только в случае тяжелого течения бронхолегочной патологии или при наличии факторов риска (алкоголизм, муковисцидоз, бронхоэктазы), а применение аминогликозидов возможно только по жизненным показаниям.
У шести беременных (13,9%) в связи с клинической неэффективностью стартовой АМХТ проведена смена антибиотика (рис. 4). Обращает на себя внимание, что замена АМХП была нерациональной в пределах одной группы – β-лактамов (с аминопенициллина на цефалоспорин или наоборот).
Микробиологическая диагностика бронхолегочной патологии у беременных в основном осуществлена в условиях стационара. У каждой третьей (38,9%) пациентки при культуральном исследовании не удалось изолировать этиологически значимого возбудителя (рис. 5).
Респираторные патогены обнаружены у 11/18 (61,1%) обследованных беременных; при этом Streptococcus pneumoniae (пневмококк) являлся преобладающим инфекционным агентом, на который приходилась половина (45,5%) всех случаев бронхолегочной инфекции известной этиологии. Haemophilus influenzae занимает второе, а S. aureus – третье место в бактериологической структуре респираторных инфекций. Серологическое и ПЦР-тестирование для поиска атипичных патогенов, таких как Mycoplasma pneumoniae, Chlamydia pneumoniae и различные виды легионелл, проведено только при госпитализации, в связи с чем затруднена дифференцииация вторичной бактериальной инфекции, колонизации и первичной инфекции нижних дыхательных путей.
Проведенный анализ чувствительности к АМХП респираторных патогенов, выделенных у беременных, показал низкий уровень их антибиотикорезистентности. Подавляющее большинство бактериальных возбудителей относилось к «диким» штаммам. Только один изолят, S. pneumoniae, был устойчив к антибиотикам [лекарственно-устойчивый S. pneumoniae (Drug-Resistant Streptococcus pneumoniae, DRSP)].
Обсуждение
Данные, полученные в результате клинико-фармакоэпидемиологического исследования, свидетельствуют о необходимости внесения существенных изменений в практику назначения АМХП у беременных с инфекционно-воспалительными заболеваниями мочевыводящих и дыхательных путей как с превентивной, так и с лечебной целями.
Необходимо признать, что в реальной клинической практике отсутствует единая концепция рационального назначения АМХП при беременности терапевтами и акушерами-гинекологами. В условиях крайне ограниченного выбора антимикробных средств в акушерстве, вынужденного селекционного антибактериального прессинга и снижения клинической эффективности β-лактамов для лечения соматических инфекций продолжают использовать препараты исключительно пенициллинового и цефалоспоринового ряда без учета групп AWaRe. Авторы статьи отмечают, что акушеры вынуждены назначать исключительно β-лактамы (по клиническим протоколам), а терапевты могут назначать антибиотики и других групп. Безосновательно игнорируются федеральные клинические протоколы, рекомендующие использовать высокоэффективные и безопасные для беременных АМХП других групп, что негативно сказывается на уровне антибиотикорезистентности. Доказано, что если пациентка получала какой-либо АМХП в течение 3 месяцев, предшествующих внебольничной инфекции, то возбудитель с большей вероятностью будет устойчив к антимикробному агенту, который был недавно использован [11]. Отсутствует стратификация пациенток в зависимости от риска носительства резистентных микроорганизмов в терапевтические группы разных по качественному составу и степени интенсивности АМХП. Выявленные факторы препятствуют достижению цели ВОЗ по увеличению доли потребления АМХП из группы AWaRe «доступ» до ≥60% [12].
При лечении неосложненной ИМП при беременности практически не применяются «старые», безопасные и высокоэффективные АМХП первой линии, рекомендованные всеми национальными и зарубежными регламентирующими документами [3–5], такие как нитрофурантоин и фуразидин (группа AWaRe «доступ»). Лишь в 28,6% случаев используется пероральный фосфомицин. Указанные уросептики в нашем исследовании показали наивысший уровень чувствительности уропатогенов (in vitro 100% микробиологическая эрадикация резистентных изолятов энтеробактерий) и отсутствие перекрестной резистентности с β-лактамами за счет уникальных механизмов действия на бактериальные клетки. При этом монодозовая терапия фосфомицином является полным законченным курсом (100% комплаентность лечения).
Каждая вторая беременная получала антибиотики ограниченного доступа (группа AWaRe «наблюдение»). Эта группа включает цефалоспорины III генерации, имеющие более высокую способность формировать лекарственную устойчивость бактериальных возбудителей [12].
Более широкое использование нитрофурантоина при бактериальной ИМП и фосфомицина при инфекциях нижних мочевыводящих путей позволило бы резервировать β-лактамы для лечения перипартальных инфекций в III триместре беременности и в послеродовом периоде. В отсутствие противоречивых данных стратегии управления, разработанные для небеременных пациентов, должны применяться в равной степени и к беременным [1].
Заболевания органов дыхания у исследованных беременных — вторая по частоте встречаемости экстрагенитальная патология с инфекционным компонентом, потребовавшая назначения АМХП. Пенициллины, цефалоспорины и макролиды – наиболее безопасные и потенциально эффективные противомикробные препараты для лечения бронхолегочных инфекций у беременных [13]. Однако β-лактамные антибиотики, в отличие от макролидов, легко проникают через плаценту и попадают в грудное молоко, следовательно, способны сенсибилизировать ребенка, негативно повлиять на его микробиом. Макролиды характеризуются широким спектром действия, включая атипичных возбудителей респираторных инфекций; активной пенетрацией и кумуляцией в тканях нижних дыхательных путей без проникновения к плоду; выраженным постантибиотическим эффектом в сравнении с β-лактамами [11, 14]. «Респираторные» фторхинолоны, обычно используемые для лечения бронхолегочной инфекции у небеременных пациенток, не назначают при гестации из-за риска фетальной артропатии, канцерогенеза и пороков развития, выявленных в исследованиях на животных. Тем не менее появились спорадические сообщения о их безопасности во время беременности с учетом того, что они могут быть применены при абсолютной необходимости [13].
Анализ практики назначения АМХТ беременным с заболеваниями органов дыхания врачами терапевтического профиля и акушерами-гинекологами показал чрезмерное увлечение β-лактамными антибиотиками; при этом полностью игнорированы макролиды. В то же время действующие клинические рекомендации по лечению инфекций нижних дыхательных путей регламентируют, чтобы пациенты получали эмпирическую терапию не только β-лактамом, но и макролидными антибиотиками, активными в отношении атипичных патогенов и пневмококка [8–10]. Среди всех макролидов азитромицин и спирамицин, как правило, переносятся лучше, чем эритромицин [8–10]. Кларитромицин применяют при беременности с осторожностью из-за неблагоприятных эмбриональных и фетальных исходов в исследованиях на животных [3].
По нашим данным, в условиях благоприятного профиля резистентности изолированных респираторных патогенов назначение ингибиторозащищенных АМХП и цефалоспоринов III генерации (группа AWaRe «наблюдение») следует считать избыточным.
Исходя из когортного анализа индивидуальных карт беременных, только 80,9% беременным действительно были показаны АМХП, регламентированные национальными протоколами, одобренными научно-практическим советом Минздрава России и размещенными в рубрикаторе клинических рекомендаций [3, 9, 10]. Фактически при первых жалобах беременной на кашель без признаков бактериальной инфекции с превентивной целью рутинно проведена АМХТ пенициллинами или цефалоспоринами. В соответствии с опубликованными федеральными протоколами не рекомендуется использовать АМХП для пациенток с острыми респираторными инфекциями без дополнительных факторов риска неблагоприятного исхода острой вирусной инфекции. Польза, полученная от стереотипного превентивного использования АМХП, значительно меньше риска в отношении роста уровня антибактериальной резистентности, их побочных эффектов и безопасности применения во время беременности.
Заключение
С целью резервации β-лактамов и сохранения их эффективности у беременных для амбулаторных и стационарных пациентов с неосложненной ИМП терапию следует проводить пероральными нитрофурантоином или фосфомицином (инфекция нижних отделов мочевых путей), которые лучше переносятся, не проникают через плаценту и эффективны против энтеробактерий ESBL-продуцентов. Парентеральное введение ингибиторозащищенных аминопенициллинов показано при тяжелом течении ИМП, наличии факторов риска антибиотикорезистентности возбудителя (предшествующая госпитализация, клиническая неэффективность проведенной АМХТ, сопутствующие заболевания).
Согласно представленным данным, в условиях крайне низкого риска изоляции DRSP и лекарственно устойчивых респираторных патогенов при внебольничной бронхолегочной инфекции нетяжелого течения беременным показана амбулаторная эмпирическая монотерапия макролидом (пероральный прием). В случае тяжелого течения заболевания и госпитализации беременной в стационар показана стартовая терапия внутривенным азитромицином, если у пациентки нет риска DRSP, и внутривенно макролидом и высокими дозами ингибиторозащищенных аминопенициллинов или цефотаксима, но не цефтриаксона у пациентов с риском DRSP.



