Введение
Появление новых иммуноонкологических препаратов открыло новые возможности в лечении пациентов с диссеминированными онкологическими заболеваниями. Внедренные в клиническую практику ингибиторы контрольных точек (ИКТ) продемонстрировали высокую эффективность и приемлемую токсичность не только в лечении распространенных форм сóлидных опухолей (преимущественно меланомы кожи, немелкоклеточного рака легкого – НМРЛ, рака почки), но и в адъювантом режиме [1, 2].
В настоящее время активно исследуется роль неоадъювантной иммунотерапии. Несмотря на значительное улучшение общей выживаемости (ОВ) при использовании ИКТ, их эффективность все еще остается ограниченной для широкого применения разными категориями пациентов.
От 50 до 60% пациентов обладают первичной резистентностью к терапии ИКТ. Первичная или адаптивная резистентность характеризуется нарушениями сигнальных механизмов, утратой экспрессии главного комплекса гистосовместимости (HLA) и др. К внешним механизмам резистентности относят иммунные контрольные точки, утрату активности Т-лимфоцитов, высвобождение цитокинов и их метаболитов в опухолевом микроокружении. Использование биомаркеров позволит эффективнее применять иммуноонкологические препараты с целью преодоления устойчивости опухоли к иммунному надзору организма [3].
Немаловажным вопросом в современной онкологии является дилемма выбора между вариантами лекарственной терапии. Например, проблемы выбора в адъювантной терапии распространенной BRAF-позитивной меланомы кожи. Таргетная или иммунотерапия принесет больше пользы конкретному пациенту? Существуют ли предиктивные биомаркеры, способные помочь нам решить этот вопрос?
Количество исследованных биомаркеров, которые могут быть потенциально использованы в качестве предиктора ответа на иммунотерапию, увеличивается, тем не менее убедительной доказательной базой обладают только некоторые из них. В настоящее время назначение ИКТ иммунного ответа большинству пациентов основывается на уже показавших свою эффективность биомаркерах, таких как экспрессия PD-L1, микросателлитная нестабильность и наличие дефектов репарации ДНК (MSI/dMMR). Однако, даже несмотря на наличие предиктивных факторов, в ряде случаев иммунотерапия оказывается неэффективной.
Таким образом, поиск универсальных маркеров, предсказывающих ответ на терапию современными иммуноонкологическими препаратами, остается приоритетной задачей, что подтверждается все бóльшим числом исследований по изучению различных молекулярных факторов.
В данной статье рассмотрены как биомаркеры, уже показавшие свою эффективность и применяемые в клинической практике, так и биомаркеры, проходящие апробацию в клинических исследованиях с высоким потенциалом.
PD-L1-экспрессия
Физиологическая роль сигнального пути PD-1 заключается в предотвращении развития чрезмерно сильного иммунного ответа на собственный тканевой антиген. При активации рецептора PD-1 его специфическими лигандами (PD-L1, PD-L2) запускаются процессы апоптоза цитотоксических лимфоцитов. Таким образом, взаимодействие PD-1/PD-L1 в естественных условиях необходимо для предотвращения гиперактивации иммунной системы в ответ на проникновение чужеродного агента и ограничения повреждения клеток в результате развития иммунного ответа. Связь PD-L1-лиганда с его рецептором PD-1 ингибирует сигнал на опухолевых клетках и клетках опухолевого микроокружения, тем самым приводит к увеличению иммуносупрессивного эффекта и способствует подавлению противоопухолевого иммунного ответа [4].
Экспрессия PD-L1 в опухолевом микроокружении коррелирует с позитивным ответом на ИКТ в лечении больных меланомой кожи, НМРЛ и др. При раке желудка вместе с микросателлитной нестабильностью уровень PD-L1-экспрессии служит предиктором ОВ. Изучаются различные механизмы активации экспрессии PD-L1 и ее связь с агрессивным фенотипом некоторых опухолей, в т.ч. при редких неблагоприятных гистологических формах и висцеральных метастазах, как это показано для рака предстательной железы. Вместе с тем гиперэкспрессия PD-L1 в опухолевых клетках служит одним из ключевых механизмов феномена «ускользания» опухоли от противоопухолевого иммунного надзора и может быть предиктором агрессивного фенотипа при некоторых типах опухоли [5].
Экспрессию PD-L1 определяют с помощью иммуногистохимического (ИГХ) метода. Одним из наиболее важных вопросов как для онкологов, так и для патоморфологов считается возможный алгоритм оценки экспрессии PD-L1 с целью определения чувствительности опухолевых клеток к PD-1-ингибиторам:
- Tumor Proportion Score (TPS): доля экспрессирующих PD-L1 жизнеспособных опухолевых клеток (с полным или частичным мембранным окрашиванием любой интенсивности) среди общего количества опухолевых клеток. Этот метод оценки используется для НМРЛ.
- Combined Positive Score (CPS): количество окрашенных PD-L1-клеток (опухолевых и лимфоидных) по отношению к общему количеству жизнеспособных опухолевых клеток, умноженное на 100. Этот метод используется для уротелиального рака, рака желудка и рака шейки матки [6].
Для других сóлидных опухолей этот алгоритм достоверно не установлен и требует дальнейшего изучения. Остается неопределенным и оптимальное пороговое значение данного биомаркера как предиктора ответа на иммунотерапию, что диктует необходимость дальнейших исследований.
Пембролизумаб остается единственным ИКТ иммунного ответа, утвержденным в качестве первой линии монотерапии пациентов с уровнем экспрессии PD-L1(+) 50% или выше, по данным исследования KEYNOTE-024 [7]. Результаты исследования KEYNOTE-042 продемонстрировали значительное увеличение ОВ в группе терапии пембролизумабом по сравнению с химиотерапией на основе платины не только пациентов с экспрессией PD-L1≥50%, но и в группе пациентов с PD-L1(+)>20% [8].
При анализе клинических исследований, на которых базировалось FDA (Food and Drug Administration) при утверждении иммуноонкологических препаратов, выявлено, что предиктивная роль PD-L1 была установлена только в 28,9% случаев. Основываясь на уровне экспресии PD-L1, ряд иммунотерапевтических препаратов получил регистрацию в следующих нозологиях: рак мочевого пузыря (атезолизумаб, пембролизумаб, дурвалумаб), НМРЛ (пембролизумаб), трижды негативный рак молочной железы (атезолизумаб+nab-паклитаксел), рак шейки матки (пембролизумаб) и рак желудка (пембролизумаб). Пороговые значения PD-L1 были переменными как внутри, так и между типами опухолей и составляли 1%, 5 и 50% [9]. Таким образом, экспрессия PD-L1 остается одним из немногих биомаркеров, основываясь на результатах которого мы назначаем иммуноонкологические препараты пациентам с различными сóлидными опухолями (НМРЛ, рак мочевого пузыря, рак шейки матки и др.).
MSI/dMMR
Следствием повышенной частоты возникновения мутаций в геноме является микросателлитная нестабильность (MSI), в первую очередь связанная с нарушением системы репарации ДНК. В опухолевых клетках появляются дополнительные аллели микросателлитов, которые по длине отличаются от аллелей в нормальных тканях. Это возникает при изменении длины микросателлитных последовательностей в результате делеции или вставки нескольких нуклеотидов. Ранние результаты исследований показали, что большинство случаев MSI – это спорадический колоректальный рак (КРР), вызванный эпигенетической инактивацией экспрессии генов у потомства из-за метилирования промотора hMLH1 без мутации гена, а меньшая часть связана с развитием наследственных синдромов, таких как, например, синдром Линча. Синдром Линча – это аутосомнодоминантный синдром, возникающий за счет инактивирующих мутаций в генах репарации неспаренных оснований ДНК (MLH1, MSH2, значительно реже – MSH6, PMS2 и др.) [10].
Опухоли с MSI или дефицитом репарации ДНК (dMMR) характеризуются высокой мутационной нагрузкой, массой неоантигенных эпитопов, обильной инфильтрацией цитотоксических CD8+-Т-лимфоцитов, что может служить объяснением более высокой эффективности иммунотерапии в данной когорте больных. Частота встречаемости MSI варьируется в зависимости от нозологического типа опухоли (см. рисунок).
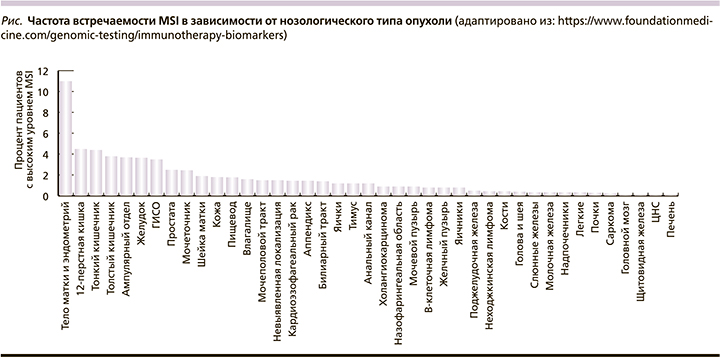
Анализ на MSI может быть выполнен посредством нескольких методик: полногеномное секвенирование, полимеразная цепная реакция (ПЦР) с капиллярным электрофорезом, ИГХ и др. Однако «золотым» стандартом признана именно ПЦР с капиллярным электрофорезом с точностью до 100% [10, 11].
Ранние исследования ИКТ у пациентов с КРР показали, что значительное число больных резистентны к терапии анти-PD-1/PD-L1-ингибиторами. Однако подгруппа пациентов с высоким уровнем MSI-H оказалась тесно связанной с высокой экспрессией PD-1/PD-L1 и продемонстрировала длительные ответы при терапии ингибиторами PD-1. Исследования с изучением других типов рака с фенотипом MSI-H были сходными [12].
Регистрация пембролизумаба для лечения больных с высоким уровнем MSI была основана на анализе данных пяти клинических исследований.
В анализ одного из них были включены 149 пациентов с MSI-Н или наличием dMMR, 90 из них – пациенты с КРР и 59 пациентов с другими нозологическими формами. Среди всех пациентов частота общего ответа (ЧОО) составила 39,6% (48 – частичный ответ [ЧО] и 11 – полный ответ [ПО]). Длительность ответа среди 78% респондентов составила от 6 месяцев и более. Частота общего ответа (ОО) равнялась 36% у пациентов с КРР и 46% у пациентов с другими типами опухоли [9]. В более позднем клиническом исследовании II фазы CheckMate-142 у пациентов с метастатическим КРР и высоким уровнем MSI подтверждена противоопухолевая эффективность другого моноклонального антитела, направленного на PD-1, – ниволумаба. Общая частота ответа на лечение ниволумабом в группе из 74 пациентов с MSI-H составила 31,1%, медиана выживаемости без прогрессирования (ВБП) заболевания – 9,6 месяца, безрецидивная выживаемость в течение года – 48,4% [13].
Таким образом, в настоящее время становится понятным, что MSI является предиктивным маркером ответа на иммунотерапию при многих типах опухолей вне зависимости от гистологического подтипа, что во многом основано на генетическом многообразии опухолевой клетки.
Мутационная нагрузка опухоли (TMB от англ. Tumor Mutational burden) – это число мутаций, содержащихся в одной мегабазе кодирующего генома опухолевых клеток. Мутационная нагрузка анализируется с помощью полноэкзомного или полногеномного секвенирования биопсийного или парафинизированного материала, полученного из опухолевого образца пациента. Высокий уровень ТМВ ассоциируется с высокой экспрессией неоантигенов, которые распознаются иммунной системой в опухолевой клетке как чужеродные (трансплантационные) тканевые антигены.
За последние несколько лет проведено много исследований, в ходе которых установлено, что самые высокие уровни TMB определяются при таких заболеваниях, как меланома, НМРЛ, другие плоскоклеточные карциномы. Рак молочной железы, рак почки и рак яичников характеризуются промежуточными уровнями TMB. При этом среди пациентов с НМРЛ наблюдается высокая степень вариабельности уровня TMB, обусловленная наличием такого фактора, как курение. Кроме того, показано, что повышение эффективности ИКТ, ассоциированное с увеличением ОВ и ВБП, наблюдается у пациентов с высоким уровнем TMB. Подгрупповой анализ подтвердил, что наибольшую прогностическую ценность TMB показала при НМРЛ и меланоме [14].
Связь между MSI и TMB достаточно сложная и не имеет линейной зависимости, в то время как экспрессия PD-1 позволяет прогнозировать эффективность иммунотерапии вне зависимости от TMB, однако в совокупности они обладают гораздо большей прогностической ценностью [15].
По данным исследования CheckMate026 (иммунотерапия НМРЛ) выявлено, что среди пациентов с высоким уровнем TMB ЧОО была выше в группе ниволумаба по сравнению с группой химиотерапии (47% против 28), а ВБП заболевания была более длительной (медиана 9,7 против 5,8 месяца); коэффициент риска для прогрессирования заболевания или смерти составил 0,62 (95% доверительный интервал [ДИ] от 0,38 до 1,00). ОВ была сопоставимой между изучаемыми группами пациентов вне зависимости от уровня TMB. Связь между TMB и уровнем экспрессии PD-L1 не была обнаружена. Однако в группе пациентов, получавших иммунотерапию с высоким уровнем TMB и экспрессией PD-L1≥50%, ЧОО была значительно выше (75%) по сравнению с пациентами, имевшими один из этих факторов (32% среди пациентов только с высокой опухолевой нагрузкой и 34% среди тех, у кого уровень экспрессии PD-L1 составлял ≥50%) [16].
Изучение влияния двух ключевых биомаркеров (уровень экспрессии PD-L1 и TMB) продолжено в исследовании CheckMate-227 (ниволумаб+ипилимумаб в лечении распространенного НМРЛ). Комбинированная иммунотерапия показала свои преимущества в когорте пациентов с уровнем TMB>10 мут/мб в увеличении ВБП. Показатели однолетней выживаемости достигли 45% по сравнению с 8% в группе химиотерапии. Медиана ВБП составила 7,7 месяца по сравнению с 5,3 – в группе пациентов, получавших химиотерапию. В качестве вторичной контрольной точки оценивалась ОВ в зависимости от уровня экспрессии PD-L1 и TMB. В исследуемых группах статистически значимого различия не установлено [17].
Использование TMB в качестве рутинного предиктивного биомаркера в настоящее время невозможно. Даже, несмотря на то что большинство исследований показало, что высокий уровень TMB можно интерпретировать как положительный прогностический фактор у пациентов, получающих ИКТ, установление точного порогового значения уровня TMB все еще остается сложной задачей, которую следует выполнять до внедрения данного биомаркера в клиническую практику. Тем не менее первые шаги в этом направлении уже сделаны группой FoundationMedicine – уровни TMB разграничены следующим образом: высокий >20 мут/мб, средний – 6–19 и низкий <5 мут/мб [18].
Таким образом, до внедрения TMB в рутинную клиническую практику необходимо собрать больше данных о динамике биомаркера в процессе развития заболевания и лечения, а также о его прогностической ценности в других сóлидных опухолях.
Нейтрофильно-лимфоцитарный индекс (НЛИ)
Первоначальные исследования показали, что увеличение значения отношения нейтрофилов к лимфоцитам связано с уменьшением ОВ и ВБП при меланоме, раке желудка, раке молочной железы, НМРЛ и др. [19–21]. Увеличение НЛИ>2,0 связано со снижением ОВ у пациентов с меланомой II стадии [20]. Уровень НЛИ >3,36 является независимым предиктором увеличения частоты смертности от рака молочной железы [21]. Кроме того, установлено, что НЛИ служит предиктором плохого ответа не только на иммунотерапию, но и на другие стандартные методы лечения онкологических заболеваний, такие как химио- и лучевая терапия.
По данным мета-анализа по оценке прогностической роли НЛИ у больных метастатическими формами рака (в исследование включены 40 559 пациентов) установлено, что повышение уровня НЛИ ассоциировано с уменьшением ОВ у большинства сóлидных опухолей. Несмотря на попытки авторов установить оптимальное значение данного индекса (медиана индекса – 4,0), оказалось, что для каждого типа заболевания НЛИ различен и установить общее пороговое значение становится невозможным. Вместе с тем очевидно, что более высокие значения НЛИ будут предвестником худшего прогноза, чем более низкие [22].
Данные выводы связаны с тем, что воспаление играет важную роль в прогрессировании опухолевого процесса. Нейтрофилы способны продуцировать ряд хемокинов и цитокинов, подавляющих активность лимфоцитов и натуральных клеток-киллеров. Взаимодействие опухолевых клеток с нейтрофилами вызывает воспалительный ответ, что приводит к пролиферации, инфильтрации и метастазированию опухолевых клеток. Как показатель воспаления и противоопухолевого иммунного ответа НЛИ в крови играет ключевую роль на различных стадиях заболевания. Высокий НЛИ указывает на повышение концентрации цитокинов, участвующих в системном воспалительном ответе, например, таких, как TGF-β, который может усиливать иммуносупрессию, ангиогенез и образование перитуморальной стромы. Более того, он может способствовать увеличению числа нейтрофилов и уменьшению числа лимфоцитов. Кроме того, некоторые исследования показали, что лимфопения была связана с иммуносупрессией, которая в свою очередь была предиктором первичной лимфоидной инфильтрации опухоли [23].
Циркулирующая опухолевая ДНК (цоДНК)
Исследование внеклеточной ДНК у онкологических больных началось во второй половине XX столетия и продолжается по сей день. Наличие фрагментированных частей опухолевой ДНК в крови может быть объяснено высвобождением ДНК из ядра опухолевой клетки в процессе клеточной смерти (апоптоз и некроз) или активным высвобождением из живых опухолевых клеток. Количество опухолевой ДНК в периферической крови зависит от опухолевой массы в организме пациента: с увеличением объема опухоли одновременно нарастает и число опухолевых клеток, подвергшихся апоптозу и некрозу, что в свою очередь увеличивает количество цоДНК.
В настоящее время существует два базовых подхода к определению цоДНК для ее использования в качестве биомаркера опухолевого процесса. При одном из них изначально определяются генетические аберрации, присутствующие в опухоли пациента (т.е. требуется предварительное проведение рутинной биопсии), после чего среди циркулирующей ДНК ведется поиск фрагментов, которые содержат выявленные в биоптате опухоли генетические изменения. При альтернативном подходе с этой же целью используют заранее определенный набор мутаций, характерных для данного типа опухолей без предварительного анализа опухолевой ткани конкретного пациента. Число методик, которые позволяют определить цоДНК в крови пациента, увеличилось с ростом технологического прогресса: секвенирование нового поколения (NGS – next generation sequencing), персонализированный анализ реаранжировки окончаний (PARE – personalized analysis of rearranged ends), цифровое кариотипирование, цифровая капельная ПЦР и др. [24–26].
Ряд ранних исследований продемонстрировал, что высокий уровень циркулирующих опухолевых ДНК на фоне терапии ингибиторами PD-1 ассоциирован с худшим ответом на лечение и ухудшением как ОВ, так и ВБП у пациентов с меланомой.
В дополнение: у 9 пациентов выявлено псевдопрогрессирование опухолевого процесса. Во всех случаях псевдопрогрессирования циркулирующая опухолевая ДНК не обнаружена. Напротив, у 20 пациентов с истинным прогрессированием только у 2 был неблагоприятный профиль экспрессии данного маркера, остальные же демонстрировали высокий уровень цоДНК [26].
По данным последних исследований, циркулирующая опухолевая ДНК обладает сильным прогностическим значением и может служить маркером рецидива заболевания при многих типах опухолей после первичного радикального лечения. Анализ циркулирующей ДНК проводился методом «глубокого секвенирования» (CAPP-Seq) для 218 образцов, полученных от 65 пациентов после химиолучевой терапии по поводу местнораспространенного НМРЛ, из них 28 пациентов получали консолидирующую иммунотерапию. Пациенты, у которых циркулирующая опухолевая ДНК после химиолучевой терапии не была обнаружена, имели хорошие результаты независимо от того, получали ли они поддерживающую терапию, или нет. Напротив, у пациентов с циркулирующей опухолевой ДНК из группы высокого риска (наличие циркулирующей опухолевой ДНК после первичного лечения), которые получали консолидирующую иммунотерапию, отдаленные результаты лечения были значительно лучше, чем у пациентов, ее не получавших. Кроме того, наблюдая за динамикой данного биомаркера, уже на предварительном этапе можно предположить, как пациенты ответят на иммунотерапию. Результаты исследования показывают, что терапия ИКТ в консолидирующем режиме улучшает отдаленные результаты лечения для пациентов с НМРЛ и наличием циркулирующих опухолевых ДНК [27].
Таким образом, циркулирующая опухолевая ДНК ассоциирована с высоким уровнем TMB и может служить предиктором ответа на иммунотерапию, а также может быть использована с целью дифференциальной диагностики между псевдопрогрессированием и истинным прогрессированием [26]. Однако внедрение данного биомаркера в клиническую практику сдерживается отсутствием стандартных методов анализа цоДНК и их высокой стоимостью.
Биомаркеры, требующие более детального изучения и проведения большего количества рандомизированных исследований
Опухоль-инфильтрирующие CD8+-T-лимфоциты (TILs – Tumor Infiltrating Lymphocytes) способны распознавать опухолевые антигены и осуществлять прямой лизис клеток-мишеней. Однако, по данным многих авторов, эти клетки находятся в дремлющем состоянии и активируются под влиянием специфической противоопухолевой терапии [28]. Согласно рекомендациям международной рабочей группы по изучению TILs, исследование проводят на окрашенных гематоксилином и эозином срезах образцов опухолевой ткани толщиной 4–5 мкм, сделанных из парафиновых блоков, что подчеркивает доступность материала для исследования. В настоящее время существуют данные о том, что важно не столько наличие выраженной лимфоидной инфильтрации, сколько соотношение CD8+/CD4+-клеток (эффекторы/хелперы), ввиду того что CD8+-T-лимфоциты могут утрачивать способность обеспечивать полноценный иммунный ответ в отсутствие поддержки CD4+-клеток [29].
В ранних исследованиях опухоль-инфильтрирующие Т-лимфоциты уже показали свою прогностическую значимость при многих сóлидных опухолях, таких как меланома кожи, КРР, рак молочной железы и др. [28–30].
P.C. Tumeh et al. (2014) установили предиктивную ценность данного биомаркера и показали, что присутствие CD8+-Т-лимфоцитов было связано с высокой экспрессией PD-1/PD-L1 и коррелировало с увеличением ЧОО у пациентов с меланомой кожи на терапию ИКТ. Увеличение CD8+-TILs от исходного уровня после терапии анти-PD-1-ингибиторами также служило благоприятным признаком и ассоциировано с лучшими и более длительными ответами на лечение [31].
Ряд авторов описывают важную роль микробиома кишечника как компонента формирования иммунного ответа. Бóльшая часть исследований по определению предиктивной и прогностической роли кишечного микробиома выполнена на мышиных моделях. Несколько исследований людей показали, что различный состав кишечной микробиоты по-разному ассоциирован с ответом на ИКТ. Пациенты с меланомой кожи, чья исходная микробиота была обогащена Faecali bacterium и Firmicutes, имели лучшие показатели ОВ и ВБП по сравнению с группой больных, чья исходная микробиота была обогащена бактериоидами после монотерапии CTLA-4-ингибитором [33, 34]. По данным ретроспективного анализа 568 пациентов с местнораспространенной и метастатической меланомой кожи, пациенты, получавшие антибактериальную терапию за 3 месяца до начала иммунотерапии, обладают худшими показателями ОВ по сравнению с группой больных, не получавших антибактериальной терапии (медиана ОВ составила 27,4 против 43,7 месяца). Также в группе пациентов, получавших антибактериальную терапию, отмечена более высокая частота развития иммуноопосредованного колита по сравнению с контрольной группой (частота встречаемости явления в течение 1 года 9,8% против 4,6) [35].
В исследовании COMBI-AD изучалась эффективность таргетной терапии в адьювантном режиме у пациентов с местнораспространенной BRAF-позитивной меланомой кожи. В качестве предиктивного маркера исследователями были выбраны ТМВ и интерферон-γ. Установлено, что у пациентов с высоким уровнем ТМВ и интерферона-γ ВБП значительно ниже, чем в группе пациентов с низкой экспрессией. Это может послужить основанием для оптимального выбора режима адъювантной терапии в данной когорте больных: при низкой экспрессии данных маркеров предпочтительнее таргетная терапия, при высоком – иммунотерапия [36].
Заключение
Проблема поиска предиктивных и прогностических биомаркеров в иммуноонкологии стоит достаточно остро. Универсальных маркеров нет. В настоящее время изучается широкий спектр потенциальных биомаркеров, большинство из которых основано на опухолевой ткани. Предиктивная и прогностическая роль таких маркеров, как экспрессия PD-L1, MSI и TMB, достаточно высока, что демонстрируется во многих рандомизированных клинических исследованиях. Высокий уровень TMB и экспрессии PD-L1 достоверно демонстрирует увеличение ЧОО и ОВ при терапии ИКТ.
Роль других биомаркеров и их связь с имеющимися более чувствительными маркерами еще предстоит установить в клинических исследованиях. Основной проблемой таких исследований является гетерогенность изучаемой популяции. Прогностическая ценность биомаркера может варьироваться даже внутри нозологических подтипов одной локализации (акральная меланома, увеальная меланома, меланома кожи), что установлено в подгрупповом анализе. Пороговое значение определенного биомаркера при различных нозологиях может также сильно различаться, что затрудняет его применение в рутинной клинической практике. Также стоит отметить, что для некоторых биомаркеров, уже ставших рутинными, например, экспрессия PD-L1, MSI, существуют разные методы оценки пороговых значений, что следует учитывать при анализе результатов. Принимая во внимание все изложенное, становится понятной целесообразность проведения дальнейших клинических исследований по изучению предиктивных и прогностических маркеров в иммуноонкологии.



