Введение
Заболеваемость злокачественными новообразованиями резко повышается в возрасте 60 лет и старше [1]. На сегодняшний день приблизительно 50% всех злокачественных новообразований возникают у больных 65 лет и старше и ожидается, что заболеваемость и далее будет также увеличиваться [1, 2]. Несмотря на частоту заболеваемости среди популяции старшего возраста, данная группа недостаточно представлена в клинических исследованиях. Включенные в них пациенты пожилого возраста представляют собой тщательно отобранную подгруппу больных [3]. Систематический обзор 345 исследований не продемонстрировал доказательств ухудшения выживаемости или увеличения смертности, ассоциированной с лечением, по сравнению с пациентами молодого возраста, несмотря на увеличение риска развития токсичности [4]. Даже при условии включения значимого числа пациентов пожилого возраста результаты не могут быть полностью экстраполированы на всю популяцию людей пожилого возраста. Пациенты, имеющие значимую сопутствующую патологию, как правило, исключаются из клинических исследований, соответственно, возникает вопрос о применимости результатов данных исследований.
В этой статье представлены наиболее важные аспекты проведения системной терапии больных сόлидными новообразованиями в пожилом и старческом возрасте, а также изложены основные методы комплексного гериатрического обследования.
Особенности проведения химиотерапии больным геронтологического профиля
Несколько ретроспективных исследований показали, что проведение химиотерапии (ХТ) пациентам старше 70 лет не сопровождается более выраженной или продолжительной токсичностью [5]. Однако результаты данных исследований не могут быть полностью применены по следующим причинам: малая численность пациентов старше 80 лет; группы пациентов не были репрезентативны, т.к. больные были тщательно отобраны и в целом здоровее, чем большинство больных пожилого возраста; многие режимы терапии включали схемы лечения с редуцированными дозами препаратов [6]. Несмотря на это, результаты исследования безусловно важны, т.к. демонстрируют, что возраст сам по себе не является противопоказанием к проведению ХТ.
Старение ассоциировано с уменьшением резервных функций многих систем организма. Это может влиять на фармакокинетику и фармакодинамику противоопухолевых препаратов и приводить к более частым осложнениям при проведении цитостатического лечения [7].
Фармакокинетика
Многие фармакокинетические параметры могут изменяться у больных пожилого возраста (табл. 1) [8]. Однако наиболее важные изменения наблюдаются в объеме распределения (ОР) препаратов и почечной экскреции [9]. ОР – это гипотетический объем жидкости организма, необходимый для равномерного распределения лекарственного препарата в концентрации, аналогичной таковой в плазме крови. Данный показатель зависит от состава тканей организма, уровня альбумина сыворотки и концентрации эритроцитов в крови. При старении ОР водорастворимых препаратов уменьшается в результате снижения содержания внутриклеточной воды, концентрации альбумина и гемоглобина в крови. Вероятность развития анемии повышается с возрастом, особенно после 65 лет [10]. Наличие анемии особенно важно учитывать при назначении антрациклиновых антибиотиков и алкилирующих агентов, т.к. эти группы препаратов усиленно связываются с эритроцитами [11].

Снижение скорости клубочковой фильтрации с возрастом наблюдается даже в отсутствие артериальной гипертензии или заболеваний почек. Нарушение почечных функций приводит к повышению концентрации лекарственного препарата и удлинению экспозиции цитостатика. Повышается риск развития выраженной токсичности химиотерапевтических агентов, которые выделяются в основном почками (метотрексат, карбоплатин, цисплатин, топотекан, блеомицин), а также препаратов, которые превращаются в активные метаболиты (идарубицин, даунорубицин) или токсические метаболиты (высокодозный цитарабин). Коррекция доз в зависимости от скорости клубочковой фильтрации должна проводиться при применении данных препаратов с целью профилактики системной токсичности. Креатинин сыворотки не является надежным индикатором почечной функции среди пациентов пожилого возраста, т.к. снижение скорости клубочковой фильтрации может быть связано с саркопенией. Таким образом, при назначении нефротоксичных препаратов пациентам пожилого и старческого возраста крайне важно учитывать показатель клиренса креатинина [12].
Возраст может влиять на печеночный метаболизм, однако последствия этих изменений на противоопухолевое лекарственное лечение во многом не изучены [6]. Метаболизм лекарственных препаратов зависит от кровоснабжения печени, скорости выделения препарата гепатоцитами и массой гепатоцитов помимо активности ферментов, участвующих в метаболизме препарата. При снижении метаболизма и элиминации лекарств возможна экспозиция высокими дозами препаратов на протяжении долгого периода времени. Выделяют два типа реакций, метаболизирующих лекарственные препараты в печени [9]. Первый тип – это кислородоредуктивные реакции, при которых образуются активные и неактивные метаболиты препаратов, запускающие систему цитохрома P-450. Данные реакции зависят от других лекарственных средств, например от барбитуратов или антиконвульсантов, которые могут снизить или увеличить активность Р-450 ферментов. Второй тип – реакции конъюгации, в результате которых образуются водорастворимые вещества, экскретируемые с желчью или мочой. Несмотря на уменьшение массы и кровоснабжения печени, этих изменений не достаточно для рутинной модификации доз препаратов. Однако следует учитывать сопутствующие заболевания печени и опухолевую нагрузку при метастатическом поражении, которые могут обусловливать необходимую коррекцию доз цитостатиков.
Фармакодинамика
Фармакодинамичекие изменения могут влиять как на токсичность, так и на противопухолевую активность цитостатических препаратов. Распространенность гена MDR-1 (ген множественной лекарственной устойчивости) повышена среди пациентов 60 лет и старше при остром миелоидном лейкозе [13]. Р-гликопротеин кодируется MDR-1-геном и отвечает за выброс противоопухолевых агентов растительного происхождения из опухолевых клеток. Также опухоли, возникающие у пожилых людей, характеризуются резистентностью к апоптозу, т.к. развиваются из «устаревших» клеток, уже не способных подвергаться апоптозу. В связи с ухудшением ангиогенеза у пожилых людей опухоли обладают скудным снабжением кислорода [11]. Аноксия может быть причиной снижения чувствительности к цитостатикам и лучевой терапии.
Токсичность ХТ у больных пожилого возраста
Восприимчивость организма пожилого человека к токсичности цитостатической терапии может быть усилена следующими тремя механизмами [6]:
- сниженный резерв стволовых клеток, которые отвечают за восстановление тканей. Данный механизм может быть причиной осложнений со стороны быстро обновляющихся тканей, включая гемопоэз и слизистые оболочки;
- уменьшение катаболизма цитостатиков и восстановления клеток после их повреждающего действия;
- критическое уменьшение функционирующей ткани может приводить к недостаточности системы органов; данный механизм ответствен за возникновение кардиоваскулярной токсичности и нейротоксичности.
Миелосупрессия
Резерв стволовых клеток костного мозга может снижаться с возрастом, что приводит к повышению гематологической токсичности при применении миелосупрессивных агентов, развитию нейтропении и анемии.
Согласно данным клинических исследований, риск развития миелосупресии существенно повышается в возрасте 65 лет и старше [11, 14, 15]. Снижение доз может компрометировать эффективность терапии, тогда как риск миелосупрессии снижается на 50% при применении колониестимулирующих факторов [16].
Нейтропения – основная дозолимитирующая токсичность, ассоциированная с проведением ХТ, особенно у пожилых людей. Среди пациентов пожилого возраста с агрессивной формой неходжскинской лимфомы проведение ХТ по схеме СНОР (циклофосфамид, доксорубицин, винкристин, преднизолон) частота развития лихорадки и нейтропении была существенно чаще у пациентов 70 лет и старше (42 против 8% у пациентов 61–69 лет; р<0,0001) [17].
Согласно мета-анализу клинических исследований, профилактическое применение рекомбинантного гранулоцитарного колониестимулирующего фактора (Г-КСФ) снижает риск развития фебрильной нейтропении [18]. Возникают некоторые опасения при комбинации Г-КСФ и ингибиторов топоизомеразы II в связи с увеличением риска развития острого лейкоза; однако данные противоречивы. Несмотря на предостережения, применение Г-КСФ служит лучшей стратегией лечения в этой группе пациентов. По рекомендациям Ассоциации онкологов России, назначение Г-КСФ показано в качестве первичной профилактики фебрильной нейтропении у пациентов 65 лет и старше, которым назначена ХТ с целью излечения, или у пациентов с агрессивным течением неходжскинской лимфомы при высокоинтенсивных режимах ХТ. Согласно рекомендациям Американского общества клинической онкологии, применение Г-КСФ оправданно при риске развития фебрильной нейтропении, равном 20% и выше.
Анемия
Анемия является фактором риска токсичности, ассоциированной с проведением ХТ, и одним из факторов, снижающих объем распределения лекарственного препарата, в результате чего возникает высокая пиковая концентрация и выраженная токсичность цитостатика [19].
Анемия часто возникает у больных злокачественными новообразованиями как осложнение основного заболевания и химиотерапевтического лечения. Эритропоэз-стимулирующие препараты (ЭСП), эпоэтин-α и дарбопоэтин-α оценивались в лечении онкологических пациентов. Целью лечения было предотвращение гемотрансфузий и возможных осложнений (перегрузка железом, передача инфекции, связанная с трансфузиями иммуносупрессия) и повышение качества жизни путем роста концентрации гемоглобина. Применение ЭСП пациентами с негематологическими новообразованиями ограниченно к применению и разрешено при условии анемии, ассоциированной с проведением ХТ. Согласно результатам рандомизированных исследований, отмечено уменьшение выживаемости и контроля заболевания среди пациентов, получающих эритропоэз-стимулирующие препараты для коррекции анемии и с целевым уровнем гемоглобина 120 г/л. Применение ЭСП также ассоциировано с увеличением риска развития венозного тромбоэмболизма и смертности. По рекомендациям Ассоциации онкологов России, применение ЭСП может считаться целесообразным для пациентов с умеренной анемией (концентрация гемоглобина менее 100 г/л), получающих ХТ, при наличии симптомов анемии или для предотвращения дальнейшего снижения концентрации гемоглобина, а также для пациентов с быстро снижающейся концентрацией гемоглобина вследствие ХТ.
Кардиоваскулярная токсичность
Заболевания сердечно-сосудистой системы (ССС) чаще возникают у пациентов старшего возраста по сравнению с таковыми молодого возраста.
Наличие сердечной недостаточности (СН), артериальной гипертензии, сахарного диабета, пожилого возра-ста, ранее проведенного лечения антрациклинами, высоких кумулятивных доз, коротких инфузий доксорубицина может увеличить риск развития СН, ассоциированной с применением антрациклинов и трастузумаба, или артериального вазоспазма при лечении фторпиримидинами [12]. Потенциальный риск, ассоциированный с проведением кардиотоксичной ХТ в популяции больных неходжскинской лимфомой пожилого возраста, был продемонстрирован Программой наблюдения, эпидемиологии и конечных результатов (SEER program – Surveillance, Epidemiology and End Results program) Национального института рака (National Cancer Institute) США. Риск развития СН достигал 29% среди тех пациентов, в лечении которых использовался доксорубицин.
Риск кардиомиопатии увеличивается с возрастом пациента, но он ограничен суммарной дозой препаратов (эквивалентной дозам доксорубицина orubicin ≥450 мг/м2). В отсутствие других факторов риска не обоснованно использование дополнительных мер предотвращения кардиоваскулярной токсичности. Длительная инфузия антрациклинов может приводить к повышению риска развития мукозита, а использование кардиопротектора дексразоксана – к усилению миелосупрессии и ослаблению противоопухолевой активности доксорубицина.
Особенности проведения таргетной терапии больным геронтологического профиля
Появление таргетных препаратов (моноклональных антител и малых молекул) значимо улучшило результаты лечения многих злокачественных новообразований. Таргетная терапия обладает менее выраженными, чем ХТ (ХТ может осложняться алопецией, фебрильной нейтропенией, тошнотой и рвотой), побочными эффектами. Таргетная терапия более предпочтительна по спектру токсичности для лечения больных пожилого возраста, однако следует проводить мониторинг некоторых нежелательных явлений.
При HER2-позитивном раке молочной железы трастузумаб был первой современной таргетной терапией, обладающей благоприятным профилем безопасности. При длительном наблюдении в исследовании HERA частота развития СН или дисфункции левого желудочка, отмены трастузумаба в связи с кардиологической патологией была низкой (0,8%, 3,6 и 5,1% соответственно) среди пациентов, получавших трастузумаб [20]. Однако в крупном ретроспективном популяционном исследовании пожилых больных раком молочной железы I–III стадий применение трастузумаба приводило к возникновению хронической СН в 30% случаев, что значительно выше, чем в данных клинических исследованиях [21]. Подгрупповой анализ клинического исследования, оценивавшего комбинацию трастузумаба с пертузумабом и доцетакселом среди пациентов, больных HER2+-метастатическим раком молочной железы (808 пациентов, 127>65 лет), не показал увеличения риска развития кардиотоксичности, ассоциированной с применением трастузумаба, также не наблюдалось отсроченной кардиотоксичности. Необходимы дополнительные данные относительно переносимости режимов среди пациентов пожилого возраста [22].
Ингибиторы ангиогенеза могут вызывать тромбоз и гипертонию, а возраст служит важным фактором риска. Например, объединенный анализ пациентов со всеми типами рака, получавших бевацизумаб, проведенный в пяти рандомизированных исследованиях, показал, что пациенты старше 65 лет подвергаются повышенному риску развития артериальных тромбоэмболических осложнений, особенно при применении бевацизумаба в комбинации с ХТ [23].
При применении ингибиторов тирозинкиназы ангиогенеза продемонстрирована более высокая частота СН, что вызывает большую озабоченность при назначении данной терапии больным пожилого возраста, которые имеют сопутствующую патологию ССС.
Помимо эффективности и токсичности все большее значение приобретают также затраты и экономическая эффективность новых (в основном дорогостоящих) лекарственных средств. Следует признать, что польза от новых лекарств может быть неодинаковой для пожилых и молодых людей. Конкурирующие риски смерти пожилых людей (т.е. смерть от другой причины, не имеющей отношения к онкологическому заболеванию) могут снижать экономическую эффективность дорогостоящих методов лечения. С другой стороны, пожилым людям не следует систематически отказывать в новых методах лечения, и предотвращение как недостаточного лечения, так и чрезмерного лечения остается главной проблемой онкологов, лечащих пожилых онкологических больных. Необходимо исследовать новые таргетные препараты в отношении пациентов старшего возраста с целью оценки эффективности и безопасности для этой определенной группы пациентов, учитывать сопутствующую патологию при назначении таргетной терапии [6, 23].
Особенности проведения иммунотерапии больным геронтологического профиля
Иммунная система пожилых онкологических больных характеризуется особенностями. Иммуностарение – это функциональное явление, развитие которого определяется как биологическим возрастом, так и другими факторами. Одно из составляющих иммуностарения – синдром хронического воспаления, рассматриваемый как системный провоспалительный статус – интенсивно исследуется у онкологических больных. Синдром хронического воспаления, сопровождающий развитие опухолевого процесса, у пожилых пациентов дополнительно усиливается за счет развития «воспалительного старения». Изменения в стареющей иммунной системе вносят вклад в воспалительные процессы: изменения в способности аутофагии, дисбактериоз и нарушение барьерной функции, нарушение в стволовых клетках, изменения внутриклеточных процессов, создание противоопухолевой среды [1].
Отличительным признаком иммуностарения рассматривается существенное снижение числа CD4+- Т-лимфоцитов в крови стареющих индивидуумов по сравнению с молодыми. Одна из причин этого явления – истощающийся с возрастом пул наивных Т-лимфоцитов, созревающих в тимусе. Вторая вероятная причина – конверсия наивных Т-лимфоцитов в Т-клетки памяти под воздействием различных антигенов в течение жизни [1].
Перераспределение субпопуляций Т-лимфоцитов приводит к увеличению восприимчивости к инфекциям и накоплению клеток иммунологической памяти ограниченного фенотипа. Снижение активности эффекторных Т-лимфоцитов обусловлено биохимическими изменениями в липидном составе мембран этих клеток – возрастным увеличением холестерина, способствующим снижению реактивности Т-лимфоцитов при встрече с чужеродными или измененными «своими» опухолевыми антигенами [1].
Использование современных иммуноонкологических препаратов, активирующих ключевые точки противоопухолевого иммунного ответа, становится перспективным направлением в лечении стареющих онкологических пациентов. Наращивание клонов аутологичных неоантиген-реактивных Т-лимфоцитов in vitro также открывает перспективы для разработки персонализированной иммунотерапии пожилых онкологических пациентов с диссеминированным опухолевым процессом.
Большинство анализов подгрупп и ретроспективных исследований сообщает о сходной клинической пользе как для молодых пациентов, так и для пожилых, и возраст не влияет на профиль токсичности иммунотерапии. При рассмотрении вопроса об иммунотерапии обязательно следует учитывать сопутствующую патологию, поскольку использование некоторых симптоматических методов лечения (таких, как антигистаминные препараты для лечения зуда) или кортикостероиды может подвергать пожилых пациентов ятрогенным явлениям, таким как ухудшение течения диабета, нарушение психического статуса, гипертония и делирий. Иммунотерапия улучшает общую выживаемость пациентов старшей возрастной группы и выживаемость без прогрессирования.
Пациенты часто принимают много дополнительных препаратов для лечения сопутствующих заболеваний, существует такой гериатрический синдром, как полипрагмазия (одновременный прием множества лекарственных средств), но на настоящий момент отсутствуют данные о каких-либо взаимодействиях иммунотерапии с другими лекарственными препаратами [24–26].
Комплексная гериатрическая оценка и инструменты скрининга для пожилых людей
Приблизительно половина пациентов в возрасте 70 лет и старше функционально считаются «пожилыми людьми» и могут лечиться стандартным онкологическим подходом. Однако другой половине потребуется более комплексный уход, включая всестороннюю гериатрическую оценку (ГО). Задача для онколога состоит в установлении различия между этими двумя популяциями. Исследования в области гериатрической онкологии выявили эффективные инструменты краткого скрининга, которые могут быть использованы в условиях ограниченного времени. Некоторые из них действительно были протестированы в отделениях неотложной помощи, затем адаптированы для использования в условиях онкологических отделений. Общее обследование пожилого больного злокачественным новообразованием представлено на рисунке.
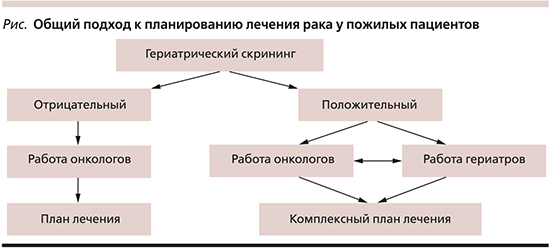
Следует отметить важность раннего гериатрического скрининга. При необходимости его возможно провести в течение 2–4 недель в процессе дообследования по поводу злокачественного новообразования. Далее приводятся ресурсы для реализации этого двухэтапного подхода к онкогериатрической оценке пожилых больных злокачественными новообразованиями [6, 8, 23, 27].
Краткие гериатрические опросники для скрининга
Это опросники быстрого отбора пациентов, содержащие вопросы, ответы на которые занимают всего несколько минут. Их можно широко использовать для отбора пожилых пациентов, нуждающихся в дальнейшей обработке.
Международное общество гериатрической онкологии (SIOG– International Society of Geriatric Oncology) опубликовало обширный систематический обзор доступных опросников. В обзоре выявлено 44 исследования, в которых сообщалось об использовании 17 различных опросников для скрининга пожилых больных раком. Наиболее изученные опросники этих пациентов — это G8, фламандская версия опросника скрининга рисков Triage (fTRST) и Vulnerable Elders Survey-13 (VES-13).
Достоверность большинства скрининговых тестов проверена с помощью гериатрических опросников и/или оценки гериатра. Во всех исследованиях наивысшая чувствительность наблюдалась для следующих опросников: G8, fTRST, онкогериатрического скрининга, исследования остеопорозных переломов, ECOG, скрининга онкологической программы для пожилых людей (SAOP) 2.
Ни один из этих опросников не специфичен, поэтому если он положительный, его необходимо дополнить более полной ГО. Однако результаты скрининга помогают сосредоточить гериатрические ресурсы на тех пациентах, которые в них больше всего нуждаются [6, 8, 23, 27].
Краткий гериатрический скрининг
Согласно краткому гериатрическому скринингу, рекомендованному Комитетом по здравоохранению Санкт-Петербурга в распоряжении от 12.09. 2014 № 732-р, основными критериями оценки являются способность пациента к самообслуживанию; когнитивные функции; астения; возраст-ассоциированные заболевания; физическое состояние и возраст. По результатам скрининга пациенты стратифицируются на три группы в зависимости от набранных баллов [11, 12]:
I. 0–7 баллов. Больные, ведущие активный образ жизни, самостоятельно обслуживающие себя, имеющие адекватный интеллектуальный уровень, без тяжелых сопутствующих заболеваний, гериатрических синдромов и полипрагмазии. Пациентам данной категории возможно назначение стандартных режимов ХТ.
II. 8–30 баллов. Больные, частично нуждающиеся в посторонней помощи и страдающие двумя и более сопутствующими заболеваниями. Всем пациентам данной группы была назначена полихимиотерапия с исходной редукцией доз препаратов на 25% и последующей их коррекцией в зависимости от переносимости.
III. 31–42 балла. Больные, нуждающиеся в постоянной посторонней помощи, отягощенные тремя и более сопутствующими заболеваниями, имеющие признаки старческой астении. В таком случае пациентам показана симптоматическая терапия.
Комплексная ГО
Если пациент дает положительный результат на скрининг с помощью кратких опросников, описанных выше, необходима последующая оценка. Формат дальнейшей оценки в значительной степени зависит от имеющихся возможностей: в некоторых учреждениях существует команда специалистов в гериатрической онкологии, у других – гериатрическая консультационная служба; некоторые центры объединили амбулаторные консультации гериатра и онколога; в других случаях единственной возможностью для медицинской бригады может быть использование гериатрических инструментов в онкологической практике.
К важным составляющим ГО относятся функциональный статус, сопутствующая патология, когнитивные способности, состояние психического здоровья, питание, социальный статус и поддержка, утомляемость, оценка полипрагмазии, наличие гериатрических синдромов. Для оценки этих факторов доступны различные инструменты.
Имеются убедительные данные об эффективности гериатрической помощи. Международное общество гериатрической онкологии (SIOG) опубликовало обновление своих рекомендаций еще в 2005 г. Помимо способности комплексной ГО выявлять скрытые проблемы в настоящее время существуют убедительные доказательства того, что эти факторы влияют на прогноз независимо от классических онкологических предикторных факторов. Элементы комплексной ГО могут предсказать вероятность выживаемости или осложнения лечения. В настоящее время есть несколько исследований, демонстрирующих, что проведение комплексной ГО может изменить тактику ведения пациентов, больных раком [5]. Комплексная ГО онкологических больных старше 60 лет может приводить 20–49% пациентов к изменению стратегии лечения, поскольку позволяет прогнозировать общую выживаемость, токсический профиль противоопухолевой терапии и выбирать оптимальную интенсивность лечения [6, 28, 29].
Средний показатель модификаций лечения составил 21,5% (диапазон: 0–49%). Он не учитывает вспомогательных вмешательств, направленных на гериатрические проблемы, не связанные с опухолями. Изменения могут быть в сторону либо усиления, либо уменьшения лечения [30].
Заключение
- Старение ассоциировано с уменьшением резервных функций многих систем организма онкологического пациента, что может влиять на фармакокинетику и фармакодинамику противоопухолевых препаратов.
- Восприимчивость организма онкологического пациента пожилого и старческого возраста к токсичности цитостатической терапии может быть усилена следующими тремя механизмами: сниженный резерв стволовых клеток, отвечающих за восстановление тканей (данный механизм может быть причиной осложнений со стороны быстро обновляющихся тканей, включая гемопоэз и слизистые оболочки); уменьшение катаболизма цитостатиков и восстановления клеток после их повреждающего действия, а также критическое уменьшение функционирующей ткани, способное приводить к полиорганной недостаточности.
- Таргетная терапия обладает менее выраженными, чем ХТ, побочными эффектами, что делает ее более предпочтительной для лечения больных пожилого возраста, однако следует проводить мониторинг нежелательных явлений. Необходимо исследовать новые таргетные препараты, применяемые в отношении пациентов пожилого и старческого возраста для оценки их эффективности и безопасности для пациентов этой определенной группы с учетом сопутствующей патологии при назначении таргетной терапии.
- Иммуностарение – это функциональное явление, развитие которого определяется как биологическим возрастом, так и другими факторами. Синдром хронического воспаления, сопровождающий развитие опухолевого процесса у пожилых пациентов, дополнительно усиливается за счет развития «воспалительного старения»: изменений в способности аутофагии, дисбактериоза и нарушения барьерной функции, нарушения в стволовых клетках, изменения внутриклеточных процессов, создания противоопухолевой среды. Использование современных иммуноонкологических препаратов, активирующих ключевые точки противоопухолевого иммунного ответа, – перспективное направление в лечении стареющих онкологических пациентов. Иммунотерапия улучшает общую выживаемость пациентов старшей возрастной группы и выживаемость без прогрессирования. При рассмотрении вопроса об иммунотерапии обязательно следует учитывать сопутствующую патологию, поскольку использование, например, кортикостероидов может ухудшать течение диабета, гипертонии, нарушить психический статус.
- Старение ассоциировано с прогрессивным уменьшением функционального резерва многих систем органов и снижением переносимости физического и психоэмоционального стресса. Физиологические и когнитивные изменения не всегда коррелируют с хронологическим возрастом и наилучшим образом должны быть оценены с применением комплексной оценки пациента пожилого возраста. Комплексная ГО онкологических больных старше 60 лет может приводить к изменению стратегии лечения 20–49% пациентов, поскольку позволяет прогнозировать общую выживаемость, токсический профиль противоопухолевой терапии и выбирать оптимальную интенсивность лечения.



