Проблема ишемического инсульта сохраняет чрезвычайную медицинскую и социальную значимость вследствие высоких показателей заболеваемости, смертности и инвалидизации [1]. Тромболитическая терапия с использованием рекомбинантного тканевого активатора плазминогена, а также метод тромбэкстракции – наиболее эффективные методы лечения ишемического инсульта в первые часы от начала развития заболевания [2], однако частота реперфузионной терапии составляет не более 20–30% от числа всех пациентов с ишемическим инсультом [3–5]. Несмотря на положительные результаты экспериментальных исследований нейропротекторов [6], эффективность данной группы препаратов в клинических исследованиях не была подтверждена [7–9], что может быть связано с неадекватными моделями ишемии у животных [10], а также с дизайном исследований с участием человека. Как следствие – терапия, направленная на коррекцию одного биохимического или молекулярного этапа патофизиологического каскада ишемического повреждения клеток, не приводит к успеху при инсульте, что говорит о необходимости изучения мультимодальной терапии, включающей лекарственные соединения, действующие на несколько связанных патофизиологических звеньев. Одним из препаратов с мультимодальным действием является церебролизин, представляющий собой комплекс низкомолекулярных нейролептидов (<10 кДа) и свободных аминокислот, получаемых из головного мозга свиньи с помощью стандартного производственного процесса. В экспериментальных исследованиях было показано, что церебролизин эффективен в отношении эксайтотоксичности, подавляет образование свободных радикалов, активацию микроглии/нейровоспаление и активацию калпаина/апоптоз. Кроме того, было продемонстрировано, что он проявляет нейротрофическую активность: способствует спраутингу нейронов, повышает выживаемость клеток и стимулирует нейрогенез [11–15].
Опубликованы результаты нескольких некрупных клинических исследований в остром периоде ишемического инсульта [16–19], однако в данных работах выборки были небольшого размера, преимущественно включавшие от 50 до 200 рандомизированных пациентов. Ретроспективный подгрупповой анализ (n=252), основанный на данных более крупномасштабного рандомизированного двойного слепого плацебо-контролируемого исследования CASTA, выявил тенденцию к снижению летальности и улучшению состояния пациентов с более тяжелым инсультом в группе, получавшей церебролизин (с баллом при поступлении по шкале NIHSS >12) [20]. Терапию в вышеуказанных клинических исследованиях начинали в первые 12–48 часов от начала инсульта и обычно проводили в течение 10 дней, более длительное применение препарата ранее не изучалось. В январе 2016 г. были опубликованы результаты проспективного рандомизированного двойного слепого плацебо-контролируемого многоцентрового исследования CARS («Церебролизин и восстановление после инсульта»), целью которого стало изучение эффективности и безопасности препарата церебролизин в период восстановления после перенесенного инсульта на фоне проведения реабилитационных мероприятий [21].

В многоцентровое исследование CARS церебролизин или плацебо в суточной дозе 30 мл вводили один раз в сутки в течение 21 дня инфузионно в течение 20 минут в период от 24 до 72 часов от начала инсульта. Каждому пациенту, включенному в данное исследование, проводилась стандартизированная программа реабилитации длительностью 21 день (5 дней/нед по 2 ч/сут), состоявшая из массажа, пассивных и активных движений верхними и нижними конечностями. После выписки пациенты продолжали занятия 2 раза по 15 минут 3 дня в неделю. Продолжительность исследования для каждого пациента составила 90 дней.
В исследование включены пациенты в возрасте от 18 до 80 лет с полушарным ишемическим инсультом (верифицированным при помощи компьютерной томографии или магнитно-резонансной томографии) объемом более 4 см3. У пациентов, включенных в исследование, до инсульта не наблюдалось значимых нарушений (балл до инсульта по модифицированной шкале Рэнкина [МШР] составил 0–1), в течение предыдущих 3 месяцев они не переносили инсульт, балл теста оценки функции руки [22] (ARAT) составлял менее 50 (оценка в диапазоне от 0 [функциональная активность отсутствует] до 57 [нарушения отсутствуют]), а балл по коммуникационной шкале Гудгласса и Каплана [23, 24] составлял более 2 (из расчета от 0 [тяжелая афазия] до 5 [минимальная афазия]). Пациентов исключали из исследования по следующим причинам: прогрессирующий или нестабильный инсульт; наличие в анамнезе или во время исследования активного неврологического или психического заболевания; значимая алкогольная или наркотическая зависимость в течение предыдущих 3 лет; заболевание печени, почек, сердца или легких на поздних стадиях; ожидаемая выживаемость менее 1 года; значительное снижение сознания на момент рандомизации; любое состояние, которое представляет собой противопоказание к введению препарата церебролизин, в т.ч. аллергии; беременность или период грудного вскармливания, или участие в другом исследовании инсульта или восстановление после инсульта.
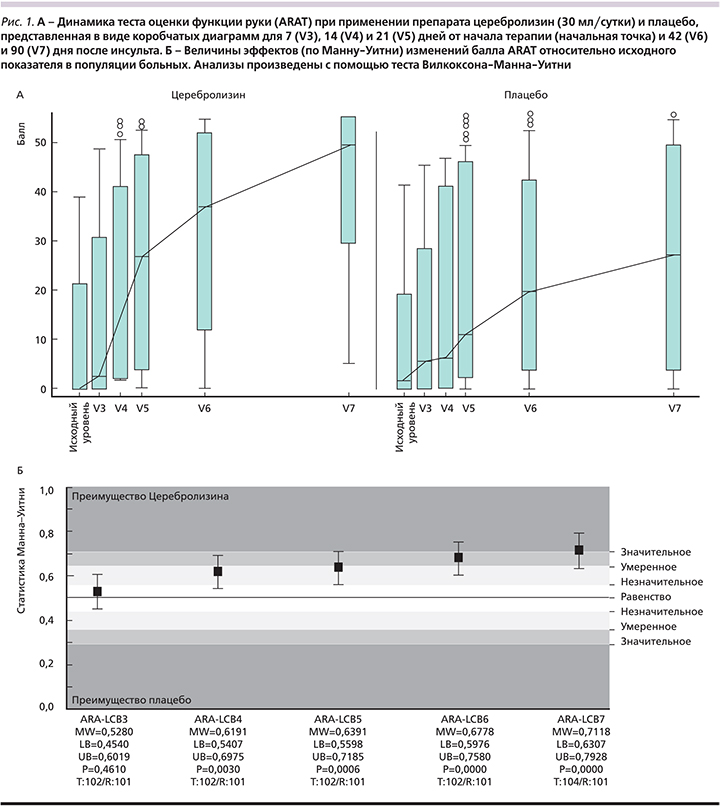
Первичным критерием эффективности в исследовании CARS служило изменение балла по шкале ARAT [22]. Данную шкалу использовали для оценки двигательной активности верхних конечностей от начала терапии (исходный уровень) до 90-го дня. Вторичные критерии эффективности: изменения скорости ходьбы (тест на скорость ходьбы), функции тонкой моторики (тест девятью отверстиями и стержнями), общего неврологического дефицита (NIHSS), уровня нарушений или зависимости в повседневной жизни (Индекс Бартел, МШР), степени афазии (коммуникационная шкала Гудгласса и Каплана) [23, 24], степени игнорирования (тест вычеркивания линий, тест на выявление пропусков), качества жизни (краткая оценка состояния здоровья по 36 пунктам [SF-36], сводный балл физического компонента и сводный балл психического компонента) и степени депрессии (Гериатрическая шкала депрессии) начиная от исходного уровня до 21-го (последний день, когда вводили исследуемый препарат) и 90-го дня.
Из-за поискового характера данного исследования фазы II официальный расчет размера выборки, аналогичный проводимому для подтверждающих исследований, не проводили. Тем не менее в результате неофициального расчета размера выборки для предполагаемого включения 2×112 пациентов было получено значение мощности, равное 80% (частота ошибки II рода; р=0,20), с разницей стандартизированного среднего в 0,376 при уровне значимости (уровень ошибки I рода), α=0,05 (двусторонний t-тест; nQuery Advisor, версия 6.0).
Все анализы выполняли на модифицированной популяции в соответствии с рандомизацией (mITT) с использованием метода переноса данных последнего наблюдения (ПДПН) при обработке недостающих данных. Анализируемую выборку mITT определяли как всех рандомизированных пациентов, получивших хотя бы 1 дозу исследуемого препарата, для которых были получены оценки для первичной конечной точки в начале исследования и по меньшей мере для 1 временной точки после применения первой дозы исследуемого препарата.

Анализы чувствительности проводили с помощью анализа наблюдаемых случаев (OC). Ни у одного пациента в популяции mITT не было зарегистрировано серьезного нарушения протокола; таким образом, популяция mITT и популяция, выполнившая требования протокола, были идентичными. Перед началом исследования первичный анализ в подгруппах был определен для пациентов, у которых исходные баллы по шкале ARAT были больше.
В данное исследование были включены 208 пациентов в период с апреля 2008 по сентябрь 2010 г. Все пациенты получили минимум 1 дозу исследуемого препарата или плацебо (церебролизин, n=104; плацебо, n=104), 12 пациентов преждевременно прекратили участие в исследовании: из-за наличия нежелательных явлений (НЯ; церебролизин, n=2; плацебо, n=5) были выведены по собственному желанию (церебролизин, n=2; плацебо, n=2) или по административным причинам (плацебо, n=1). Для троих из этих пациентов, все из группы плацебо, отсутствовали данные, полученные после исходного уровня, и, таким образом, их исключили из анализируемой популяции mITT. Для популяции mITT другие серьезные нарушения протокола отсутствовали; таким образом, как mITT, так и популяция, выполнившая требования протокола, состояли из 205 пациентов.
Исходные базисные и демографические характеристики пациентов были сопоставимыми между группами (табл. 1 и 2). Средний возраст больных составил 64 года, 63,9% пациентов были мужского пола, средний балл по шкале NIHSS при поступлении был 9,2 (медиана – 8,0).
Анализ первичного критерия эффективности показал увеличение балла по шкале ARAT с 10,1±15,9 (0,0; 21,5) баллов при включении в исследование (среднее±стандартное отклонение [СО], медиана, межквартильный размах [МКР]) до 40,7±20,2 (51,0; 28,0) балла на 90-й день в группе, получавшей церебролизин, и от 10,7±16,5 (2,0; 18,0) до 26,5±21,0 (27,0; 44,0) балла в группе плацебо (рис. 1А).
Средние абсолютные изменения баллов по шкале ARAT на 90-й день после инсульта по сравнению с исходными значениями составили 30,7±19,9 (32,0; 36,5) в группе церебролизина и 15,9 ±16,8 (11,0; 22,0) в группе плацебо. Увеличение балла по ARAT наблюдалось у 96 из 104 (92,3%) пациентов группы препарата церебролизин по сравнению с 85 из 101 (84,2%) пациента, получавшего плацебо. Непараметрический анализ продемонстрировал превосходство препарата церебролизин по сравнению с плацебо на 90-й день (рис. 1Б).
Анализ вторичных критериев эффективности позволил также выявить существенные различия между группами, получавшими церебролизин и плацебо, по другим шкалам. Хорошая степень функционального восстановления (балл по МШР от 0 до 1) была зарегистрирована у 42,3% пациентов в группе церебролизина по сравнению с 14,9% в группе плацебо, и аналогичные результаты были получены для баллов МШР от 0 до 2 (рис. 2).
Умеренное превосходство препарата церебролизин наблюдалось по 6 из 12 критерий эффективности, включая ARAT, NIHSS, индекс Бартел, mRS, SF-36 (общий физический компонент) и по шкале депрессии (Гериатрическая шкала депрессии). Незначительное превосходство препарата церебролизин было продемонстрировано с помощью теста скорости ходьбы, теста с девятью отверстиями и стержнями, коммуникационной шкалы Гудгласса и Каплана и SF-36 (общий психический компонент).
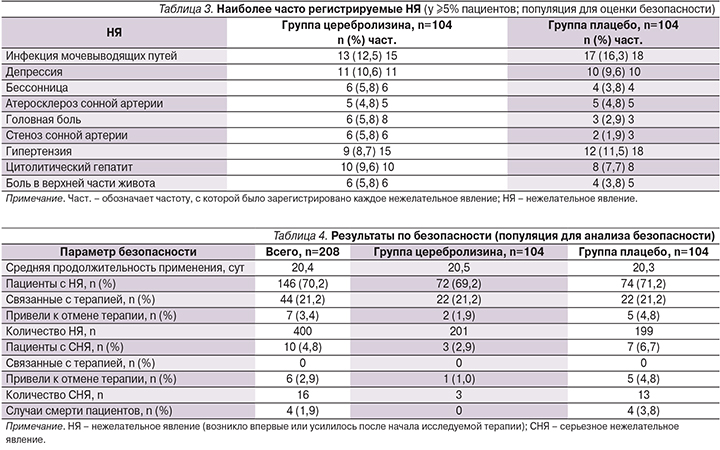
У 69,2% пациентов, получавших церебролизин, зарегистрировано по меньшей мере одно НЯ по сравнению с 71,2% пациентов в группе плацебо. Большинство НЯ имели легкую степень (церебролизин – 76,1%; плацебо – 69,8%). Обзор наиболее часто возникавших во время лечения НЯ, описанных по меньшей мере у 5% пациентов в любой группе, приведен в табл. 3.
У 3 пациентов группы препарата церебролизин (2,9%) и 7 – группы плацебо (6,7%) зарегистрированы серьезные НЯ (СНЯ), ни одно из которых не было оценено как связанное с исследуемыми препаратами (табл. 4). СНЯ в группе препарата церебролизин включали тяжелую периферическую ишемию, почечные колики (умеренная интенсивность) и острый инфаркт миокарда.
Все данные СНЯ разрешились в течение периода исследования. В группе плацебо умерли 4 (3,8%) пациента. Причиной летальных исходов стали сепсис с острой почечной недостаточностью и комой, сепсис с полиорганной недостаточностью, ишемия кишечника, субдуральная и внутримозговая гематомы. В группе, получавшей церебролизин, летальных исходов не было.
Таким образом, результаты рандомизированного плацебо-контролируемого многоцентрового исследования CARS продемонстрировали положительный эффект применения препарата церебролизин по сравнению с плацебо по первичному критерию эффективности, баллу по шкале ARAT и общему исходу спустя 90 дней.
В данном исследовании принимали участие преимущественно пациенты с умеренным или тяжелым инсультом (средний исходный балл по шкале NIHSS – 9), т.к. гипотезообразующий анализ в подгруппах в исследовании CASTA [20] выявил тенденцию к более высоким результатам после терапии препаратом церебролизин пациентов с баллом по шкале NIHSS более 12 (n=246). Данный подгрупповой анализ показал, что после терапии препаратом церебролизин у пациентов наблюдается улучшение баллов по шкале NIHSS на 3 пункта на 90-й день по сравнению с группой плацебо и выявил величину эффекта, указывающую на умеренное превосходство препарата церебролизин по сравнению с плацебо для всех доменов комбинированной конечной точки (NIHSS, индекс Бартел и МШР).
Исследование CARS также подтверждает результаты предыдущего исследования W Lang. и соавт., в котором церебролизин вводили в течение 10 дней системного тромболизиса, после чего отмечено выраженное улучшение в течение первых 30 дней от начала заболевания [19]. Однако с течением времени различия между двумя группами исчезали и становились незначимыми через 90 дней после начала инсульта (балл по МШР 0 был выявлен у 30,4% пациентов группы препарата церебролизин по сравнению с 23,7% пациентов группы плацебо), отсутствие существенных нарушений жизнедеятельности (балл по МШР – 1) наблюдалось у 21,4% пациентов группы, получавшей церебролизин, и у 28,8% пациентов, получавших плацебо. Положительные эффекты от применения препарата церебролизин в исследовании CARS наблюдались в течение более длительного периода лечения, составившего 21 день; кроме того, выявлены более низкие темпы полного восстановления пациентов группы плацебо. Низкий уровень спонтанного восстановления в группе плацебо может быть связан с включением пациентов с умеренным или тяжелым инсультом (среднее значение исходного балла по шкале NIHSS – 9). Сложно напрямую сравнивать результаты исследования CARS с предыдущими исследованиями препарата церебролизин, т.к. в данном исследовании в обеих группах активно проводились реабилитационные мероприятия. Кроме того, раннее начало восстановительной терапии, возможно, оказало влияние на наблюдавшиеся исходы, что проявилось в более быстром начальном улучшении клинического состояния.
Таким образом, к особенностям исследования CARS по сравнению с другими клиническими испытаниями нейропротекторов отнесены исходное планирование более узких конечных критериев эффективности (восстановление двигательной функции руки, тогда как во многих исследованиях главной целью было снижение летальности), а также стандартизованная программа реабилитации в обеих группах лечения (как правило, ранее в подобных исследованиях характер и объем реабилитационных мероприятий не учитывались, несмотря на то что таковые мероприятия могут оказать существенное влияние на исход инсульта). Исследование CARS является первым среди ранее проведенных клинических испытаний нейропротекторов, в котором была достигнута первичная цель (восстановление двигательной функции), что открывает новые возможности для медикаментозной поддержки реабилитационных мероприятий в отношении больных ишемическим инсультом.



