Введение
Современные представления о механизмах повреждающего действия острой церебральной ишемии связаны с пониманием сложных соотношений между сосудистым обеспечением и морфофункциональным состоянием тканей головного мозга. Изучение показателей биоэлектрической активности коры головного мозга в оценке функционального состояния центральной нервной системы лиц с поражениями мозга различного генеза хорошо известно [1]. Применение метода количественного анализа электроэнцефалограммы (ЭЭГ) позволяет разработать математические модели церебрального инсульта различных локализаций и генеза, изучить их изменение в связи с применением медикаментозной терапии.
В работе Е.А. Жирмунской (1987) показано, что изменения ЭЭГ при инсульте неспецифичны и выражаются в дизритмии альфа-ритма, преобладании медленноволновой активности, острых волн в зоне поражения. Работ, посвященных анализу биоэлектрической активности мозга при ишемическом инсульте (ИИ) в бассейне средней мозговой артерии (СМА) в острейшем и остром периодах ИИ, недостаточно, а сопоставление данных математического анализа с нейропсихологическим исследованием практически не проводилось, что и послужило основанием выполнения данной работы.
Цель исследования: изучение возможности использования количественной электроэнцефалографии (КЭЭГ) в исследовании функционального состояния мозга больных, перенесших ИИ в бассейне СМА, в сопоставлении с данными нейропсихологического исследования.
Материал и методы
В региональном сосудистом центре ГБУЗ РБ «Больница скорой медицинской помощи» г. Уфы было проведено исследование 30 больных ИИ в бассейне СМА. Средний возраст больных обоих полов составил 61,63±1,9 года. По гендерному признаку преобладали мужчины – 19 (63,3%), женщин было 11 (36,7%). Соотношение мужчин и женщин составило 1,7:1. Всем пациентам осуществлено комплексное клинико-нейропсихологическое, инструментальное и лабораторные исследования. Запись ЭЭГ проведена продолжительностью 30 минут в первые сутки заболевания на 19-канальном безбумажном электроэнцефалографе фирмы «Nicolet» с локализацией электродов, установленных по международной схеме «10-20» с референтным ушным электродом. Всем пациентам наряду с изучением фоновой записи проведен анализ межполушарной когерентности и интегрального индекса. За норму мощностей ритмов ЭЭГ средних уровней межполушарной когерентности использованы данные В.С. Русинова [2]. Для оценки типов и ЭЭГ-паттернов использовали классификацию Е.А. Жирмунской (1991) и Г. Людерса (2000) [3, 4]. Также были тщательно проанализированы и изучены амбулаторные карты больных с целью выявления в преморбиде эмоциональных и когнитивных нарушений.
Для оценки двигательной и повседневной активности использованы показатели шкалы Рэнкина, индекса мобильности Ривермид, Бартела. С целью определения наличия когнитивных и тревожно-депрессивных расстройств проведено нейропсихологическое исследование с использованием следующих шкал: краткой шкалы исследования психических функций, или Mini-Mental State Examination (MMSE), Монреальской шкалы оценки когнитивных функций МоСА (Montreal Cognitive Assessment), шкалы реактивной и личностной тревожности Спилберга–Ханина, шкалы депрессии Бэка, госпитальной шкалы тревоги и депрессии HADS (Hospital Anxiety and Depression Scale). Для исследования вегетативной устойчивости и оценки степени выраженности вегетативных дисфункций применен опросник А.М. Вейна.
Статистическая обработка полученных результатов осуществлена с использованием программного обеспечения Excel Worksheet из пакета Microsoft Office (2013). Вычислены средняя арифметическая, стандартное отклонение и критерий достоверности (t), корреляция. За достоверные принимались различия на уровне значимости 95% при р<0,05.
Результаты исследования
В структуре соматической патологии преобладали артериальная гипертензия у 27 (90%) больных, ишемическая болезнь сердца у 25 (83,3%), сахарный диабет у 8 (26,7%), дислипидемия у 7 (23,3%), фибрилляция предсердий у 6 (20%), метаболический синдром у 3 (10%). Аортокоронарное шунтирование присутствовало в анамнезе у 1 (3,3%) больного. По подтипам ИИ различали: неуточненный подтип – у 16 (53,3%) пациентов, лакунарный подтип – у 6 (20%), кардиоэмболический – у 5 (16,7%); атеротромботический – у 3 (10%). Преобладали больные с очагами инсульта в зоне СМА в левом полушарии – 18 (60%), у 12 (40%) очаг находился в правом полушарии. По данным ультразвукового дуплексного сканирования (УЗДС), у 20 (66,7%) больных выявлен стенозирующий атеросклероз магистральных артерий головы, причем у 3 (10%) – стеноз более 50%, у 1 (3,3%) – окклюзия, у 8 (26,6%) – нестенозирующий атеросклероз. Лишь у 2 (6,7%) больных данные УЗДС были в пределах нормы.
Неврологический дефицит по шкале NIHSS (National Institutes of Health Stroke Scale) у больных в среднем составил 5,1±0,2 балла. При поступлении средний балл индекса мобильности Ривермид составил 5,4±0,6; по шкале Рэнкина – 2,0±0,3; по шкале Бартела – 69,1±5,0; по опроснику Вейна – 34,2±4,3.
В неврологическом статусе преобладали двигательные расстройства у 19 (63,3%) больных в виде гемипареза различной степени выраженности: легкий гемипарез – у 12 (40%), неравномерный гемипарез – у 4 (13,3%), пирамидная недостаточность – у 2 (6,7%), глубокий – у 1 (3,3 %). Речевые нарушения представлены в виде моторной афазии у 5 (16,7%) больных, дизартрии – у 4 (13,3%), сочетание амнестической и сенсорной афазии – у 2 (6,6%), элементы сенсомоторной афазии – у 1 (3,3%).
Нарушения чувствительности по гемитипу были у 9 (30%) больных.
Анализ исследования интеллектуально-мнестической, эмоционально-аффективной сфер с применением шкал выявил наличие когнитивных, тревожно-депрессивных расстройств различной степени выраженности в острейшем и остром периодах ИИ. При поступлении средний балл по тесту MMSE составил 22,7±1,3, по тесту МоСА – 19,7±1,5, по шкале Бэка – 16,3±1,4, по шкале HADS (уровень депрессии) – 7,3±0,6, по шкале HADS (уровень тревожности) – 8,0±0,5, по шкале Спилберга–Ханина (уровень реактивной тревожности) – 33,1±3,5. Только у 4 (13,3%) больных определены показатели шкалы личностной тревожности Спилберга–Ханина, остальные 26 (86,7%) отказались, ссылаясь на плохое самочувствие и нежелание отвечать на вопросы данной шкалы. Когнитивные функции выявлены по шкале MMSE у 24 (80%) больных, из них деменция – у 2 (6,7%), по шкале МоСА – у 23 (76,7%), из них деменция – у 4 (13,3%). Депрессивные расстройства по шкале HADS (депрессия) определены у 19 (63,3%) больных, тяжелая депрессия – у 3 (10%), по шкале Бэка – у 26 (86,7%) и у 2 (6,7%) соответственно. Тревожные расстройства по шкале Спилберга–Ханина определены у 12 (40%) больных, из них выраженная тревога – у 3 (10%), по шкале HADS (тревога) – у 20 (66,7%), выраженная тревога – у 4 (13,3%).
При анализе ЭЭГ оценивались спектры мощности и частоты альфа-, бета1-, тета- и дельта-ритмов, что отражено в табл. 1–5.

Из приведенных данных видно, что по сравнению с контралатеральным полушарием в пораженном полушарии в центральном и затылочном отведениях выявляется тенденция к снижению мощности ритмов, не достигающая достоверности, в то время как в лобных и височных отведениях отмечается тенденция к повышению мощности в пораженном полушарии, вероятно, за счет преобладания медленной активности. Зональные различия распределения мощности сохранены. Наименьшая суммарная мощность определена в височных отведениях. Снижение общей мощности ритмов, видимо, можно объяснить ишемией головного мозга, особенно выраженной в пораженном полушарии.
Как видно из табл. 3, при сравнении с контралатеральным полушарием мощность альфа-ритма в пораженном полушарии достоверно снижена в височных отведениях, Также выявлена тенденция к снижению мощности альфа-ритма в центральном и лобном отведениях, более выраженная на стороне поражения.

Как видно из приведенных данных, отмечается снижение частоты альфа-ритма как в пораженном, так и в контралатеральном полушарии по сравнению с нормой. Наиболее пораженными оказались центральные и височные области пораженного полушария. Достоверно снижена частота альфа-ритма в центральном и височном отведениях. Наиболее выражена асимметрия частоты альфа-ритма между пораженным и контралатеральным полушарием в центральном и височных отведениях, т.к. эти отведения соответствуют зоне проекции прецентральной извилины.
Амплитуда альфа-ритма у пациентов с ИИ в каротидном бассейне оказалась достоверно сниженной: средняя амплитуда альф-ритма в затылочных отведениях составила 29,7±7,1 мкВ.
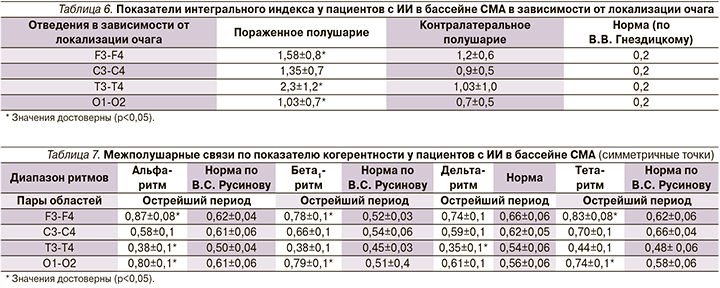
Для оценки степени изменений представительства спектральных составляющих в различных частотных диапазонах использованы полиспектральные индексы (отношение суммарных изменений в низкочастотной области ЭЭГ – тета+дельта к изменениям в высокочастотных областях – альфа+бета1), представленные в табл. 6, 7 (В.В. Гнездицкий, 2000) [4].
При анализе мощности бета1-ритма выявлена тенденция к снижению мощности данного ритма у пациентов по сравнению с нормой, не достигающая границ достоверности.
Мощность дельта-ритма оказалась сниженной во всех отведениях по сравнению с нормой. Выявилась асимметрия мощности дельта-ритма в пораженном и контралатеральном полушариях, особенно наглядная в лобных отведениях. С тяжестью инсульта коррелирует мощность дельта-волн на стороне очага. Выявлена умеренная обратная связь между мощностью дельта-волн и тяжестью инсульта (r=-0,29).
Из табл. 6 видно, что интегральный индекс повышен как в пораженном, так и в контралатеральном полушарии. Однако статистически значимые грубые нарушения выявляются в височных и центральном отведениях.
Межполушарные уровни когерентности характеризуются бóльшими значениями в лобных отделах коры, что свидетельствует о наиболее согласованной их деятельности по сравнению с другими корковыми зонами [5, 6]. Анализ межполушарных связей по показателю когерентности по различным диапазонам ритмов ЭЭГ у пациентов с ИИ в бассейне СМА представлены в табл. 7.
Как видно из представленной табл. 7, в острейшем периоде ИИ выявлено достоверное повышение межполушарной когерентности по альфа-, бета- и тета-диапазонам, в лобных и затылочных отведениях по альфа- и бета-диапазонам, в центральных отведениях тенденция к снижению межполушарной когерентности по всем диапазонам частот, достоверно снижена межполушарная когерентность по альфа- и тета-ритмам в височных отведениях. Отмечаются нарушения региональных различий у пациентов с ИИ: при достаточно высокой связи в лобных отведениях, выявлена также высокая связь по альфа-ритму и в затылочных отведениях (в норме когерентность в затылочных отведениях ниже). Общее снижение межполушарной когерентности в острейшем периоде ИИ и ее патологическое повышение в диапазоне низких частот (дельта и тета), вызывают нарушение функциональных связей электрических процессов коры головного мозга, обеспечивающих нормальную нервно-психическую деятельность человека [5, 6].
Обсуждение
Проведенный нами математический анализ ЭЭГ установил определенные корреляции между выраженностью нарушений электрогенеза коры и высшими мозговыми функциями. Выявлена умеренная прямая связь между когнитивной деятельностью и показателями частоты альфа-ритма: чем выше частота альфа-ритма, тем более выраженными были когнитивные нарушения (r=0,36). Выявлена умеренная обратная связь между амплитудой альфа-ритма и когнитивной деятельностью: чем ниже амплитуда альфа-ритма, тем более выраженными были когнитивные нарушения (r=-0,27). Установлена умеренная прямая связь между когнитивной деятельностью и показателями межполушарной когерентности по дельта-, тета- и альфа-ритмам в височных областях: чем ниже показатели межполушарной когерентности, тем более выраженными были когнитивные нарушения (r=0,27).
Заключение
Таким образом, в результате проведенного исследования установлено, что постинсультные когнитивные и тревожно-депрессивные расстройства выявляются уже в острейшем и остром периодах ИИ. Несомненно, депрессивные и когнитивные расстройства, влияющие на активную самостоятельную работу больных и их сотрудничество с членами мультидисциплинарной команды, негативно влияют на реабилитационный процесс. Кроме того, пациенты с легкими и умеренными когнитивными расстройствами имеют высокий риск развития деменции, что требует их диагностики и коррекции на раннем этапе заболевания.
При углубленном анализе ЭЭГ у пациентов с ИИ с локализацией очага в бассейне СМА выявлено, что наиболее выраженные изменения в виде преобладания медленноволновой активности, снижения уровня межполушарной когерентности регистрируются преимущественно в височных и центральной областях – на стороне поражения уже в острейшем периоде ИИ. Показатели межполушарной когерентности биоэлектрической активности мозга в височной области на стороне поражения коррелируют с данными нейропсихологического тестирования. Данные нейропсихологического исследования сопоставимы с таковыми ЭЭГ, что позволяет высказать суждение о преимущественном поражении медиобазальных структур височной области, играющих важную роль в мнестической деятельности, уже в остром периоде ИИ.
Определение полиспектральных индексов может быть рекомендовано для определения степени нарушения биоэлектрической активности мозга при мониторинге ЭЭГ-активности у больных с полушарным ИИ.



